CT肺密度和肺气肿体积对肺癌患者术后肺功能及肺部并发症的相关性分析
2023-12-14徐志富张燕妮沈占贤王锡丽
徐志富 张燕妮 沈占贤 王锡丽
肺癌是全球癌症死亡的主要原因之一,手术切除是局限性肺癌患者的首选疗法,对待手术患者进行肺评估,可确定围手术期并发症风险[1]。美国胸科医师学会的指南指出,肺癌患者应在术前测量一秒钟用力呼气量(forced expiratory volume in one second,FEV1)和一氧化碳弥散量(diffusing capacity of carbon monoxide,DLCO)。如FEV1和DLCO≥预测值的60%,患者并发症风险较低,如FEV1或DLCO<预测值的60%,建议通过定量肺部扫描或心肺运动试验进一步评估[2]。肺气肿在解剖学上定义为终末细支气管远端空间的异常永久性扩大,平均肺密度测定常用于评估慢性肺气肿肺实质破坏的程度和严重性[3]。研究显示,CT肺密度测定和肺气肿的组织学分级与肺癌肺叶切除术患者的肺功能变化有关,肺气肿程度较高的患者中,肺叶切除术后肺功能降低幅度更大[4-5]。本研究旨在探讨CT肺密度和肺气肿体积分析对肺癌患者术后肺功能及肺部并发症的相关性。
资料与方法
一、一般资料
本研究为回顾性病例分析,选取2022年4月至2023年4月诊治的肺癌患者。纳入标准:①年龄18~75岁。②经病理诊断为原发性肺癌。③行手术切除治疗。④临床资料完整。排除标准:①全肺切除术。②既往肺部手术史。③合并其他原发肿瘤者。④胸腔积液、肺段或肺叶肺不张、>3 cm的肺大疱、CT图像显示肺纤维化。共纳入患者77例,其中男性54例(70.13%),女性23例(29.87%),年龄30~76岁,平均年龄(60.24±6.75)岁,腺癌49例,鳞状细胞癌28例,肿瘤位于右肺上叶16例、中叶7例、下叶17例,左肺上叶21例、下叶16例,低分化13例、中分化19例、高分化45例,肺叶切除术40例(51.95%),肺部分切除术37例(48.05%)。吸烟者44例(57.14%),高血压患者17例(22.08%)、冠心病患者8例(10.39%),糖尿病患者5例(6.49%)。本研究经医院伦理委员会批准(HB20201599),所有患者均签署知情同意书。
二、计算机断层扫描
增强CT胸部扫描使用64排螺旋CT进行,静脉注射造影剂后,在仰卧位吸气结束时屏气,期间扫描胸部区域。使用自动推注跟踪软件在位于胸主动脉上方的感兴趣区域触发阈值为100HU的图像采集。使用OsiriX数字分析程序进行肺密度和体积测量。根据预先确定的密度阈值,使用图像分割软件对肺实质进行分割。肺衰减阈值限制为-400~-1024 HU,用于排除肺部周围的软组织。衰减值小于-950HU的区域定义为功能不良的肺气肿[6]。计算每个片段体积和密度的定量测量值,计算每例患者的肺气肿体积和肺密度。
三、肺功能测试
肺功能检查在术后1周时采用运动气体代谢分析仪(MasterScreen CPX)测量FEV1、用力肺活量(forced vital capacity,FVC)、FEV1/FVC比率、最大呼气中段流量(mean mid-expiratory flow between 75% and 25% of the FVC,MMEF25%-75%)、用力呼出50%肺活量时的平均呼气流速(maximum expiratory flow at 50% ofthe FVC,MEF50%)、最大呼气峰流速(peak expiratory flow,PEF)和用力呼气时间(forced expiratory time,FET)、DLCO和肺泡容积校正的DLCO(DLCO/VA),所有肺功能数据均以患者年龄、性别和身高预测值的百分比表示。
四、结果定义
术后并发症定义为手术后30天内发生的并发症。肺部并发症包括:肺炎定义为>38°C的发热持续48h,影像学显示肺部炎症改变,细菌培养阳性。大叶性肺不张:胸片或支气管镜检查发现的由于粘液堵塞引起的肺不张。胸腔积液:胸片或CT扫描显示胸腔积液,需要胸腔置管。持续漏气:术后肺部漏气导致>7天的胸腔闭式引流。
五、统计学分析
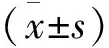
结 果
一、术前CT参数结果与术后肺功能测量值
77例患者FEV1%预测值:(72.73±11.61)%,FVC%预测值:(81.46±9.71)%,FEV1/FVC:(78.52±12.49)%,DLCO%预测值:(66.82±17.34)%,MMEF25%-75%预测值:(77.8±10.7)%,MEF50%预测值:(96.56±1.95)%,PEF%预测值:(94.64±18.32)%,FET:(96.71±16.93)S,DLCO/VA%预测值:(89.50±4.33)%。总肺容量:(4446.32±1672.76) cm3,右肺容积:(2309.43±912.33) cm3,左肺容积:(2136.83±848.92) cm3,肺气肿体积所占比例:(5.27±1.49)%,肺密度:-(730.64±273.41)HU。
二、术前CT参数与术后肺功能测量值的相关性
术后FEV1%预测值、DLCO%预测值、FEV1/FVC、MMEF25%-75%预测值、MEF50%预测值和DLCO/VA%预测值与术前肺密度成正相关,与术前肺气肿体积显著负相关(均P<0.05)。术后FVC%预测值和PEF%预测值与术前肺密度和肺气肿体积无相关性(均P>0.05)(见表1)。

表1 术后肺功能测量值与术前CT参数的相关性
三、术前CT肺密度和肺气肿体积的ROC曲线
共24例(31.17%)患者术后发生肺部并发症:肺炎2例、肺叶不张8例、胸腔积液4例、持续漏气10例。ROC曲线显示肺密度的AUC为0.898(95%CI:0.810~0.985,P<0.001),临界值为-787.5 HU,敏感度和特异度分别为86.96%和81.48%(kappa=0.682,P<0.001),阳性预测值和阴性预测值分别为0.80(95%CI:0.659~0.896)和0.88(95%CI:0.750~0.950)。肺气肿体积的AUC为0.878(95CI:0.776~0.980,P<0.001),临界值为5.41%,敏感度和特异度分别为84.00%和80.00%(kappa=0.645,P<0.001),阳性预测值和阴性预测值分别为0.81(95%CI:0.667~0.901)和0.83(95%CI:0.696~0.919)(见图1)。
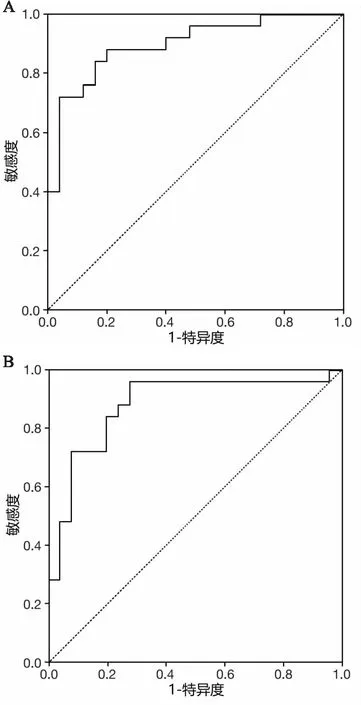
图1 A:平均肺密度预测肺部并发症的ROC曲线;B:肺气肿体积预测肺部并发症的ROC曲线
四、影响术后肺部并发症的Logistic回归分析
以性别(赋值:男=1,女=0)、年龄(实际值)、吸烟(赋值:是=1,否=0)、手术类型(赋值:肺叶切除术=1,肺部分切除术=0)、病变位于上叶(赋值:是=1,否=0)、合并基础疾病(赋值:是=1,否=0)、肺气肿体积(赋值:>5.41%=1,<5.41%=0)和肺密度(赋值:<-787.5HU=1,>-787.5HU=0)为自变量,以是否发生肺部并发症(赋值:是=1,否=0)为因变量,进行Logistic回归分析,将单因素分析中P<0.05的变量纳入多因素分析,回归方法为“进入-条件”。结果显示,术前肺气肿体积>5.41%和肺密度<-787.5HU是术后肺部并发症的独立危险因素(见表2)。

表2 影响术后肺部并发症的单因素和多因素Logistic回归分析
讨 论
解剖性肺切除术是早期肺癌患者的唯一治愈性疗法,术后肺部并发症发生率为12%~50%,死亡率为2%~12%[7]。本研究中77例患者共24例术后发生肺部并发症,肺部并发症发生率31.17%,与上述研究结果相似。本研究排除了有肺部手术史和胸腔积液病史的患者,因为此类患者会导致肺体积测量错误。此外,由于限制性肺疾病的减容作用,有肺纤维化CT表现的患者也被排除在外。
肺癌患者中吸烟者和存在呼吸道疾病者比率较高,术前采取肺部评估,对患者进行风险分层具有重要意义[8]。肺气肿的特征是末端细支气管及远端气道破坏,是肺癌患者常见的肺部合并症,可在肺切除手术后引起肺部并发症[9]。胸部CT是诊断肺癌分期和确定能否手术的主要方法,可以更准确地反映功能肺组织的体积,在测定早期肺气肿方面优于肺活量检查[10],研究表明,定量CT在预测术后肺功能方面比肺活量测量更加准确,与灌注显像具有良好的一致性[11]。肺气肿在CT上表现为异常低衰减区域,不同研究的肺气肿衰减阈值范围为-900~-950 HU左右[12-13],Koo等[6]调查了进行增强CT检查的患者,发现-950 HU的衰减阈值与肉眼可见的肺气肿有较强相关性,本研究中,所有患者均采用增强CT检查,根据上述研究选择-950 HU的肺衰减阈值来区分肺气肿和正常肺实质,相关性分析显示,术后FEV1%预测值、DLCO%预测值、FEV1/FVC、MMEF25%-75%预测值、MEF50%预测值和DLCO/VA%预测值与术前肺密度成正相关,与术前肺气肿体积成负相关,多项研究发现,术前肺气肿体积和肺密度与术后FEV1和DLCO有显著相关性[14-15]。
在CT图像上,-400~-1024 HU的衰减值可限制周围组织对肺实质的影响[16-17]。Karimi等[18]研究了目前吸烟的慢性阻塞性肺疾病患者肺实质炎症的肺密度,将-750~-900 HU的区域代表正常范围内密度较高的肺组织,以量化肺部疾病的早期体征,该研究结果显示,吸烟者比从不吸烟者的肺密度更大,吸烟者的肺密度与全身炎症和支气管肺泡灌洗液中细胞浓度的测量有关。本研究ROC曲线显示,肺密度预测术后肺部并发症的AUC为0.898,临界值为-787.5 HU。肺气肿体积预测术后肺部发病率的AUC为0.878,临界值为5.41%,Logistic回归显示,肺气肿体积>5.41%,肺密度<-787.5HU的患者术后肺部并发症发生率较高。对于肺切除手术患者来说,持续漏气会增加肺炎、脓胸的风险,是导致住院时间延长的常见术后并发症,因住院时间过长还可能增加血栓栓塞风险[19-20]。本研究有10例术后持续漏气患者,占术后肺部并发症的比率最高,这可能是因为肺气肿患者的潜在肺基质在手术中更容易受到损伤,需要更长的时间才能愈合,在肺气肿体积较大、密度较低的患者中,这种并发症显著增加。
本研究样本量较小,队列主要由轻度至中度肺气肿患者组成,可能不适用于患有严重疾病者,尽管排除了CT上有纤维化特征的患者,但可能无意中包括了有早期细微变化的纤维化肺病患者,并且本研究的相关性可能不适用于同时患有纤维化肺病的患者。此外,CT图像采集是在吸气结束屏气时进行的,但可能部分患者没有或无法遵守,这会改变肺容量和密度的测量。肺密度和肺气肿体积的测量值由CT扫描获得,方便经济,不需要修改检查方案、额外暴露于电离辐射或增加扫描时间。综上所述,术前CT肺密度和肺气肿体积与肺癌患者术后肺功能相关,肺气肿体积>5.41%和肺密度<-787.5 HU是术后肺部并发症的独立危险因素。
