研究TGR5过表达对暴露于高氧的新生小鼠炎症和肺损伤的影响
2023-12-14池婷刘爱红范彧阴欣
池婷 刘爱红 范彧 阴欣
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是一种早产儿慢性肺部疾病[1],由补充供氧或机械通气治疗呼吸窘迫综合征引起[2]。肺泡简化是肺中与BPD相关的主要病理改变,影响有效气体交换和肺功能[3-4]。BPD不仅会降低新生儿的肺功能[5],还会增加儿童后期患哮喘的可能性[6]。因此,预防或改善BPD对新生儿来说很重要。跨膜G蛋白偶联受体-5(takeda G protein-coupled receptor-5,TGR5)是一种血浆膜结合G蛋白偶联胆汁酸受体,在人体各器官中广泛表达[7]。研究表明,TGR5可以改善肝脏损伤中的炎症反应[8],也有利于预防高糖诱导的心肌细胞损伤[9]。尽管在肺中也发现了TGR5的表达,然而TGR5对高氧(hyperoxia,HO)诱导的BPD的保护作用尚未见报道。本研究旨在确定TGR5对新生小鼠BPD炎症和肺损伤影响,并评估潜在的分子机制。
资料与方法
一、材料
1 主要试剂 慢病毒(LV-TGR5、LV-NC、si-TGR5和si-NC)购自上海生工生物公司;髓过氧化物酶(myeloperoxidase,MPO)活性分析试剂盒购自南京建成生物公司;ELISA试剂盒购自武汉云克隆生物公司;抗体购自英国Abcam公司。
2 实验动物 C57BL/6小鼠(6~8周龄,20~24 g)购自山西医科大学(生理动物实验室)。许可证号:SYXK(晋)2019-0008。所有动物实验均按照美国国立卫生研究院的实验动物护理和使用指南进行,并得到了山西省儿童医院动物伦理委员会的批准(NO.2022056)。所有小鼠饲养在20℃~24℃的单个笼子中,在12h/12h的光/暗循环中自由获取食物和水。
二、方法
1 动物模型及分组 将成年小鼠杂交并在足月(妊娠第21~22 天)自然分娩,幼崽被汇集,并在6小时内返回母鼠。将36只幼鼠分为6个实验组(n=6):对照组(常氧组);高氧组(HO组);HO+LV-NC组;HO+LV-TGR5组;HO+si-NC组;HO+si-TGR5组。在整个实验过程中,HO+LV-TGR5组和HO+si-TGR5组小鼠以25 mg/kg的剂量分别静脉注射[10]慢病毒感染载体,每两天一次。对照组和HO组注射等体积的生理盐水。对照组的新生小鼠被放置在含21%氧气的室内空气中,HO组的新生小鼠被放置在含75%氧气的一个密封的有机玻璃室内14天[11],湿度和环境温度分别保持在50%和24℃。对照组与HO组母鼠每24 h在高氧和常氧窝之间轮转,以防止O2毒性。房间每天打开一次,持续0.5 h,以替换食物和水。实验期间每天观察各组新生小鼠的存活情况。每组小鼠分别于出生后14天腹腔注射1%戊巴比妥(50 mg/kg)处死。收集肺组织、支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和血清进行形态学测定和生化分析。
2 苏木精-伊红(hematoxylin&eosin,H&E)染色 处死小鼠并结扎右支气管。左肺通过静脉注射针插入气管在20 cm H2O压力下灌注4%多聚甲醛(paraformaldehyde,PFA)。左肺用4% PFA固定48 h后,切片用石蜡包埋并切片成4 μm厚度。切片用苏木精和伊红(H&E)染色,用光学显微镜(日本Nikon公司)进行形态测量分析。
3 肺湿/干(W/D)比测量 从小鼠体内对湿肺组织进行分离,记录肺组织的湿重,在80℃下干燥48 h并重新称重,直到达到稳定的干重。然后计算肺W/D重量比。
4 支气管肺泡灌洗液分析 出生14天后处死幼鼠,在H&E染色处理左肺之前,通过气管插管用磷酸盐缓冲盐水(PBS)洗涤3次,收集洗涤液,在4℃下12000 rpm离心15 min。收集上清液,使用BCA蛋白检测试剂盒(北京碧云天公司)测定蛋白浓度。使用Countstar 自动细胞计数器(上海瑞宇生物公司)计数总细胞。用瑞氏吉姆萨染色的离心制剂进行差异细胞计数,每只幼鼠至少计数200个细胞。
5 髓过氧化物酶活性分析 取新鲜肺组织,滤纸吸干污血渗液后,在适当比例的生理盐水中均质。将样品在4℃下12000 rpm离心20 min,使用指定的MPO活性比色分析试剂盒在460 nm下测定上清液中的MPO活性。
6 血清细胞因子水平 按方法4处理收集上清液。根据制造商的说明,使用细胞因子特异性ELISA试剂盒测量肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和IL-10的水平;使用微孔板读数器在450 nm处对结果进行定量。
7 SOD,GSH和MDA测定 按方法4处理收集上清液。按照制造商说明,使用市售的诊断试剂盒(北京碧云天公司)评估丙二醛(malondialdehyde,MDA)浓度,超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)活性。
8 qRT-PCR实验 使用TRIzol试剂(美国Invitrogen公司)从组织提取总细胞RNA,并用于合成cDNA(日本Takara公司)。使用Fast Start Universal SYBR Green Master(日本Takara公司)和7900实时PCR系统(美国Applied Biosystems公司)按照94℃ 25 s,94℃ 7 s和58℃ 25 s循环38次进行定量PCR。使用2-△△Ct方法计算基因水平。小鼠TGR5正向引物 5′-CCTGGCAAGCCTCATCGTC-3′,TGR5反向引物5′-AGCAGCCCGGCTAGTAGTAG-3′; 小鼠β-actin正向引物 5′-ATGGAGCCGGACAGAAAAGC-3′,β-actin反向引物 5′-TGGGAGGTGTCAACATCTTCTT-3′。
9 Western Blot分析 收集肺组织样本并使用RIPA缓冲液(北京碧云天公司)进行裂解。通过低温离心(1000×g,10 min)获得蛋白质,并使用BCA蛋白检测试剂盒(美国Thermo Fisher公司)确定浓度。蛋白质在10%~12%的SDS/PAGE凝胶上分离,并转移到聚偏氟乙烯(PVDF)膜上。用5%的脱脂牛奶封闭1 h后,在4 ℃环境下孵育抗TGR5、磷酸化p65、p65和乙酰化p53过夜。TBST洗涤3次后,将膜与辣根过氧化物酶偶联的二抗在室温下孵育1 h。用β-actin作为内参对照蛋白。使用增强化学发光检测系统检测蛋白条带,并用Multi-Analyst software package (美国Bio-Rad公司)对条带密度进行定量。
三、统计学分析
结 果
一、TGR5在新生高氧肺损伤小鼠中上调
构建了HO诱导的小鼠BPD模型,新生小鼠出生14天后收集小鼠肺组织进行组织学检查和基因检测。与对照组相比,HO组间质水肿和肺泡壁增厚,中性粒细胞和巨噬细胞浸润。此外,与对照组相比,HO组小鼠肺组织中TGR5的表达显著上调(P<0.05)(见图1)。

图1 TGR5在HO小鼠中上调
二、TGR5过表达减弱HO诱导的新生小鼠肺损伤
为了探究体内TGR5表达在新生小鼠肺发育的功能意义,通过静脉注射LV-TGR5或si-TGR5载体,并建立新生小鼠BPD模型。与HO组相比,LV-TGR5明显增加TGR5表达,si-TGR5明显降低TGR5表达(P<0.05)。与对照组相比,HO组间质水肿和肺泡壁增厚,中性粒细胞和巨噬细胞浸润明显;肺含水量明显增加;BALF中总细胞、中性粒细胞和巨噬细胞数量明显增加(P<0.05)。与HO组相比,TGR5过表达组新生小鼠水肿和肺泡壁增厚减弱,中性粒细胞和巨噬细胞浸润减少;肺含水量明显减少;BALF中总细胞、中性粒细胞和巨噬细胞数量明显减少(P<0.05)。与HO组相比,TGR5干扰进一步加剧肺泡损伤恶化,明显增加肺含水量,增加BALF中总细胞、中性粒细胞和巨噬细胞数量(P<0.05)(见图2)。

图2 TGR5过表达对肺组织损伤的影响
三、TGR5过表达减轻HO诱导的肺氧化应激
与对照组相比,HO组的促氧化应激标记物MDA含量显著升高,抗氧化应激标记物GSH和SOD活性降低(P<0.05)。与HO组相比,TGR5过表达显著降低MDA含量,升高GSH和SOD活性(P<0.05)。与HO组相比,TGR5干扰进一步升高MDA含量,降低GSH和SOD活性(P<0.05)(见图3)。

图3 TGR5过表达对BPD小鼠氧化应激的影响
四、TGR5过表达减少HO诱导的中性粒细胞浸润和炎症因子释放
与对照组相比,HO组的肺MPO活性显著增加(P<0.05);血清中TNF-α和IL-6表达显著增加,IL-10表达显著减少 (P<0.05)。与HO组相比,TGR5过表达显著抑制MPO活性;降低TNF-α、IL-6表达,升高IL-10表达(P<0.05)。与HO组相比,TGR5干扰显著升高MPO活性;升高TNF-α和IL-6的血清表达,降低IL-10的血清表达(P<0.05)(见图4)。

图4 TGR5过表达对BPD小鼠炎症反应的影响
五、TGR5过表达抑制TRAF6/NF-κB信号通路的活化
与对照组相比,HO显著升高肺组织中TRAF6和p65的蛋白表达(P<0.05)。与HO组相比,TGR5过表达显著降低TRAF6蛋白表达和p65磷酸化水平(P<0.05)。与HO组相比,TGR5干扰进一步升高TRAF6和p65的蛋白水平(P<0.05)(见图5)。
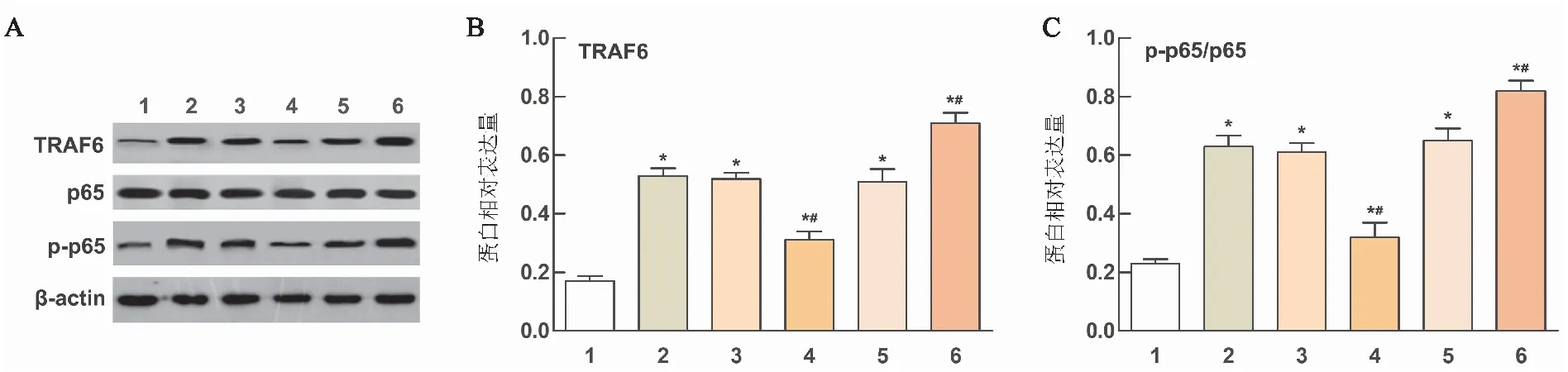
图5 TGR5对小鼠肺中TRAF6/NF-κB通路的影响
讨 论
BPD是早产儿常见的临床并发症。据报道,未成熟的肺长期暴露于高氧环境中是BPD发生发展的主要原因之一[12],并一直延伸到患有严重呼吸系统问题的儿童时期。我们通过将小鼠暴露于75%的氧气中,建立了新生小鼠的BPD模型。本研究中,我们证实了新生小鼠持续暴露于HO导致BPD病理特征。TGR5过表达减弱了HO诱导的中性粒细胞浸润和氧化应激,并改善间质水肿和肺泡壁增厚,减少肺部炎症。
高氧暴露肺损伤是BPD新生儿最常见的肺损伤模式,可引起肺泡简化、血管畸形和肺纤维化。出生后0~14天将新生小鼠暴露在75%的氧气中,这代表小鼠的囊泡和肺泡阶段。此外,暴露于高水平的氧气中不可避免地会导致产生过量的氧自由基[13]。MDA作为脂质过氧化的产物,可用于评估氧化应激水平,而抗氧化酶SOD和抗氧化剂GSH在氧化应激中发挥重要作用,可清除超氧阴离子自由基,保护细胞免受HO损伤[14]。在随后发展为BPD的早产儿中检测到较低的抗氧化水平和较高的MDA浓度[15]。在本研究中,HO暴露后,新生小鼠肺组织MDA升高,GSH和SOD减少,肺结构破坏,炎症细胞浸润,表明高氧诱导的肺损伤模型成功建立。TGR5过表达使BPD小鼠的氧化应激和HO诱导的肺损伤得到改善。TGR5过表通过提高GSH和SOD水平表现出抗氧化作用,降低了HO诱导的脂质过氧化程度,提示TGR5过表达缓解了HO诱导的新生小鼠肺氧化应激。
肺部炎症加重BPD的发展,炎症因子与BPD的不良结局相关[16]。本研究中,ELISA结果显示,TGR5过表达可降低小鼠血清中HO诱导的TNF-α、IL-6血清水平,升高IL-10水平,提示TGR5过表达可有效缓解高氧损伤引起的炎症反应。Leroy等[17]指出,BPD患儿的全身炎症先于临床症状。TGR5过表达对HO诱导血清炎症因子水平的抑制作用,提示其可用于BPD的早期干预。TRAF6蛋白是肿瘤坏死因子受体相关因子(TNF receptor associated factor,TRAF)家族成员之一,与败血症引起的急性肺损伤密切相关[18]。研究表明,TRAF6的过度表达增加了TNF-α和IL-6的表达水平[19]。NF-κB通路参与广泛的炎症激活。先前的研究表明,TRAF6可以激活NF-κB信号通路[20],而抑制NF-κB通路可减轻LPS诱导的急性肺损伤[21]。在本研究中,我们发现HO暴露促进NF-κB通路的激活,这可能与HO诱导的肺损伤和炎症有关。TGR5过表达降低了高氧诱导的TRAF6蛋白和NF-κB p65的磷酸化,提示TGR5过表达可能通过抑制TRAF6/NF-κB信号通路活性来缓解小鼠肺损伤,但仍需进一步研究。
综上所述,本研究证实在小鼠BPD模型中,TGR5可以减少肺泡水肿和氧化应激反应,改善肺功能和降低炎症细胞浸润。TGR5可以通过抑制肺细胞中TRAF6/NF-κB通路降低高氧肺损伤的严重程度。我们的结果为保护高氧肺损伤提供了一种新的机制,为预防炎症反应和新生儿BPD提供一种新的、潜在的治疗方法。
