Notch信号通路调控巨噬细胞极化在大鼠纤维化型饲鸽者肺的作用
2023-12-14王文艺彭真杨晓红邬超
王文艺 彭真 杨晓红 邬超
饲鸽者肺(pigeon breeders’lung,PBL)是反复吸入鸽子羽毛、皮屑等脱落物后诱发的肺部炎症反应性疾病[1-2]。其发病依赖于吸入致敏原,致敏原被肺巨噬细胞识别并吞噬,与特异性IgG结合形成免疫复合物,通过补体激活活化巨噬细胞[3-4]。α-平滑肌肌动蛋白(α-SMA)和转化生长因子(TGF-β1)是肺纤维化的关键细胞因子,参与肺纤维化的形成[5]。Notch信号通路是巨噬细胞生物学功能的关键调节器,在不同环境刺激下极化为经典活化M1型巨噬细胞和旁路活化M2型巨噬细胞,M1型巨噬细胞增多促进炎症的进展,M2型巨噬细胞增多促进肺纤维化的进展[6],γ分泌酶抑制剂(DAPT)阻断Notch信号通路,可直接或间接的影响巨噬细胞的促炎功能及部分炎症因子的转录[7]。课题组前期发现纤维化期Notch信号传导通路异常表达与巨噬细胞的极化相关,故推测Notch信号通路可能通过调控巨噬细胞极化方向影响纤维化型饲鸽者肺的发展。
资料与方法
一、一般资料
本研究采用的清洁级健康成年SD大鼠(sprague-dawley rat,SD Rat)6~8周龄27只,不限雌雄,(Wt:180~200 g)。所有动物均购自上海西普尔-必凯实验动物有限公司,许可证号[SCXK(沪)2018-0006]。饲养环境:温度21℃~25℃,相对湿度45%~50%,用标准大鼠箱饲养,2~3只/箱,水料充足,换气次数1~2次/天,气流速度0.1~0.2 cm/s,环境噪声控制在60dB以下,照明15~20lx。检疫1周后用于实验。所有操作和实验流程均遵循《实验动物管理条例》,已通过新疆维吾尔自治区人民医院伦理委员会审批同意(2019030615)。
二、方法
1 建立疾病模型 正常对照组(Ctrl组)0.9%生理盐水气道内滴入1次/周,持续4周,培育至20周;模型组(M组):冻干粉气道内滴入1次/周,连续4周,将老鼠培育至20周;给予DAPT抑制剂组(M+DAPT组):造模开始给予γ分泌酶抑制剂(DAPT 0.05 mg/kg腹腔注射)干预,每周2次,持续4周,造模结束后每周1次,持续到20周实验结束,腹腔注射戊巴比妥钠(10 mg/kg)过麻处死大鼠,留取左肺组织,取右肺肺泡灌洗液备用。
2 肺泡巨噬细胞培养及鉴定 取肺泡灌洗液,按实验要求调整细胞浓度为1×105个/mL,细胞吹打混匀后,移入铺有圆形载玻片的24孔板中,置于37℃,5% CO2培养箱中培养2h,用D-hanks液体冲洗,贴壁细胞孔中加入RPMI1640培养基2mL,隔2天进行半量换液,培养7天,得贴壁的巨噬细胞用于以下实验,免疫荧光检测CD68鉴定巨噬细胞,分离的巨噬细胞CD68染色阳性,纯度达95%以上为合格(见图1)。

图1 大鼠肺泡巨噬细胞鉴定免疫荧光图(×400)
3 Western Blot检测α-SMA、TGF-β1及Notch信号通路关键蛋白的表达 本研究所用电泳系统由Bio-Rad公司出品的Mini-PROTEAN 3(MP3)电泳槽和Mini-PROTEAN 3缓冲液槽及盖组成,转膜仪为Bio-Rad公司出品的Trans-Blot SD湿转转印槽。取出-80℃冷冻肺组织,20~50mg左右,加缓冲液组织剪碎,研磨,用滤网200目过滤,标本制备成匀浆,用预冷 PBS 洗涤细胞 3 次后加入RIPA细胞裂解液,提取细胞蛋白,BCA 法测定并调整蛋白浓度,进行电泳及转膜,50g/L 脱脂奶粉封闭2 h后TBST洗膜3次(10 min/次),并按照说明书要求滴加一抗、二抗,进行化学发光反应,对所显影的蛋白条带用ImageJ检测其灰度值,采用于Tanon5200化学发光成像仪拍照,获取图片。
4 荧光定量PCR技术检测阻断Notch通路对巨噬细胞极化方向的影响 本研究采用TRIzolRNAiso Plus(Takara,9108,即Trizol)法提取细胞总RNA,逆转录实验步骤按照逆转录试剂盒说明书操作[PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara,RR047A,即逆转录试剂盒),定量PCR根据上述反应体系加入各种反应试剂,是混匀好的试剂,里面有Taq polymerase,dNTP,Sybr green(SYBR®Premix Ex Taq(Takara,RR820A)]染液,反应缓冲液。整个试剂配制体系在冰上配制,根据上述反应体系轻轻混匀后,将8连管用盖子盖好后,在离心机中瞬时离心将贴在管壁上的液体沉到底部。将8连管放入定量PCR检测,采用以上反应体系。PCR反应结束后,直接将8连管丢弃,直接根据仪器收集的数值对数据进行分析即可,引物(见表1)。
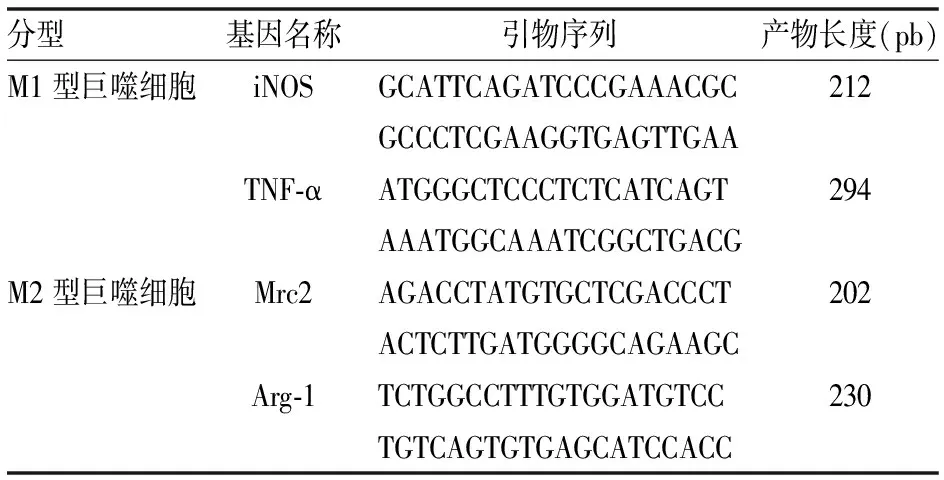
表1 巨噬细胞引物标记基因的引物
三、统计学分析
采用SPSS 26.0软件进行分析,所有定量数据在符合正态分布和方差齐性检验后,多组间比较使用单因素方差分析,LSD-t法进行多组样本均数间的两两比较,P<0.05表示其差异存在统计学意义。
结 果
一、动物模型制备
根据预实验结果20周时大鼠出现纤维化改变,故本研究选取18只纤维化大鼠分为2组,即大鼠饲鸽者肺纤维化模型及DAPT抑制剂干预组,正常对照组9只,采用HE及Masson染色检测各组大鼠病理变化,Ctrl组肺组织未见炎症及纤维化改变,M组可见肺间质炎细胞浸润明显,细支气管及腺体周围纤维组织和平滑肌组织明显增生,肺泡间隔增宽,肉芽肿及肉芽肿中心纤维化形成。M+DAPT组炎细胞浸润及纤维化程度明显减低,未见明确肉芽肿形成(见图2)。

图2 三组大鼠肺组织HE染色及Masson染色病理图表现
二、肺部CT变化
20周时正常对照组肺部影像学未见纤维化形成,大鼠纤维化型饲鸽者肺20周时双肺可见网格影及部分区域内呈蜂窝样改变,考虑符合纤维化改变,给予DAPT抑制剂干预后可延缓纤维化形成(见图3)。

图3 三组大鼠间肺部影像学表现
三、α-SMA、TGF-β1及Notch信号通路关键蛋白的表达结果
与Ctrl组比较:α-SMA纤维化期M组患者α-SMA表达水平较对照组显著增高(P<0.05);TGF-β1纤维化期M组患者TGF-β1表达水平较对照组显著增高提示大鼠纤维化型饲鸽者肺造模成功;给予DAPT抑制剂后TGF-β1蛋白表达水平较纤维化期降低,差异有统计学意义,而α-SMA蛋白表达量较纤维化期下降,但差异无统计学意义。M组与Ctrl组比较:纤维化型过敏性肺炎大鼠肺组织Notch信号通路关键蛋白配体DLL1、DLL4、JAG1、JAG2及受体Notch1、Notch2的蛋白表达水平增高;应用DAPT抑制Notch信号通路后DLL4、JAG1、JAG2及受体Notch1均下降(P<0.05);而DLL1、Notch2蛋白表达水平下降,差异无统计学意义(见表2及图4)。
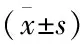
表2 α-SMA、TGF-β1及Notch信号通路关键蛋白的表达结果

图4 三组大鼠间a-SMA、TGF-β1及Notch信号通路关键蛋白的表达
四、M1型巨噬细胞、M2型巨噬细胞标记基因的mRNA表达结果
M组与Ctrl组比较:纤维化型过敏性肺炎大鼠肺组织巨噬细胞M1型标记基因TNF-α、iNOS mRNA表达量下降;巨噬细胞M2型标记基因Mrc2、Arg-1 mRNA表达量升高(P<0.05),应用DAPT抑制Notch信号通路后TNF-α、iNOS基因mRNA的相对表达量升高,Mrc2、Arg-1 基因mRNA的相对表达量降低(P<0.05)(见表3和图5)。
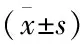
表3 M1型、M2型巨噬细胞标记基因 mRNA表达水平
讨 论
前期已在新疆喀什地区“新疆新投鸽叶有限公司”鸽舍内收集的鸽子脱落物成功制作了纤维化型过敏性肺炎动物模型。本研究按照前期研究使用鸽子粪、羽毛、皮屑等脱落提取物制作冻干粉蛋白溶于生理盐水中,每周一次气道滴入制作的大鼠动物模型HE染色细支气管壁增厚纤维化明显,血管周围见小灶肉芽肿,腺体增生,肺泡间隔增宽;Masson染色提示肺间质纤维化明显,桥状纤维化形成,细支气管管壁明显增生纤维化,肺泡腔塌陷,部分消失;文献提示纤维化型过敏性肺炎通常以细支气管为中心,可以出现桥接纤维化、小叶周围或肺膜下纤维化及显微镜下蜂窝肺区域。研究表明TGF-β1 和 α-SMA 是关键致纤维化因子[8],本研究中纤维化期α-SMA、TGF-β1表达水平增高,表明在成纤维细胞持续性分化增殖的过程中二者协同参与肺纤维化的形成,证实纤维型饲鸽者肺造模成功。
Notch信号通路是高度保守的信号转导通路,在肺的稳态、损伤和修复中起着关键作用[9]。研究发现:纤维化型过敏性肺炎大鼠肺组织Notch信号通路关键蛋白配体DLL1、DLL4、JAG1、JAG2及受体Notch1、Notch2的蛋白表达水平增高;应用DAPT抑制Ntoch信号通路后DLL4、JAG1、JAG2及受体Notch1均下降;而DLL1、Notch2蛋白表达水平下降,差异无统计学意义,提示Notch信号通路在纤维化饲鸽者肺中起作用。在文献中报道巨噬细胞的活化及分化总伴随着Notch1、Notch2受体表达的增加;在一定范围内,Notch 信号通路激活促进巨噬细胞的炎症反应,而巨噬细胞释放炎症介质或自身Notch信号通路激活可以使 Notch受体、配体表达增加[10-12]。Notch信号的抑制因子DAPT能够以一种时间和剂量依赖模式抑制CD4+T淋巴细胞的增殖,阻断肺泡上皮细胞发生上皮-间充质转化(EMT),延缓肺纤维化发生、发展。
不同的病理条件下,Notch通路可以决定巨噬细胞的M1/M2激活模式[13]。本研究结果表明:纤维化型过敏性肺炎大鼠肺组织巨噬细胞M1型标记基因TNF-α、iNOS mRNA较正常对照组比较表达量下降;巨噬细胞M2型标记基因Mrc2、Arg-1 mRNA表达量升高(P<0.05),表明予以致敏原刺激后,大鼠纤维化型饲鸽者肺中巨噬细胞向M2方向极化,应用DAPT抑制剂后TNF-α、iNOS基因mRNA的相对表达量升高,Mrc2、Arg-1 基因mRNA的相对表达量降低,表明M2型极化发生了减少,巨噬细胞向M1型方向极化;表明Notch信号通路存在使巨噬细胞易于向M1型分化,当DAPT抑制剂阻断信号通路时,抑制巨噬细胞向M2型分化;而我们在饲鸽者肺纤维化型大鼠动物模型中也发现了这一特点,与Ye C,Li H等人在急性肺损伤中研究的巨噬细胞极化方向结果一致[14]。表明M2巨噬细胞可以产生促纤维化介质,促进肌成纤维细胞增殖[15]。而本研究中大鼠已经处于肺纤维化状态,且表现出巨噬细胞向M2型极化增多的现象,表明饲鸽者肺纤维化型的大鼠动物模型中巨噬细胞向M2型极化受Notch信号通路抑制剂DAPT的影响。
从本实验我们看到Notch信号通路可能调控巨噬细胞极化参与大鼠纤维化型饲鸽者肺发生发展,实验研究本就是在摸索中前进,后期我们会探讨巨噬细胞敲除后纤维化型饲鸽者肺的关系进一步阐明纤维化型过敏性肺炎的免疫学机制。
