不同浓度L-谷氨酸钠高效促进盐单胞菌XH26胞内合成Ectoine及相关代谢途径与Ectoine合成通路的关联性※
2023-12-13沈国平王智博舒志万崔金子汪明香朱德锐
沈国平,张 鑫,王智博,舒志万,崔金子,衡 珊,汪明香,朱德锐,王 嵘
(青海大学医学院基础医学研究中心,西宁 810016)
四氢嘧啶(Ectoine)作为嗜盐微生物胞内重要的次级代谢产物,已广泛应用于生物医学和生物制剂等领域。如何改善和提高细菌的Ectoine生产能力是目前需要着重解决的问题[1]。目前,国内外实现Ectoine过量化生产的主要策略集中于:(1)筛选易于培养、能耐受高盐且生长盐度范围宽泛、胞内Ectoine合成量大的菌株;(2)深入研究酸碱度、盐度、温度和碳氮源、合成前体物质等因素对Ectoine发酵产量的影响,并优化发酵工艺以提高产率;(3)基于Ectoine合成代谢通路和系统代谢工程原理,借助基因重组或基因敲除技术,构建高效工程菌株[2-4]。本研究通过构建小柴旦盐湖野生菌株XH26的系统发育树,明确进化分类地位并进行基因组测序。同时,探索合成前体底物(L-谷氨酸钠)对菌株XH26胞内Ectoine的合成影响,利用基因组测序法分析L-谷氨酸钠代谢途径与Ectoine生物合成通路的关联性,明确相关代谢基因的参与情况,为后续Ectoine的高效生产和系统代谢工程菌株改造提供理论依据。
1 材料与方法
1.1 菌株来源与培养条件
从小柴旦盐湖分离出的野生盐单胞菌株H.campaniensisstrain XH26(CCTCC2019776 M)可高效合成Ectoine。菌株XH26的最佳培养基条件[5]:L-谷氨酸钠35 mM、酶水解酪素100 mM、NaCl 1.0 M、MgSO4·7H2O 0.1 M和KCl 0.75 M,接种量为1%,培养时间为36 h,酸碱度为8,温度为35℃。
1.2 主要试剂与设备
L-谷氨酸钠和酶水解酪素(分析纯,天津永大公司),乙腈(HPLC级,美国赛默飞公司),Invitrogen Trizol试剂(美国赛默飞公司),Ectoine标准对照品(HPLC级>95%,德国Fluka分析公司) ,微孔过滤器(0.22 μm水系膜,天津亳津公司),色谱分析柱(德国Merck公司);细菌Ribo-Zeror RNA去除试剂盒(美国Illumina公司),细菌基因组DNA试剂盒(QI Aamp Fast DNA Stool Mini Kit,德国Qiagen公司),qPCR试剂盒(TB Green®Premix Ex TaqTMII,日本Takara公司);高效液相色谱仪(HPLC-2100型,美国Agilent公司),NanoDrop 2000微量检测仪(美国Thermo公司),PacBio Sequel测序平台(美国PacBio公司),实时荧光定量PCR仪(Roche Light Cycler®96,瑞士Roche公司)。
1.3 16S rRNA基因测序与系统发育分析法
按照细菌基因组DNA提取试剂盒说明书进行基因组DNA提取。用PCR法扩增16S rRNA基因时采用通用引物27F(5′-AGTTTGATCMTGGCTCAG)和1492R(5′-GGTTACCTTGTTACGACTT)[6]。PCR反应体系(25 μL):10×Buffer 2.5 μL,2.5 mM dNTPs 1 μL,正/反向引物(10 μM)各0.5 μL,DNA聚合酶0.2 μL,DNA模板(20~50 ng/μL)0.5 μL,最后用ddH2O补充至25 μL。PCR反应条件:94℃(240 s),94℃(45 s),55℃(45 s),72℃(60 s),25个循环,最后于72℃延伸10 min后纯化回收目的条带测序。通过NCBI数据库获取与菌株相似性较高的近缘物种基因序列,利用MEGA 7.0软件进行相似性比对,采用邻接法(Neighbor joining)构建系统发育进化树(Bootstrap 1000),分析菌株XH26的系统发育地位[7]。
1.4 细菌全基因组测序法
细菌基因组DNA采用1.0%琼脂糖凝胶电泳法分析完整性。采用微量检测仪检测DNA质量纯度。细菌全基因组由武汉菲沙公司利用PacBio Sequel平台完成测序。使用HGAP4、Canu(v.1.6)软件对纯三代数据进行组装,并对组装结果进行补洞、优化和评价[8]。使用Pbalign(v.0.3.1,默认Blasr算法)软件将三代Subreads比对组装到基因组上,用K-mer统计法评估基因组大小以及Scaffolds、Orphan contigs数目[9]。通过统计组装序列的GC含量、重复序列度和覆盖深度,分析Reads的测序深度。采用Genemark S软件预测编码基因,利用GO、COG和KEGG数据库判断直系同源基因,并进行功能基因注释[10-11]。
1.5 Ectoine定量检测法
根据文献报道方法定量检测Ectoine[5]。
1.6 荧光qRT-PCR法验证L-谷氨酸钠相关代谢基因
L-谷氨酸钠浓度梯度设置为15、30、45 mM,同步培养XH26菌株36 h后,离心收集菌泥。采用Invitrogen Trizol试剂盒提取菌株XH26的总RNA,总RNA符合样品要求(OD260/OD280=1.8~2.2;浓度>4 nM)。采用逆转录试剂盒进行qRT-PCR(2 μg RNA)实验,将实验产物cDNA 稀释20倍作为qRT-PCR模板。用qPCR试剂盒进行定量检测,将样品混合均匀于96孔板,上机运行,反应体系(20 μL):cDNA 6 μL,TB溶液10 μL,正/反向引物各0.5 μL,无菌水3 μL。qRT-PCR运行条件:95℃(180 s),95℃(10 s),65℃(20 s),72℃(30 s),40个循环,在延伸阶段采集每个循环的数据。内参基因为磷酸苷油酸脱氢酶(GADPH)基因,采用2-ΔΔCT法计算各基因的相对表达水平(n=3)[12]。PCR引物由南京金斯瑞公司合成(表1)。

表1 qRT-PCR实验涉及L-谷氨酸钠和Ectoine相关代谢的基因引物
2 结果
2.1 菌株XH26形态特征与系统发育
野生菌株XH26的菌落适应高盐生长(0~3.0 M NaCl),最适生长盐度为(NaCl)1.5 M。将16S rRNA基因测序(1438 bp)结果与NCBI数据库结果比对,其结果显示:菌株XH26与H.campaniensisLS21(No.CP007757.1)的序列相似性为99.86%(进化同源)。同时,系统发育分析(图1)显示:菌株XH26与盐单胞菌属类聚,隶属于γ-变形菌纲(γ-Proteobacteria)海洋螺菌目(Oceanospirillales)盐单胞菌科(Halomonadaceae)盐单胞菌属(Halomonas)的坎帕尼亚盐单胞菌(H.campaniensis)。
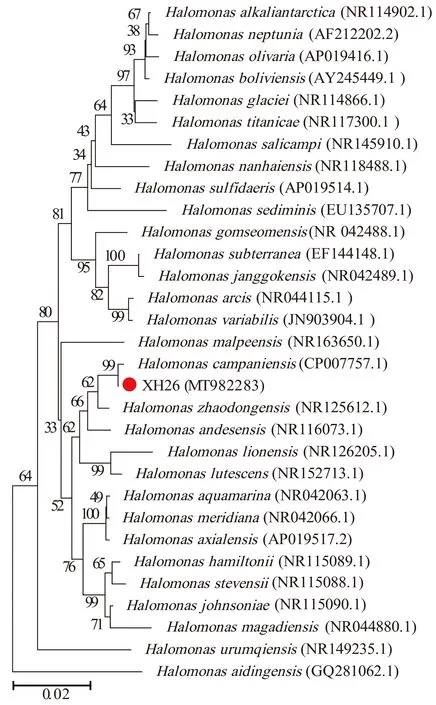
红色圆点代表本研究中应用的模式菌株及其NCBI登录号
2.2 L-谷氨酸钠对菌株XH26胞内Ectoine的合成影响
前期研究显示,将L-谷氨酸钠作为碳源时,Ectoine的合成量最大。分析不同浓度的L-谷氨酸钠对菌株XH26胞内Ectoine合成量的影响(图2)表明:随着L-谷氨酸钠浓度的增加,Ectoine的合成量随之升高,当L-谷氨酸钠浓度为30 mM时,Ectoine的合成量达到最大值(321.83 mg/L);此后,随着L-谷氨酸钠浓度的增加,Ectoine的合成量逐渐呈下降趋势。由此表明XH26菌株合成Ectoine的最适L-谷氨酸钠浓度为30 mM。
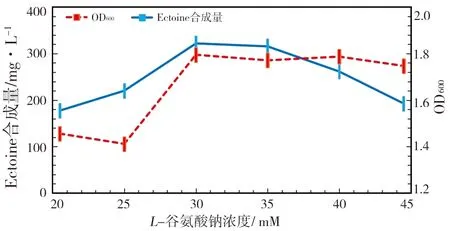
图2 不同浓度的L-谷氨酸钠影响菌株XH26的Ectoine合成量
2.3 菌株XH26全基因组特征分析
利用高通量测序法进行坎帕尼亚盐单胞XH26基因组组装(图3)。结果显示:模式菌株XH26的基因组大小为4 112 053 bp、预测编码基因3 927个、编码基因总长度为3 687 732 bp、编码基因GC含量为53.28%、编码基因总长/基因组大小为89.68%;tRNA为63个,5S rRNA、16S rRNA和23S rRNA均为6个。基于NR数据库注释出的基因数目为3 669个(比例为93.43%)、SwissProt数据库注释出的基因数目为2 812个(71.61%)、COG数据库注释出的基因数目为3 252个(82.81%)、KEGG数据库注释出的基因数目为2 305个(58.70%)、GO数据库注释出的基因数目为2 618个(66.67%)。注释基因数目共计3 669个(93.43%)。基于KEGG数据库分析显示,代谢富集基因主要涉及氨基酸代谢(amino acid metabolism)的相关基因277个、碳水化合物代谢(carbohydrate metabolism)的相关基因221个、辅助因子和维生素代谢(metabolism of cofactors and vitamins)的相关基因182个、跨膜转运(membrane transport)的相关基因178个、能量代谢(energy metabolism)的相关基因140个以及参与信号转导(signal transduction)的相关基因115个。
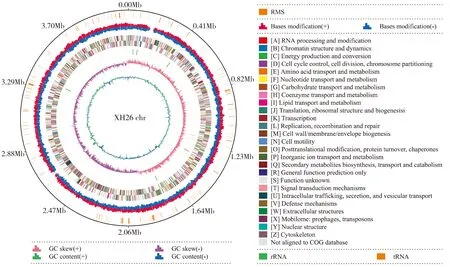
图3 坎帕尼亚盐单胞菌株XH26的基因组组装图
2.4 L-谷氨酸钠与Ectoine代谢通路的关联分析
基于菌株XH26基因组进行KEGG氨基酸代谢通路和Ectoine合成途径分析(图4),结果显示:Ectoine的生物合成采用保守的连锁基因簇ectABC操纵子实现转录调控,合成前体底物是天冬氨酸半醛(L-aspartate-β-semialdehyde),由天冬氨酸(L-aspartate)经天冬氨酸激酶和天冬氨酸半醛脱氢酶催化而来,分别由lysC、asd编码;而天冬氨酸的代谢与三羧酸循环的代谢中间物(如草酰乙酸、苹果酸、延胡索酸和琥珀酸)、琥珀酸半缩醛以及上游的谷氨酸(或谷氨酰胺)的分解代谢直接关联。至此,在优化培养基中添加L-谷氨酸钠(30 mM),能有效提高胞内Ectoine的合成量。通过增加L-谷氨酸钠的碳/氮代谢流量(C/N metabolic flux)提高下游产物天冬氨酸或天冬氨酸半醛的浓度,最终导致胞内Ectoine合成量增加。该过程中可能涉及相关基因参与其中,如gltB、gltD、davT、gdhA、lysC与asd。
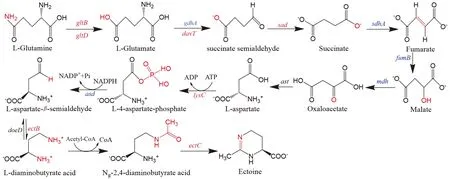
图中红色标记为物质变化过程中的主要官能基团
2.5 L-谷氨酸钠代谢的参与基因验证
设置L-谷氨酸钠浓度梯度组(15、30、45 mM),培养菌株XH26并提取总RNA,并利用qRT-PCR分析Ectoine合成通路基因的相对表达量(图5)。分析表明:随着L-谷氨酸钠浓度升高,基因gltB、gdhA、lysC的相对表达量呈递增趋势且有显著差异(P<0.05),ectB、ectA和ectC的相对表达量亦呈递增趋势但无显著差异;当L-谷氨酸钠浓度较低时(15 mM),gltD、asd的相对表达量无显著差异,当L-谷氨酸钠浓度较高时(45 mM),gltD、asd的相对表达量较高(P<0.05)。此外,当L-谷氨酸钠浓度为30 mM时,davT的相对表达量较高,而L-谷氨酸钠为低浓度(15 mM)或高浓度(45 mM)时,相对表达量较低。
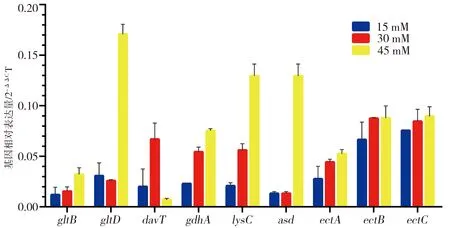
*:组间比较,P<0.05
3 讨论
目前,规模化生产Ectoine选用的模式菌株主要集中在γ-变形菌纲海洋螺菌目盐单胞菌科(Halomonadaceae),以盐单胞菌属(Halomonas)和色盐杆菌属(Chromohalobacter)应用最为广泛[3]。截至2023年3月,LPSN数据库(http://www.bacterio.net/halomonas.html)收录盐单胞菌属167个,成为种数最多的嗜盐菌属群,其典型代表有延长盐单胞菌(H.elongate)、盐水盐单胞菌(H.salina)、南极碱盐单胞菌(H.alkaliantarctica)、樊氏盐单胞菌(H.ventosae)以及玻利维亚盐单胞菌(H.boliviensis)等[16]。Romano等[13]从意大利坎帕尼亚Malvizza矿池中首次分离并命名为H.campaniensisstrain 5AG。该菌能在10.0℃~43.0℃范围内生长,最适温度为37.0℃;同时,该菌(在10% NaCl下生长最佳,生长pH范围为7.0~10.0,最适pH值为9.0)大量合成细胞渗透压保护剂Ectoine和谷氨酸。本研究选用的菌株XH26的生长盐度范围宽泛(0~3.0 M NaCl),最适生长盐度(NaCl)为1.5 M;系统发育分析结果表明:该菌与H.campaniensis进化同源,具备高效的Ectoine合成能力。
L-谷氨酸钠作为培养基碳源或氮源,可有效提高菌株胞内Ectoine的合成量[14]。姜蔚宇等的研究结果[15]显示:当酵母提取物为4.0 g/L时,Ectoine的产量为123.84 mg/L;当L-谷氨酸钠为0.355 M时,Ectoine的产量为134.37 mg/L;氮源酶水解酪素为12.5 g/L时,Ectoine的合成量为467.94 mg/L。Lang[14]和Chen[16]等在不同浓度的L-谷氨酸钠(0.237、0.355、0.473、0.592 M)中培养盐水盐单胞菌H.salinaDSM 5928T,研究批式发酵过程中Ectoine的产量变化。当L-谷氨酸钠浓度为0.473 M、NaCl浓度为0.5 M及pH为7.0时,Ectoine产量为8.21 g/L。本研究采用单批次方式摇瓶培养XH26菌株,当L-谷氨酸钠浓度为0.03 M时,Ectoine的合成量最大值为321.83 mg/L。对比分析发现,以L-谷氨酸钠作为碳/氮源,菌株XH26的Ectoine合成量较高。
本研究中,菌株H.campaniensisstrain XH26的基因组大小为4.11 Mb,预测编码基因为3 927个,代谢通路富集基因主要涉及氨基酸代谢基因(277个基因)和碳水化合物代谢基因(221个基因)等。谷氨酸或谷氨酰胺的分解代谢通路,依次生成琥珀酸半缩醛→琥珀酸→延胡索酸→苹果酸→草酰乙酸→天冬氨酸→天冬氨酸半缩醛等中间产物,最终合成Ectoine[12]。荧光qRT-PCR实验证实:当L-谷氨酸钠浓度从15 mM升至30 mM时,L-谷氨酸钠的代谢流量增加了Ectoine的合成量。在该代谢过程中,主要参与基因的相对表达量呈明显的上调趋势,如基因davT(1 275 bp)、gdhA(2 427 bp)和lysC(1 398 bp)。基因davT、gdhA和lysC分别编码4-氨基丁酸转氨酶(424 aa)、谷氨酸脱氢酶(808 aa)和天冬氨酸激酶(465 aa)。谷氨酸脱氢酶和γ-氨基丁酸转氨酶共同参与L-谷氨酸α-碳原子位点的脱羧基和脱氨基作用,生成琥珀酸半缩醛;天冬氨酸激酶参与L-天冬氨酰磷酸水解和脱氢反应,生成天冬氨酸半醛[3,17]。天冬氨酸激酶(EC2.7.2.4)是合成L-赖氨酸、L-甲硫氨酸、L-苏氨酸和L-异亮氨酸等氨基酸的关键酶,亦是合成天冬氨酸族氨基酸的限速酶[18]。同时,随着L-谷氨酸钠浓度从15 mM升至45 mM,Ectoine合成核心基因簇ectABC的相对表达量均轻度上调,可促进Ectoine的合成效率。此外,当L-谷氨酸钠浓度为45 mM时,基因gltD、lysC、asd的相对表达量均显著上调,此时Ectoine的合成量并未显著增加;与合成量最大值(L-谷氨酸钠浓度为30 mM时)相比,反而有所下降,可能与前体物质(天冬氨酸半醛)的代谢流量分配有关,具体的调控机理有待深入研究。
