基于网络药理学和实时荧光定量聚合酶链式反应法探讨鬼臼毒素对胃癌的作用机制※
2023-12-13陈思嫒庞一丹齐佳瑞孙静薇苏占海
刘 雅,陈思嫒,庞一丹,齐佳瑞,孙静薇,安 娟,苏占海
(青海大学医学部,西宁 810001)
鬼臼毒素(Podofilox)是一种鬼臼属植物桃儿七(生长于海拔2 000~4 000米的青藏高原)的芳基萘类木脂素内酯[1],具有抗肿瘤、调节免疫等多种生物学活性,其中抗肿瘤活性最为显著[2]。研究人员通过修饰鬼臼毒素结构,得到衍生物依托泊苷(etoposide,VP-16)和替尼泊苷(teniposide,VM-26)[3],为广谱抗肿瘤药物。虽然鬼臼毒素及其衍生物取得了较好的临床疗效,但作用机制不甚清楚。本研究拟通过网络药理学和实时荧光定量聚合酶链式反应(Quantitative Real-time PCR,qRT-PCR)法研究鬼臼毒素对胃癌的作用机制。
1 材料与方法
1.1 材料
1.1.1 药物与细胞
鬼臼毒素(上海陶素生化有限公司,产品编号:T1121),人胃腺癌AGS细胞(武汉普诺赛生物公司)。
1.1.2 试剂与仪器
人胃癌AGS细胞专用培养基(武汉普诺赛生物公司),0.25%胰蛋白酶溶液(北京索莱宝公司),PBS(北京索莱宝公司),CCK-8试剂溶液(武汉伊莱瑞特生物科技有限公司),引物(中国上海生工公司),总RNA提取试剂盒(中国北京天根生化科技有限公司),FastKing gDNA Dispelling RT SuperMix(中国北京天根生化科技有限公司),SuperReal PreMix Color(中国北京天根生化科技有限公司)。
NanoDrop 2000紫外分光光度计(美国Thermo公司),实时荧光定量PCR仪(美国Roche公司)。
1.2 方法
1.2.1 网络药理学方法
1.2.1.1 鬼臼毒素的分子靶标确定
基于TCMSP(https://tcmsp-e.com/)、Pubchem(http://pubchem.ncbi.nlm.nih.gov/)、Swiss Target Prediction(http://swisstargetprediction.ch/)、Similarity ensemble approach(https://sea.bkslab.org/)、Pharmapper(http://lilab-ecust.cn/pharmmapper/)数据库[4]完成靶标预测。由于识别出的部分候选靶标未使用公认基因名,因此使用UniProt(www.uniprot.org/)、STRING数据库(https://cn.string-db.org/)进行基因映射,获取鬼臼毒素分子靶标名称。
1.2.1.2 与胃癌相关的基因鉴定
应用GeneCards(http://www.gene-cards.org/)、Disgenet(https://www.disgenet.org/)数据库鉴定与胃癌相关的基因。
1.2.1.3 韦恩图交集靶标筛选
将使用韦恩图在线网站(http://bioinformatics.psb.ugent.be/webtools/Venn/)预测得到的鬼臼毒素潜在靶标和胃癌基因取交集,再将转录组测序数据中的差异基因与公共数据库来源的潜在靶标基因上传至该网站做韦恩图,取韦恩图中的交集基因导入STRING数据库。
1.2.1.4 PPI蛋白互作分析
利用公共数据库STRING构建胃癌相关基因和鬼臼毒素相关治疗靶标的相互作用网络。各靶标间的最低交互得分是0.4。将结果保存为tsv格式后导入Cytoscape3.8.2软件,绘制PPI网络。
1.2.1.5 GO和KEGG富集分析
我们将核心靶标导入DAVID(https://david.ncifcrf.gov)数据库[5]获得由GO和KEGG分析的结果。GO富集分析包括3类:生物过程(BPs)、细胞组分(CCs)和分子功能(MFs)。利用微生信网站(http://www.bioinformatics.com.cn)绘制GO富集和KEGG信号通路富集的气泡图。
1.2.2 体外实验方法
1.2.2.1 药物配置
取鬼臼毒素药品粉末用DMSO溶解至100 μM,再用培养基稀释至工作浓度(12.50、6.25、3.13、1.56 nM),用微膜过滤后置-20℃冰箱保存。用前震荡混匀。
1.2.2.2 细胞培养及分组
使用含10%胎牛血清的专用培养基(37℃,5% CO2)培养人胃腺癌细胞AGS,每2 d换液一次。待细胞密度达到80%~90%时进行传代,分为对照组和不同药物浓度实验组。
1.2.2.3 细胞增殖实验
将对数生长阶段的AGS细胞以每孔5 000个细胞的密度接种于96孔板,置细胞培养箱(37℃,5% CO2)培养24 h,加药继续培养24 h后吸去原培养基,每孔(4个复孔)加入10 μL CCK-8溶液和100 μL完全培养基混合液,摇匀避光培养1 h。用酶标仪在450 nm波长处测光密度(OD)值,根据OD值绘制细胞增殖曲线并计算IC50值。细胞存活率(%)按下式计算:细胞存活率(%)=(给药组的OD值-空白组的OD值)/(对照组的OD值-空白组的OD值)×100%。
1.2.2.4 qRT-PCR测定
将计算得到的IC50值设置为加药组的药物浓度,使用该浓度的鬼臼毒素处理AGS细胞。根据试剂盒说明,使用总RNA提取试剂盒提取药物作用24 h的细胞总RNA。总RNA被反向转录成cDNA。使用Sybrgreen PCR试剂进行相对定量PCR实验。qRT-PCR反应条件如下:95℃预变性900 s;95℃变性15 s,60℃退火/延伸20 s,共40个循环(两步法)。相对mRNA表达水平使用2-ΔΔCt法表示。qRT-PCR 使用的引物序列信息见表1。

表1 引物序列信息
1.2.3 统计学分析方法

2 结果
2.1 网络药理学结果
2.1.1 潜在靶标筛选
应用TCMSP、Swiss Target Prediction、Pubchem等数据库共筛选出120个鬼臼毒素潜在靶标。从Genecard、Disgenet数据库共得到1 901个胃癌相关基因。分析鬼臼毒素靶标和胃癌基因的共同基因(即鬼臼毒素对胃癌作用的潜在靶标),得到120个交集基因。
我们前期从测序数据研究中共获得了1 278个差异基因[6],将这些差异基因与从公共数据库得到的120个预测靶标上传到上文提到的韦恩图在线网站绘制Venn图(图1),该图显示有15个相交靶标,分别是ISG20、HSPA5、MTHFD1、RELA、TP53、ANG、EGFR、IGF1R、MET、ALDH1A1、DHFR、JUN、BCL2L1、CCND1、VIM,鬼臼毒素和胃癌交集靶标名称和信息见表2。
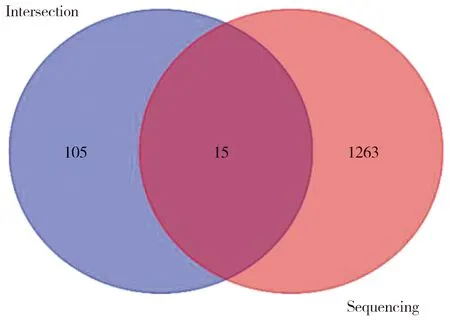
图1 鬼臼毒素和胃癌交集靶标Venn图
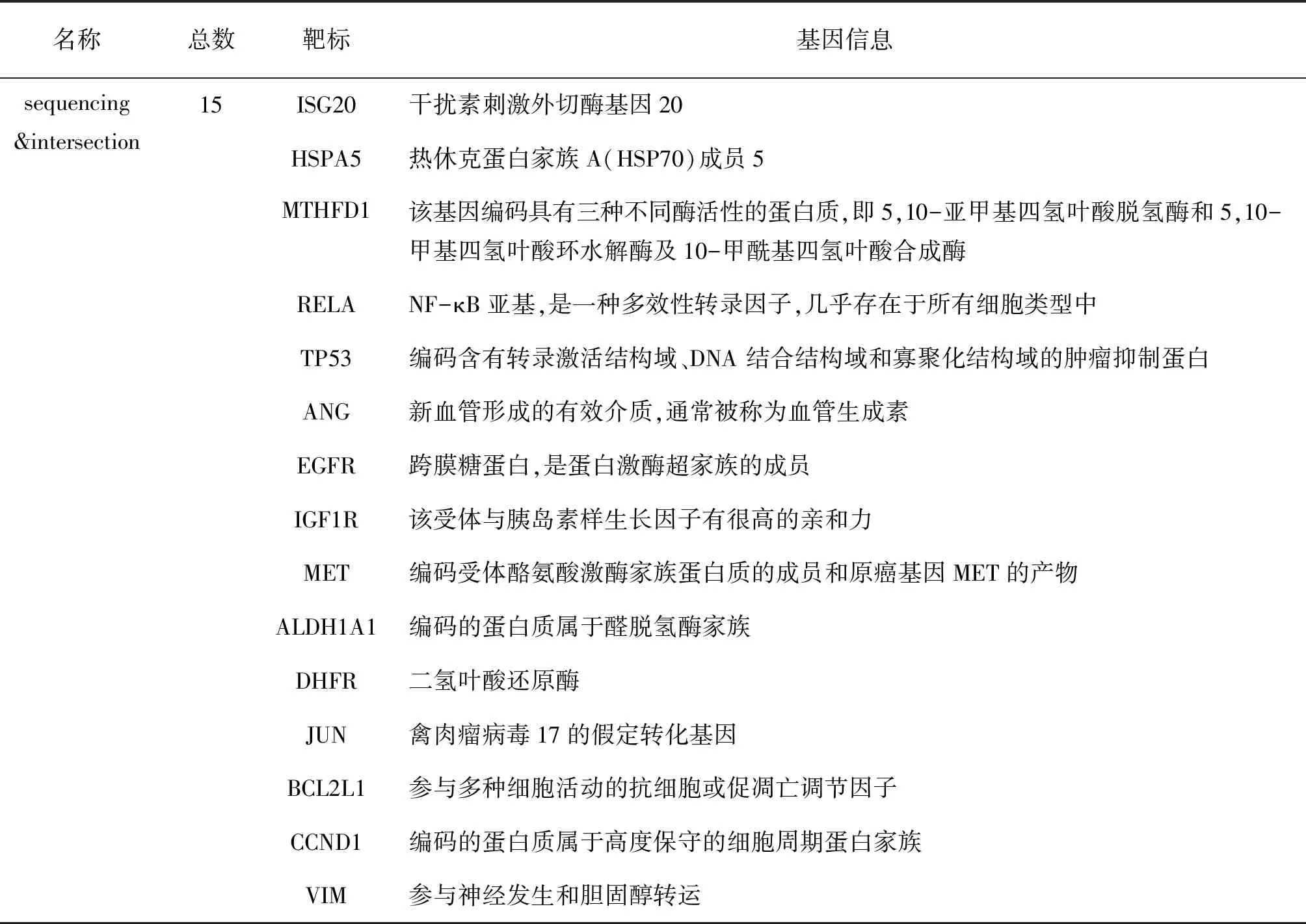
表2 鬼臼毒素潜在靶标名称和基因信息
2.1.2 蛋白-蛋白互作PPI网络图构建
将鬼臼毒素的15个核心靶标导入STRING数据库构建蛋白-蛋白互作PPI网络图,并应用Cytoscape 3.8.2软件优化网络(图2)。随着度值减小,节点颜色和大小由深到浅,每条边代表活性成分与作用靶标之间的相互作用关系。

图2 Cytoscape蛋白互作PPI网络图
2.1.3 GO富集分析与KEGG信号通路富集分析
使用DAVID数据库对15个潜在靶标进行了GO富集分析和KEGG信号通路富集分析。我们将数据导入微生信网站(http://www.bioinformatics.com.cn/)绘制GO富集分析气泡图(图3A-C),以P<0.05为标准筛选MF、CC、BP。结果表明,潜在靶标与23个MFs、84个BPs和17个CCs密切相关。MFs的结果显示,这15个潜在靶标主要与各种蛋白质的结合相关。BPs的结果显示,这15个潜在靶标主要与细胞凋亡、pri-miRNA转录等生物过程相关。CCs主要富集在细胞体、转录抑制器复合体、细胞质、微管组织(中心)、受体复合体、转录因子复合体、核膜、线粒体、轴突等细胞组分中。使用DAVID数据库对15个潜在靶标进行KEGG信号通路富集分析发现,这15个潜在靶标主要富集在黑色素瘤相关通路、癌症通路、PI3K/AKT信号通路和MAPK信号传导通路(图3D)等通路中。

A:MF富集分析;B:BP富集分析;C:CC富集分析;D:KEGG通路富集分析
2.2 qRT-PCR结果
2.2.1 抑制胃癌细胞的增殖
结果显示,与对照组比较,随着鬼臼毒素浓度增加,各加药组的AGS细胞存活率明显下降(P<0.05),且呈浓度依赖性,提示鬼臼毒素对AGS细胞的增殖具有显著抑制作用。并且鬼臼毒素处理胃癌细胞AGS的IC50的浓度为11.49 nM,见表3、图4。

鬼臼毒素(药物浓度,nM)

表3 鬼臼毒素对AGS细胞活性的影响
2.2.2 验证PI3K/AKT信号通路
为了研究与PI3K/AKT信号通路相关的基因,我们设计了7对引物,采用qRT-PCR实验检测对照组和鬼臼毒素加药组各个基因的表达情况。以β-actin为内源性对照,使用2-ΔΔCt法定量每个样品中mRNA的相对含量。采用t检验分析各组间差异。结果显示,除CCND1外,TP53、MET、RELA、EGFR、BCL2L1、IGF1R的mRNA表达在两组之间有差异,并且差异有显著性(P<0.05),见表4、图5。
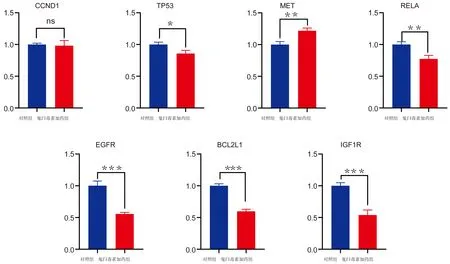
Ns:not significant,*:P<0.05,**:P<0.01,***:P<0.001

表4 关键靶标mRNA表达水平
3 讨论
本研究通过网络药理学分析获得鬼臼毒素作用于胃癌的15个潜在靶标。通路富集分析显示,鬼臼毒素可能是通过抑制PI3K/AKT信号通路相关基因的表达抑制胃癌生长。Yu HG等的研究结果提示[7],鬼臼毒素衍生物依托泊苷对胃癌细胞的抑制作用可能是通过影响PI3K/AKT信号通路实现的。Zhang Y等采用SGC7901/ADR胃癌细胞系探究了鬼臼毒素衍生物依托泊苷对胃癌的作用机制,认为它通过抑制PI3K/AKT信号通路进而抑制细胞凋亡[8]。2022年有学者采用HGC-27胃癌细胞和GES-1胃粘膜正常细胞探究鬼臼毒素衍生物12 c对胃癌细胞的影响,指出该化合物作用的靶标可能是PI3K/AKT信号通路[9]。以往的研究发现,PI3K/AKT信号通路在促进胃癌的发生发展过程中起到了关键的作用,并且鬼臼毒素对于胃癌细胞的生长抑制有剂量依赖效应[10,11],这与我们的分析结论一致。我们通过分析发现,潜在靶标CCND1、TP53、MET、RELA、EGFR、BCL2L1、IGF1R均富集在这条通路,qRT-PCR结果显示,经鬼臼毒素处理后的TP53、RELA、EGFR、BCL2L1、IGF1R表达下调。然而CCND1和MET与该通路其他基因的受抑制程度不同,可能是这两个基因在鬼臼毒素发挥作用的同时,被其他调控机制影响。以往的研究表明,PI3K/AKT信号通路被抑制可以促进细胞凋亡[12],是癌症治疗的重要靶点[13,14]。有研究显示,凋亡相关通路PI3K/AKT/NF-κB信号通路轴在胃癌的发生发展中发挥了重要作用[13]。PI3K/AKT信号通路已在大多数肿瘤中被发现,并被用作药物治疗的靶标。TP53在许多肿瘤类型中充当肿瘤抑制剂[15],TP53可以诱导细胞生长停滞或者促使细胞凋亡[16];RELA又名NF-κB,可以通过调节上皮-间充质转化影响肿瘤微环境的组成[17],从而改变肿瘤对化疗药物的耐药性[18];EGFR是人体内的一类跨膜受体酪氨酸激酶,该区域的激活即磷酸化对抑制肿瘤细胞增殖、血管生成、肿瘤侵袭、肿瘤转移及细胞凋亡的抑制有重要意义[19];BCL2L1是细胞死亡的有效抑制剂[20];IGF1R对于肿瘤的转化和恶性细胞的存活至关重要。文献及本研究的qRT-PCR结果提示,鬼臼毒素可能在mRNA转录水平抑制PI3K/AKT信号通路相关基因的表达进而影响胃癌细胞的生长。下一步,我们将通过蛋白水平的Western Blot实验进行验证。
