不同浓度1,25-二羟维生素D3对高原肺水肿雄性大鼠的防治作用及可能机制#
2023-12-13李天天张先钧戴重阳朱梦婷邓章昌蒲小燕
李天天,张先钧,戴重阳,朱梦婷,邓章昌,蒲小燕
(青海大学医学部,西宁 810001)
有研究发现,1,25-二羟维生素D3[1,25-(OH)2D3]对肺组织损伤有良好的预防和保护作用[1-4],这提示1,25-(OH)2D3可能对HAPE具有较好的防治作用。本研究通过建立HAPE雄性大鼠模型,应用不同浓度的1,25-(OH)2D3干预大鼠。通过检测大鼠相关指标和肺组织中炎症因子及关键基因并观察肺组织病理学变化,探究相关干预对雄性大鼠HAPE的防治效果及可能作用机制,初步明确1,25-(OH)2D3防治HAPE的最佳浓度。
1 材料与方法
1.1 材料
1.1.1 实验动物
SD雄性大鼠(200 g~300 g)购于西安交通大学医学部实验动物中心[许可证号:SCXK(陕)2019-0001]。本研究经青海大学医学院实验动物伦理委员会批准,实验中所涉处理动物的操作均按照《实验动物管理条例(GB14923-2010)》要求执行。
1.1.2 实验药物及试剂
骨化三醇[1,25-(OH)2D3]软胶囊购自青岛正大制药有限公司;Trizol Reagent、RNA反转录试剂盒,IL-1β、IL-6、TNF-α检测试剂盒,荧光定量PCR试剂盒购自日本Ta Ka Ra公司;PCR引物购自南京金斯瑞生物科技有限公司;SOD、GSH-Px、MDA的ELISA试剂盒购自上海酶联生物有限公司;RIPA裂解液、BCA蛋白定量检测试剂盒购自Beyotime公司;PVDF膜购自Sigma-Aldrich公司;β-actin、CYP27B1、VDR抗体和兔克隆抗体购自Ab clonal公司。
1.1.3 实验仪器
低温冷冻离心机(V28R)由Dynamica公司提供,多功能酶标仪和MyCycler PCR扩增仪及凝胶成像系统由BIO-Rad公司提供,实时荧光定量仪由Thermo Fisher公司提供,荧光显微镜由Nikon公司提供,全自动血气分析仪由Sysmex公司提供。
1.2 实验方法
1.2.1 实验动物分组、给药及模型建立
所有大鼠按随机数字表法分为7组:对照组、低氧组和5个不同浓度组(低氧+浓度0.063 μg/kg组为A组;低氧+浓度0.126 μg/kg组为B组;低氧+浓度0.189 μg/kg组为C组;低氧+浓度0.252 μg/kg组为D组;低氧+浓度0.315 μg/kg组为E组),每组15只。对照组大鼠饲养于青海大学实验动物房;将骨化三醇软胶囊溶解于丙二醇、乙醇和水的混合溶剂中(60,10,30;V,V,V)[5]灌胃,1次/d,连续5 d;低氧组和5个浓度组大鼠置于青海大学医学院高原医学研究中心低压氧舱(模拟海拔6 000 m,低氧胁迫48 h),构建HAPE大鼠模型,随后降至海拔3 500 m进行生理指标的检测,并从腹主动脉采血。实验期间,大鼠的饲养环境均达到如下要求:SPF环境,温度为18℃~26℃,相对湿度为40%~60%,自由摄食及饮水(饮水瓶的瓶口加钢珠)。出低压氧舱时麻醉处死大鼠,于无菌条件下解剖,取标本暂存液氮,放置-80℃冰箱保存待测。
1.2.2 大鼠PAP及血气指标测定
将大鼠麻醉后,切开大鼠腹部皮肤,经腹主动脉抽取全血1 mL,使用全自动血气分析仪(Sysmex)测定PaO2、SaO2。切开颈部皮肤,分离右颈外静脉,结扎远心端,插入导管,使用Power Lab生理记录仪观察PAP波形的变化,并通过压力传感器收集PAP。
1.2.3 大鼠肺组织含水量(LWC)测定
麻醉处死大鼠后,取出左肺上叶组织,用生理盐水冲洗两遍,用无菌滤纸吸干表面水分后置于电子天平称湿重[W(g)],用恒温烘干箱(55℃)烘干(72 h)称重[D(g)]。LWC百分比按Elliott计算[6],计算得出肺组织含水量公式:LWC(%)=(湿重-干重)/湿重×100%。
1.2.4 大鼠肺组织病理学变化观测
取右下肺尖处肺组织(约5 mm×5 mm×5 mm大小),用预冷的生理盐水洗净血液,在4℃的4%多聚甲醛溶液中固定48 h,使组织充分展开。用常规方法制片。选择三个视野采集显微图像,观察肺组织的组织病理学变化。
1.2.5 大鼠血清SOD、GSH-Px、MDA水平检测
用ELISA法检测大鼠血清SOD、GSH-Px、MDA水平。取大鼠右上肺组织称重后放入研磨器中匀浆,低温离心10 min收集上清液,使用ELISA试剂盒测定肺组织SOD活力及GSH-Px活性和MDA的含量,建立标准曲线孔和检测孔。使用酶标仪在450 nm波长处测量光密度,使用标准曲线计算SOD活力、GSH-Px活性和MDA浓度。
1.2.6 大鼠肺组织CYP27B1、VDR、IL-1β、IL-6、TNF-α mRNA表达量检测
用RT-PCR法检测关键基因CYP27B1、VDR、IL-1β、IL-6、TNF-α mRNA表达量。使用Trizol试剂提取肺组织总RNA,混匀并离心后取上清液,反转录成cDNA。然后采用RT-PCR法检测肺组织中关键基因CYP27B1、VDR、IL-1β、IL-6、TNF -α mRNA的表达情况。按照Real-time Quality PCR试剂盒说明书进行操作,使用实时荧光定量仪分析结果,得出各个样本的Ct值。引物(由南京金斯瑞生物科技有限公司合成)序列见表1。以β-actin作内参,采用2-△△Ct法计算目的基因的相对表达值。各个基因的表达值测量均重复3次。

表1 PCR引物序列
1.2.7 大鼠肺组织CYP27B1、VDR的蛋白表达水平检测

1.3 统计学分析方法
2 结果
2.1 各组大鼠肺血流动力学和血气变化情况
与对照组比,低氧组及A、B、C、E组大鼠PAP升高(P<0.05),D组大鼠PAP差异无统计学意义(P>0.05);低氧组及浓度由低到高组大鼠SaO2、PaO2呈降低趋势(P<0.05)。与低氧组比,浓度由低到高组大鼠PAP呈降低趋势(P<0.05),其中D组明显降低(P<0.05);SaO2、PaO2呈升高趋势(P<0.05),其中D组明显升高(P<0.05)。各浓度组间相比有差异。见表2。
表2 各组大鼠PAP、PaO2及SaO2水平变化情况
2.2 各组大鼠肺组织LWC
与对照组比,低氧组及浓度由低到高组大鼠LWC升高(P<0.05),经1,25-(OH)2D3干预后,与低氧组比,浓度由低到高组大鼠LWC呈降低趋势(P<0.05),其中D组明显降低(P<0.05),各浓度组间有差异。见表3。

表3 各组大鼠肺组织
2.3 各组大鼠肺组织病理学变化情况
对照组大鼠的肺组织形态在光镜下显示结构正常:肺泡腔结构完整,未见炎性细胞浸润,无水肿现象(图1 A);低氧组大鼠肺组织出现缺氧性肺水肿现象,肺组织结构破坏,肺泡间隔增宽,红细胞和炎性细胞浸润(图1B)。A、B组大鼠肺组织有轻度肺泡塌陷水肿现象,部分肺组织结构受损,伴有少量红细胞与炎性细胞浸润(图1C、D);C、D、E组大鼠肺组织水肿减轻,肺泡结构趋于完整,红细胞和炎性细胞减少,其中D组改善最为显著(图1E、F、G)。见图1。
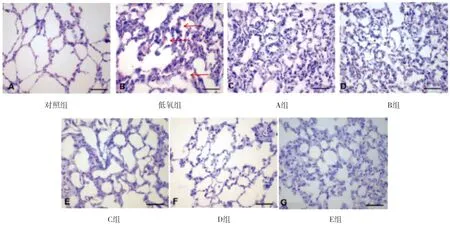
图1 各组大鼠肺组织HE染色(400×)
2.4 各组大鼠肺组织氧化应激生化指标
与对照组比,低氧组大鼠SOD、GSH-Px降低(P<0.05),A、B、C、E组大鼠SOD降低(P<0.05),D组差异无统计学意义(P>0.05),各浓度组大鼠GSH-Px降低(P<0.05),低氧组及各浓度组大鼠MDA升高(P<0.05)。与低氧组比,各浓度组大鼠SOD、GSH-Px升高(P<0.05),A组大鼠MDA差异无统计学意义(P>0.05),B、C、D、E组降低(P<0.05)。各浓度组间有差异。见表4。
表4 各组大鼠肺组织中SOD、GSH-Px、MDA含量变化情况
2.5 1,25-(OH)2D3对HAPE大鼠肺组织中的CYP27B1、VDR蛋白表达量的影响情况
与对照组比,低氧组CYP27B1蛋白表达水平升高(P<0.05)。与低氧组比,各浓度组CYP27B1蛋白表达水平呈降低趋势(P<0.05),其中C组明显降低(P<0.05)。与对照组比,低氧组VDR蛋白表达差异无统计学意义(P>0.05),各浓度组VDR蛋白表达水平升高(P<0.05),其中C组升高明显(P<0.05)。与低氧组比,各浓度组VDR蛋白表达水平升高(P<0.05),其中C组升高明显(P<0.05)。见图2、表5。

A:对照组,B:低氧组,C:A组,D:B组,E:C组,F:D组,G:E组

表5 各组大鼠肺组织中CYP27B1、VDR蛋白表达含量
2.6 1,25-(OH)2D3对HAPE大鼠肺组织中的CYP27B1、VDR及IL-1β、IL-6、TNF -α mRNA表达的影响情况
与对照组比,低氧组大鼠肺组织IL-1β、IL-6、TNF-α mRNA表达升高(P<0.05),CYP27B1、VDR mRNA表达升高(P<0.05),A、C、E组CYP27B1 mRNA表达升高(P<0.05),B、D组CYP27B1 mRNA的差异无统计学意义(P>0.05),各浓度组大鼠VDR mRNA表达升高(P<0.05)。与低氧组比,各浓度组大鼠IL-1β、IL-6、TNF-α、CYP27B1 mRNA表达降低(P<0.05),VDR mRNA表达升高(P<0.05)。各浓度组间有差异。见表6、7。
表6 各组大鼠肺组织CYP27B1、VDR mRNA相对表达量

表7 各组大鼠肺组织IL-1β、IL-6、TNF -α mRNA相对表达量
3 讨论
本研究发现,1,25-(OH)2D3可明显减轻低压低氧所致的肺组织损伤。本研究结果显示,1,25-(OH)2D3能够显著提高雄性大鼠肺组织中的SOD和GSH-Px活性,降低MDA含量,提示1,25-(OH)2D3可能通过其抗氧化应激作用发挥对低氧胁迫所致大鼠肺损伤的保护作用。IL-1β、IL-6、TNF-α作为主要的促炎因子,在诱导炎性细胞浸润和组织损伤中发挥重要作用,其活性的高低可以反映机体的炎症损伤情况[7-9]。本研究发现,1,25-(OH)2D3可使雄性大鼠肺组织中炎症因子IL-1β、IL-6、TNF-α的水平显著降低,炎症反应被抑制。综上所述,1,25-(OH)2D3对雄性大鼠HAPE具有较好的防治效果。
1,25-(OH)2D3的免疫调节作用依赖于25-(OH)D3的激活并与特定组织中的VDR 结合[10]。CYP27B1是调控1,25-(OH)2D3生成的关键基因,负责将25-(OH)D3转化为1,25-(OH)2D3[11]。研究证实,1,25-(OH)2D3和VDR通过负反馈机制调节CYP27B1水平[12-13]。本研究探究了各组大鼠肺组织CYP27B1和VDR的变化,结果显示,低氧组大鼠肺组织CYP27B1 mRNA和蛋白水平显著升高,VDR mRNA和蛋白水平显著降低,1,25-(OH)2D3可下调CYP27B1、上调VDR,从而减轻炎症和氧化应激反应致大鼠HAPE得以缓解。提示1,25-(OH)2D3通过调控CYP27B1、VDR的表达,发挥对HAPE的防治作用。
综上所述,1,25-(OH)2D3可降低低氧环境下雄性大鼠肺组织LWC,减轻肺组织损伤,通过下调CYP27B1、上调VDR抑制促炎细胞因子的产生,降低氧化应激水平,有效预防大鼠HAPE的发生;初步确定了预防大鼠HAPE的最佳浓度为0.252 μg/kg。
