环状RNA0001287(circ_0001287)和miR-21在糖尿病视网膜病变发病过程中的作用机制△
2023-12-13陈妍鹏温登慧
陈妍鹏 顾 婕 袁 沣 温登慧
糖尿病视网膜病变(DR)是糖尿病常见的微血管并发症之一[1]。研究发现,人视网膜色素上皮(hRPE)细胞位于视网膜神经感觉层与Bruch膜之间,是维持视网膜组织完整性和内环境稳定的重要细胞[2]。因此,研究高糖诱导的hRPE细胞功能障碍对制定有效的DR治疗策略至关重要。环状RNA(circRNA)是一种具有共价闭合连续环的非编码RNA,可通过充当微小RNA(miRNA)海绵来调节基因表达,参与DR疾病进展[3-4]。miR-21是存在于玻璃体中的候选纤维化miRNA,参与控制hRPE细胞的增殖和迁移[5-6]。CircInteractome数据库显示环状RNA0001287(circ_0001287)和miR-21之间存在假定的结合位点,这意味着circ_0001287可能通过作为miR-21海绵来影响DR的疾病进展。本研究旨在探讨circ_0001287和miR-21在DR发病过程中的作用机制,为DR的治疗提供新的分子靶点。
1 材料与方法
1.1 材料
从供体眼(来自于我院眼库)中分离原代hRPE(phRPE)细胞;其中4眼标本来自于行玻璃体切割术的增生型DR患者(PDR组)(男2例,女2例,年龄39~79岁),4眼标本来自于糖尿病患者(DM组)(男2例,女2例,年龄34~81岁,2例缺血性脑卒中和2例急性心肌梗死)。将标本置于含4×103U·L-1庆大霉素的生理盐水中浸泡10~20 min,加入含Ⅰ型胶原酶(5×103U·L-1)和透明质酸酶(50×103U·L-1)的平衡盐溶液,37 ℃、体积分数5%CO2培养箱中消化40~50 min,剪开眼球,保留眼后段,加入2.5 g·L-1胰蛋白酶消化 8~10 min。用含体积分数20%胎牛血清的DMEM培养液终止消化,1 500 r·min-1离心5 min。将细胞按5×107个·L-1的密度接种于直径60 mm培养皿中。取P2-P4代phRPE细胞用于circRNA芯片分析。另取hRPE细胞系ARPE-19细胞(购自北京癌症研究所)用于细胞实验。
1.2 方法
1.2.1 phRPE细胞芯片分析
收集phRPE细胞约1×107个。用TRIzol试剂(美国Invitrogen公司)提取总RNA,纯化后扩增RNA,并用Ambion WT表达试剂盒(美国Ambion公司)标记。将标记样本加载到Capital Bio Technology Human CircRNA Array v2芯片(美国安捷伦公司)上。使用Agilent GeneSpring软件分析circRNA微阵列结果。倍数变化≥2和P≤0.05的CircRNA被视为表达上调或下调。
1.2.2 ARPE-19细胞分组
将ARPE-19细胞分为空白组、高糖组、阴性组、si-circ组、circ_0001287组、circ_0001287+阴性组、circ_0001287+miR-21组。构建抗circ_0001287的小干扰RNA(siRNA)寡核苷酸和含有靶向miR-21序列的模拟物以及miR-21 mimics质粒。阴性组、si-circ组、circ_0001287组、circ_0001287+阴性组、circ_0001287+miR-21组分别采用Lipofectamine2000试剂盒(美国Invitrogen公司)将空质粒、circ_0001287 siRNA、circ_0001287模拟物、circ_0001287模拟物+miRNA无序序列、circ_0001287模拟物+miR-21 mimics质粒转染到ARPE-19细胞。转染6 h后,用新鲜的正常培养基更换Opti-MEM培养基。空白组和高糖组细胞不作转染处理。空白组细胞用含5.5 mmol·L-1葡萄糖的培养液培养,高糖组细胞逐次用含15.5 mmol·L-1、25.5 mmol·L-1、35.5 mmol·L-1葡萄糖的培养液培养。而其余各组细胞用35.5 mmol·L-1葡萄糖处理48 h。
1.2.3 RT-PCR检测circ_0001287和miR-21表达情况
按1.2.2细胞分组方案处理后,提取各组细胞总RNA,琼脂糖凝胶电泳验证RNA的完整性。所有引物均由中国上海Sangon公司合成。总RNA通过SYBR Green Master Mix反转录系统(日本Takara公司)转录成第一链cDNA。通过PIKO REAL RT-PCR试剂盒(美国Thermo Fisher Scientific公司)测量mRNA的相对表达量,并将其标准化为内参(GAPDH或U6)表达。
1.2.4 CCK-8实验检测细胞增殖活性
在96孔板中加入100 μL的 ARPE-19细胞悬液(1×107个·L-1),按1.2.2细胞分组方案,在各组细胞培养液中加入35.5 mmol·L-1葡萄糖处理48 h,每孔加入10 μL CCK-8溶液。用酶标仪测定培养液450 nm处的吸光度。
1.2.5 双荧光素酶报告基因检测circ_0001287和miR-21的靶向关系
通过CircInteractome数据库预测结合位点,扩增含有circ_0001287和miR-21之间结合位点的序列,并将其插入pGL3报告载体(美国Promega公司)中,以获得野生型质粒(circ_0001287-WT)。通过定点突变获得突变报告载体(circ_0001287-MUT)。Lipofectamine2000用于将报告载体和miR-21模拟或对照模拟转染到HEK293 T细胞中作为miR-21模拟组和对照模拟组。48 h后收集细胞,使用双荧光素酶报告基因检测试剂盒(美国Promega公司)检测荧光素酶活性。
1.2.6 RNA免疫沉淀实验验证circ_0001287和miR-21的靶向关系
使用Magna RIPTM RNA结合蛋白免疫沉淀试剂盒(美国Millipore公司)进行RNA免疫沉淀(RIP)实验。将ARPE-19细胞在RIP裂解缓冲液中裂解,然后将细胞提取物与含有抗Ago2抗体和阴性对照IgG偶联的磁珠一起孵育过夜。提取免疫沉淀中的总RNA进行RT-PCR,测定circ_0001287和miR-21表达情况。
1.2.7 生物素偶联探针Pull-down法验证circ_0001287和miR-21的靶向关系
生物素标记的circ_0001287探针和阴性对照探针由广州RiboBio Biotech公司合成。将转染circ_0001287过表达质粒的ARPE-19细胞进行裂解和超声处理,随后与针对circ_0001287或阴性对照的生物素标记探针孵育4 h。之后,用链霉亲和素偶联Dynabeads(美国Invitrogen公司)孵育过夜,捕获circ_0001287-miR-21复合物。第2天将circ_0001287-miR-21-磁珠复合物与含有蛋白酶K的RIP洗涤缓冲液孵育。最后,提取RNA并测定。
1.2.8 Western blot法检测蛋白表达情况
按1.2.2细胞分组方案处理细胞后,用RIPA和PMSF(1001)提取细胞总蛋白。取50 ng蛋白通过体积分数12%SDS-PAGE凝胶电泳系统进行蛋白质印迹,并电转移到PVDF膜上。用脱脂牛奶将膜封闭1~2 h。随后将膜与抗PTEN多克隆抗体(11 000)和GAPDH(11 000)的稀释抗体共同孵育,用HRP结合二级抗体重新孵育1 h。最后,用ECL化学发光试剂盒暴露免疫反应印迹。
1.3 统计学方法
所有数据均采用SPSS 26.0软件进行统计学分析,并以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 phRPE细胞中circRNA表达谱差异
使用人circRNA微阵列v2共筛选出798个circRNA,其中296个表达上调,502个表达下调(图1A)。通过火山图分析,与DM组相比,PDR组phRPE细胞共有86个circRNA差异表达,其中70个表达上调,16个表达下调。利用更严格的筛选标准:P<0.01,|变化倍数|≥2,外显子和原始强度大于200,筛选得到包括hsa_circ_0001287、hsa_circ_0085613、hsa_circ_0009021、hsa_circ_0012107在内的4种表达降低的circRNA(图1B)。进一步使用RT-PCR验证,只有circ_0001287在PDR组phRPE细胞和高糖组ARPE-19细胞中的表达下调(P<0.01)。与PDR组相比,circ_0001287在DM组phRPE细胞中的表达上调了3.2倍。因此选择hsa_circ_0001287用作后续研究。
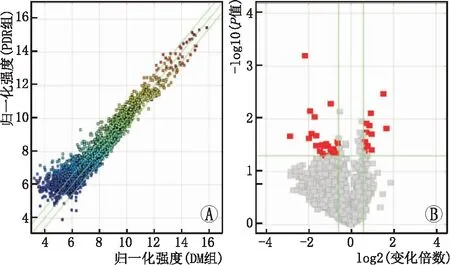
A:circRNA散点图;B:circRNA火山图。
2.2 高糖对circ_0001287、miR-21表达的影响
RT-PCR检测结果显示:与空白组相比,高糖组ARPE-19细胞中circ_0001287表达降低(P<0.05),并且具有剂量依赖性,而且随着葡萄糖浓度的增加,ARPE-19细胞中miR-21表达逐渐升高(P<0.05,图2)。
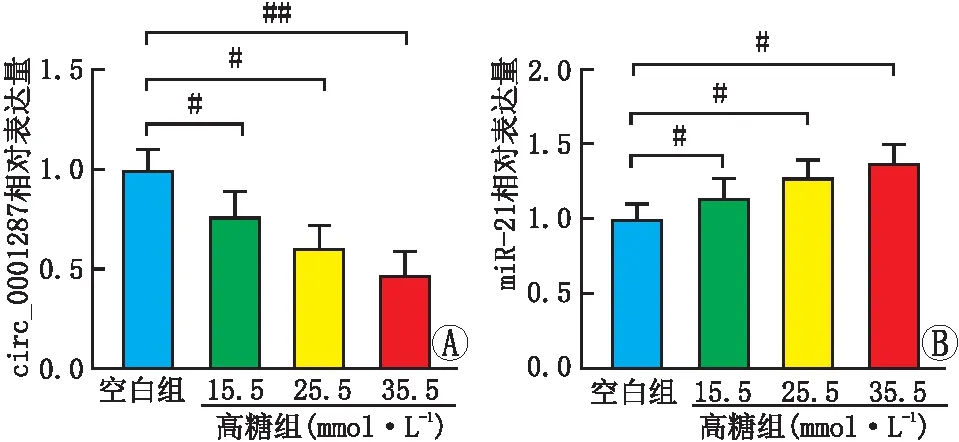
#P<0.05;##P<0.01。
2.3 转染效果验证
与空白组(1.00±0.02)相比,阴性组circ_0001287相对表达量(0.98±0.04)几乎无变化(P>0.05);与阴性组相比,si-circ组circ_0001287相对表达量(0.17±0.02)降低(P<0.05),circ_0001287组circ_0001287相对表达量(1.91±0.08)升高(P<0.05)。即使将siRNA与circ_0001287模拟物共转染,siRNA也能减少circ_0001287表达,表现为circ_0001287+阴性组circ_0001287相对表达量(0.70±0.03)与阴性组相比显著降低(P<0.05)。
2.4 双荧光素酶报告基因检测结果对于转染circ_0001287-WT质粒的细胞,与对照模拟组(0.98±0.03)相比,miR-21模拟组荧光素酶相对酶活性降低(0.59±0.02,P<0.05);然而,对于转染circ_0001287-MUT质粒的细胞,对照模拟组和miR-21模拟组荧光素酶相对酶活性几乎一致(分别为0.96±0.05和1.00±0.04,P>0.05)(图3)。
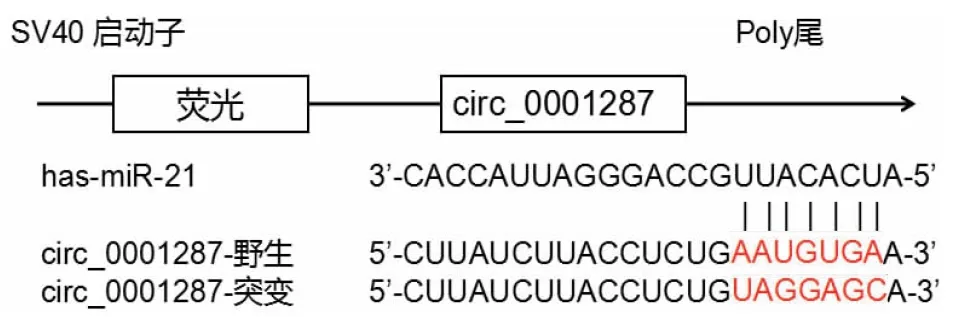
图3 circ_0001287与miR-21靶向关系的双荧光素酶报告基因检测系统
2.5 RIP法和Pull-down法验证circ_0001287与miR-21的靶向关系
在抗Ago RIP实验中,探针用于特异性下拉ARPE-19细胞中的circ_0001287;与对照组相比,circ_0001287组中miR-21明显富集,表明miR-21可被生物素化circ_0001287探针显著下拉;Pull-down分析结果显示:与对照IgG相比,circ_0001287特异性探针下拉样品中circ_0001287和miR-21显著富集(图4)。RT-PCR检测结果显示:与阴性组(1.00±0.03)相比,si-circ组ARPE-19细胞miR-21相对表达量(1.42±0.03)升高(P<0.05),而circ_0001287组miR-21相对表达量(0.80±0.02)降低(P<0.05)。

A:RIP分析结果;B:Pull-down分析结果。
2.6 circ_0001287对高糖诱导的ARPE-19细胞增殖的影响
与空白组(100.00%±0.95%)相比,用35.5 mmol·L-1葡萄糖处理后,高糖组ARPE-19细胞增殖率(78.54%±3.88%)降低(P<0.05),阴性组细胞增殖率(76.60%±4.12%)与空白组基本一致(P>0.05),si-circ组细胞增殖率为72.10%±3.95%,低于阴性组(P<0.05);而circ_0001287组细胞增殖率为91.35%±2.87%,高于阴性组(P<0.05)。在本实验中,circ_0001287+miR-21组细胞增殖率(78.25%±3.01%)低于circ_0001287+阴性组(90.88%±3.51%,P<0.05)。
2.7 circ_0001287对PTEN蛋白表达的影响
与空白组(0.98±0.02)相比,用35.5 mmol·L-1葡萄糖处理的高糖组ARPE-19细胞PTEN蛋白表达(0.31±0.03)显著下调(P<0.05),而circ_0001287组ARPE-19细胞PTEN蛋白表达(0.56±0.04)较阴性组(0.42±0.02)增加(P<0.05),circ_0001287+miR-21组ARPE-19细胞PTEN蛋白表达量(0.70±0.04)则高于circ_0001287组(P<0.05)(图5)。

1:阴性组;2:circ_0001287组;3:circ_0001287+阴性组;4:circ_0001287+miR-21组。
3 讨论
有研究发现,早期糖尿病大鼠RPE细胞胞体变薄,基底膜面褶皱增多[7-8]。与正常条件下培养的RPE细胞相比,高糖环境下培养的RPE细胞的增生受到明显抑制[9-10]。
circRNA是一种具有环状结构的非编码RNA[11-12],具有丰富的功能性miRNA结合位点,可充当miRNA海绵,从而间接调节靶基因表达[4,13-16]。如circ_PSEN1通过吸附miR-200b-3p可下调cofilin-2表达,进而改善高糖处理的RPE细胞的铁下垂[15]。circ_0084043通过吸附miR-140-3p和调节转化生长因子α表达抑制了高糖诱导的人RPE细胞损伤[12]。此外,circ_0041795通过miR-646/血管内皮生长因子C促进高糖诱导的RPE细胞凋亡和炎症反应,从而加剧DR进展[16]。因此,circRNA被认为是DR进展的关键调节因子。本研究中,我们通过circRNA芯片筛选得到包括hsa_circ_0001287在内的4种circRNA,其表达均降低。RT-PCR验证circ_0001287在高糖诱导的ARPE-19细胞中的相对表达量也降低,相反miR-21表达升高。既往研究发现,circ_0001287可吸附miR-21并抑制其表达,间接影响肺癌细胞的增殖和转移[17]。在本研究中,我们同样发现,上调circ_0001287表达可改善高糖诱导的ARPE-19细胞增殖活性,说明circ_0001287在DR进展中发挥了负向调控作用,这为circ_0001287作为DR治疗的潜在靶点提供了新的证据。
此外,生物信息学分析提示circ_0001287和miR-21之间可能存在结合位点。本实验中,双荧光素酶报告基因检测、RIP实验、pull-down实验和RT-PCR均证实,circ_0001287可吸附miR-21并负向调节其表达。随后,实验结果显示:circ_0001287+miR-21组细胞增殖率低于circ_0001287+阴性组。这些数据表明,circ_0001287可能作为miR-21的竞争性内源RNA来发挥作用。DR与血管内皮细胞功能障碍有关,miR-21具有保护内皮细胞和视网膜神经节以及调节氧化应激和炎症反应的作用。研究表明,miR-21可通过负向调控PTEN,从而增加下游血管内皮生长因子表达,促进血管生成,加重视网膜病变进程,下调miR-21表达则能保护视网膜神经节[18]。李雷等[19]研究发现,miR-21的表达在DR的发生发展过程中起着至关重要的作用,DR患者血浆中miR-21含量较单纯糖尿病患者和健康人群显著升高。在链脲佐菌素诱导的DR和缺血诱导的视网膜新生血管的啮齿类动物模型中也报告了miR-21的高表达[20]。另外,Usui-Ouchi等[21]发现,玻璃体中miR-21水平升高与视网膜纤维化相关,并进一步确定miR-21是在PDR发病机制中起重要作用的候选纤维化miRNA。本研究结论与这些研究相似,故推测miR-21可能参与了DR的病情发展,其表达水平与疾病进展呈正相关。
10号染色体上缺失的PTEN基因编码一种蛋白磷酸酶,该磷酸酶反向调节磷酸肌醇-3激酶(PI3K)/蛋白激酶B(Akt)信号通路,从而调节多种细胞发育[22]。研究表明,视网膜特异性PTEN基因敲除可激活PI3K/Akt通路,引起视网膜中间神经元的病理改变[8,23],或者促使hRPE细胞向间充质细胞表型转化[24]。本研究中,我们也发现PTEN在ARPE-19细胞中受到高糖浓度和miR-21下调的反向调节。这些结果提供了PTEN间接参与miR-21介导的ARPE-19细胞高糖凋亡过程的直接证据。但目前尚不清楚PTEN发挥这种作用的确切机制是什么,这将是我们未来进一步研究的重点。
4 结论
circ_0001287在phRPE细胞和高糖诱导的ARPE-19细胞中表达下调,上调circ_0001287可通过吸附miR-21和激活PTEN表达从而抑制糖尿病性RPE细胞损伤。本研究目前仅在细胞层面验证了上调circ_0001287对RPE细胞的保护作用。然而,高糖所致视网膜损伤涉及多种病理机制,其过程十分复杂,具体致病机制尚需进一步深入研究。另外,circ_0001287调控机制中是否有其他通路间接参与糖尿病眼病,仍需进一步实验加以验证。
