Nei核酸内切酶Ⅷ样蛋白1对过氧化氢诱导的晶状体上皮细胞凋亡与自噬的影响△
2023-12-13鲍思洁李鹏飞康丽华王从玉王思文管怀进
鲍思洁 李鹏飞 康丽华 王从玉 王思文 管怀进
白内障是一种以晶状体混浊为特征的眼部疾病,是全球主要的致盲性眼病,年龄相关性白内障(ARC)是其最常见的类型,多见于50岁以上的中老年人,其发病率随年龄增长而升高。随着我国人口老龄化加重,ARC患者的人数将持续增加,由此导致的视力障碍与失明将为社会带来巨大的经济负担[1]。晶状体上皮细胞(LECs)是覆盖在晶状体前表面的单层上皮细胞,它的功能状态与晶状体的透明性和内环境稳定密切相关[2]。过度的氧化应激(外源性紫外线、内源性含氧自由基等)导致LECs凋亡增加使其屏障功能受损,从而引起晶状体内环境紊乱,导致晶状体混浊的发生[3-4]。目前,超声乳化吸除术是治疗白内障的首选方法,然而对于尚未达到手术指征的初发期白内障尚无有效药物延缓其进展。因此,探究ARC的形成与进展的病理机制对预防或延缓ARC发生发展具有重要意义。Nei核酸内切酶Ⅷ样蛋白1(NEIL1)作为DNA糖基化酶,负责在真核细胞碱基切除修复途径(BER)中识别并切除损伤碱基基团,维持基因组稳定性[5]。近年来,不少研究发现,NEIL1除了参与DNA损伤修复外,还在凋亡、炎症和肿瘤发生等过程中发挥重要作用[6-8]。此外,一些BER通路修复酶被发现还可以调节自噬环节[9],因此我们推测NEIL1也有可能参与自噬的调节。然而,NEIL1在ARC发生过程中的调控机制尚不明确。因此,本研究检测了NEIL1在ARC患者晶状体前囊膜及H2O2诱导的SRA01/04细胞氧化损伤模型中的表达水平,以及NEIL1过表达对SRA01/04细胞活力、凋亡与自噬的影响,为探究ARC的发病机制及其防治策略提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验标本
选取2021年10月至2022年10月在南通大学附属医院眼科住院并行白内障超声乳化术的ARC患者以及接受透明晶状体摘除术的黄斑前膜的对照患者各10例,收集入组患者的临床资料及术中剥离的晶状体前囊膜。ARC患者年龄55~68(60.3±7.7)岁,其中男5例,女5例;对照患者年龄55~69(61.2±7.8)岁,其中男4例,女6例。两组患者之间的年龄、性别差异均无统计学意义(P=0.67、0.67)。ARC患者纳入标准:晶状体混浊且年龄为50~80岁,最佳矫正视力(BCVA)≤0.5。ARC患者排除标准:(1)先天性、并发性、外伤性、代谢性、药物及中毒性白内障等其他类型的白内障;(2)合并青光眼、高度近视、外伤等眼部疾病;(3)合并高血压、糖尿病、心血管疾病等氧化损伤相关的全身性疾病。对照患者纳入标准:晶状体透明且年龄为50~80岁;BCVA≥0.6。对照患者排除标准:(1)合并晶状体脱位、青光眼、近视、糖尿病视网膜病变、葡萄膜炎等其他眼部疾病;(2)合并糖尿病、自身免疫性疾病、肾脏病、癌症等全身性疾病。本研究通过南通大学医学院伦理委员会审批(批号:2021-L091),所有患者均签署知情同意书。
1.1.2 细胞与主要实验试剂
人晶状体上皮细胞系SRA01/04细胞由浙江大学眼科中心姚克教授团队馈赠。DMEM培养液、胎牛血清(FBS)、胰蛋白酶和细胞培养板(美国Gibco公司);NEIL1过表达质粒和空载体质粒(中国Public Protein/Plasmid Library); Trizol试剂(美国Invitrogen公司);逆转录试剂盒(中国诺唯赞生物科技股份有限公司);GAPDH引物和NEIL1引物(中国生物工程股份有限公司);BCA蛋白定量试剂盒、一抗稀释液、二抗稀释液、CCK-8试剂盒和线粒体膜电位与细胞凋亡检测试剂盒(中国碧云天生物技术有限公司);GAPDH抗体、辣根过氧化物酶标记的山羊抗兔荧光二抗(中国爱博泰克生物公司);ATG7抗体(英国Abcam公司);NEIL1抗体、P62抗体、Beclin1抗体、LC3-I抗体、LC3-II抗体、Bax抗体、Bcl-2抗体(美国Proteintech公司)。
1.2 方法
1.2.1 细胞培养及分组处理
将SRA01/04细胞复苏稳定传代后接种至细胞培养板,加入完全培养基(DMEM培养基+体积分数10% FBS+10 g·L-1青链霉素),然后置于37 ℃、含体积分数5%CO2的细胞培养箱中培养。将SRA01/04细胞随机分为对照组、OE-Vector组和OE-NEIL1组,采用RT-PCR和Western blot检测过表达效率;将SRA01/04细胞随机分为对照组、H2O2组、OE-Vector H2O2组、OE-NEIL1 H2O2组,采用CCK-8法检测细胞活力,Western blot检测自噬相关蛋白和凋亡相关蛋白的表达,荧光染色法检测细胞凋亡与线粒体膜电位情况。其中,对照组:正常培养24 h,不进行特殊处理;H2O2组:用含400 μmol·L-1H2O2的完全培养基培养24 h;OE-Vector组:转染过表达空载体质粒后正常培养24 h;OE-NEIL1组:转染过表达NEIL1质粒后正常培养24 h;OE-Vector H2O2组:转染过表达空载体质粒并用含400 μmol·L-1H2O2的完全培养基培养24 h;OE-NEIL1 H2O2组:转染过表达NEIL1质粒并用含400 μmol·L-1H2O2的完全培养基培养24 h。
1.2.2 细胞转染
当细胞融合度达到60%~70%时,在6孔板每孔中加入已混匀并室温孵育15 min的Lipofectamine®3000和2 μg质粒混合液,之后置于培养箱中孵育,再进行后续实验。
1.2.3 RT-PCR检测
根据Trizol试剂盒的步骤提取两组患者晶状体前囊膜样本和各组细胞中的RNA。按照逆转录试剂盒说明书设计逆转录反应体系和反应时间。以GAPDH为内参,用2-△△Ct分析各组细胞中NEIL1 mRNA表达情况,实验均重复3次。GAPDH:上游引物为5’-TGAAGGTCGGAGTCAACGGATTTGGT-3’,下游引物为5’-CATGTGGGCCATGAGGTCCACCAC-3’;NEIL1:上游引物为5’-CCTACCGCATCTCAGCTTCAG-3’,下游引物为5’-GTCCACGAAACATAGGGCGAG-3’。
1.2.4 Western blot检测蛋白表达
细胞分组处理后,在细胞样本中加入蛋白裂解液,冰上反应10 min,将初步裂解的细胞自培养板上刮除转移至离心管,在4 ℃冰箱中继续反应30 min,然后高速离心,收集蛋白上清后按照BCA蛋白定量试剂盒说明书步骤行蛋白定量。随后以150 V、70 min 的凝胶电泳条件分离蛋白;以250 mA、90 min的转膜条件对目的蛋白进行湿转;将载有目的蛋白的PVDF膜置于浓度5 g·L-1脱脂牛奶中室温(20~25 ℃)下封闭1~2 h;用PBS洗涤封闭结束的PVDF膜,然后将其置于含适量一抗(GAPDH抗体稀释比例为110 000;NEIL1、P62、Beclin1、LC3-I、LC3-II、Bax抗体稀释比例均为11 000;ATG7抗体稀释比例为1800;Bcl-2抗体稀释比例为1500)的塑封膜中,4 ℃孵育16~18 h。TBST洗涤,置于山羊抗兔荧光二抗(稀释比例110 000)室温下孵育1 h,TBST再次洗涤,最后曝光显影。
1.2.5 CCK-8实验检测细胞活力
SRA01/04细胞以每孔1×104个接种于96孔板,每组设置6个平行孔,待细胞分组处理后,按照CCK-8试剂盒要求向每孔中加入CCK-8溶液(操作过程中注意避光),避光孵育1~2 h,酶标仪测定450 nm 的吸光度。
1.2.6 荧光染色检测活细胞与凋亡细胞情况
SRA01/04细胞以每孔5×104个接种于24孔板中,待细胞分组处理后,用PBS清洗,在每孔中依次加入 Annexin V-FITC结合液、Annexin V-FITC、线粒体红色荧光探针染色液和DAPI细胞核染色液,操作过程中注意避光,然后室温(20~25 ℃)避光孵育30 min。最后,在荧光显微镜下避光拍摄,并行细胞计数。
1.3 统计学方法
实验数据分析均采用Graphpad prism 9统计软件进行。所有实验均重复3次,数据以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。检验水准:α=0.05。
2 结果
2.1 ARC患者和对照患者晶状体前囊膜样本中NEIL1 mRNA的表达情况
RT-PCR检测结果显示,与对照患者晶状体前囊膜样本中NEIL1 mRNA表达量(1.00±0.05)相比,ARC患者晶状体前囊膜样本中NEIL1 mRNA表达(0.19±0.02)显著降低(P=0.020)。
2.2 H2O2处理对SRA01/04细胞中NEIL1 mRNA表达的影响
RT-PCR检测结果显示,与对照组(1.00±0.02)相比,经400 μmol·L-1H2O2处理24 h后的H2O2组SRA01/04细胞中NEIL1 mRNA表达(0.27±0.02)显著降低(P=0.000)。
2.3 NEIL1过表达质粒转染效率验证
RT-PCR检测结果显示,对照组与OE-Vector组SRA01/04细胞中NEIL1 mRNA相对表达水平分别为(1.01±0.27)与(0.98±0.12),两组相比差异无统计学意义(P=0.830);OE-NEIL1组SRA01/04细胞中NEIL1 mRNA的相对表达水平(33.38±3.54)显著高于OE-Vector组,差异有统计学意义(P=0.000)(图1A)。Western blot检测结果显示,OE-Vector组(0.98±0.02)与对照组(1.00±0.02)SRA01/04细胞中NEIL1蛋白表达水平相比差异无统计学意义(P=0.999),OE-NEIL1组中NEIL1 蛋白表达水平(4.30±0.02)较OE-Vector组显著升高,差异有统计学意义(P=0.000)(图1B)。
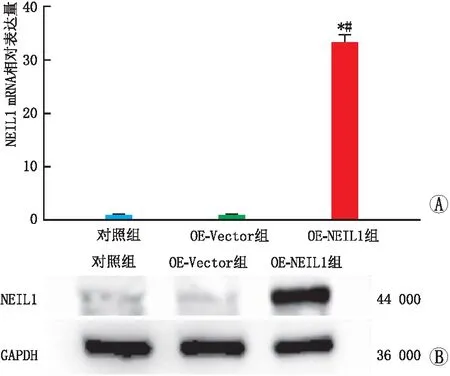
A:RT-PCR检测NEIL1过表达后NEIL1 mRNA的相对表达水平;与对照组相比,*P<0.05;与OE-Vector组相比,#P<0.05。B:Western blot检测NEIL1过表达后NEIL1的蛋白表达。
2.4 NEIL1过表达对H2O2处理的SRA01/04细胞的影响
2.4.1 NEIL1过表达增加H2O2处理的SRA01/04细胞活力
CCK-8实验结果显示,对照组、H2O2组、OE-Vector H2O2组、OE-NEIL1 H2O2组SRA01/04细胞活力分别为(100.00±0.83)%、(63.54±1.59)%、(63.50±0.34)%、(111.00±7.2)%;与对照组相比,H2O2组和OE-Vector H2O2组SRA01/04细胞活力均显著降低(均为P=0.000),OE-NEIL1 H2O2组中SRA01/04细胞活力显著增加(P=0.040),且H2O2组与OE-Vector H2O2组SRA01/04细胞活力相比差异无统计学意义(P=0.999)。以上结果提示,NEIL1的过表达可增加H2O2处理的LECs的细胞活力。
2.4.2 NEIL1过表达增加H2O2处理的SRA01/04细胞自噬
Western blot检测结果(图2)显示,与对照组相比,H2O2组SRA01/04细胞中Beclin1与P62蛋白表达水平均降低(均为P=0.000),ATG7、LC3-I、LC3-II蛋白表达水平两组相比差异均无统计学意义(均为P>0.05)。H2O2组与OE-Vector H2O2组SRA01/04细胞中ATG7、Beclin1、LC3-I、LC3-II和 P62蛋白表达水平均差异均无统计学意义(均为P>0.05)。当NEIL1过表达后,OE-NEIL1 H2O2组SRA01/04细胞中早期自噬相关蛋白ATG7、LC3-I和Beclin1的表达水平均较OE-Vector H2O2组显著升高(均为P=0.000),并且OE-NEIL1 H2O2组SRA01/04细胞中晚期自噬相关蛋白LC3-I和P62的表达水平也均较OE-Vector H2O2组显著升高(P=0.000、0.005)。以上结果表明,NEIL1过表达可促进H2O2处理的SRA01/04细胞自噬。
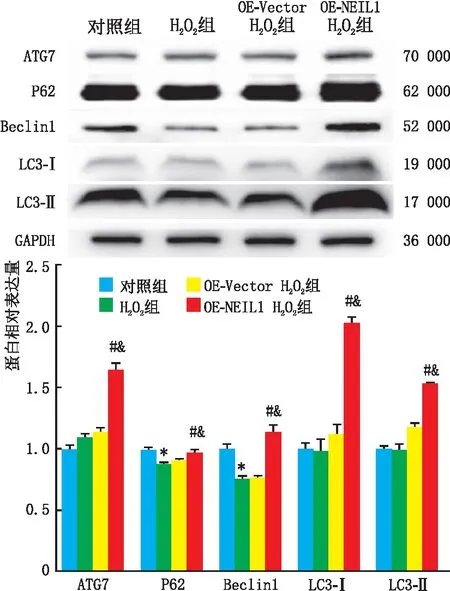
与对照组相比,*P=0.000;与H2O2组相比,#P<0.05;与OE-Vector H2O2组相比,&P<0.05。
2.4.3 NEIL1过表达抑制H2O2处理的SRA01/04细胞凋亡
Western blot检测结果(图3)显示,与对照组相比,H2O2组SRA01/04细胞中促凋亡标志蛋白Bax的表达水平显著升高,而抗凋亡标志蛋白Bcl-2表达水平显著降低(均为P=0.000)。同时,H2O2组与OE-Vector H2O2组SRA01/04细胞中Bax、Bcl-2蛋白表达水平差异均无统计学意义(P=0.200、0.200)。与OE-Vector H2O2组相比,OE-NEIL1 H2O2组中Bax蛋白表达水平显著降低,而Bcl-2蛋白表达水平显著升高(P=0.000、0.006)。
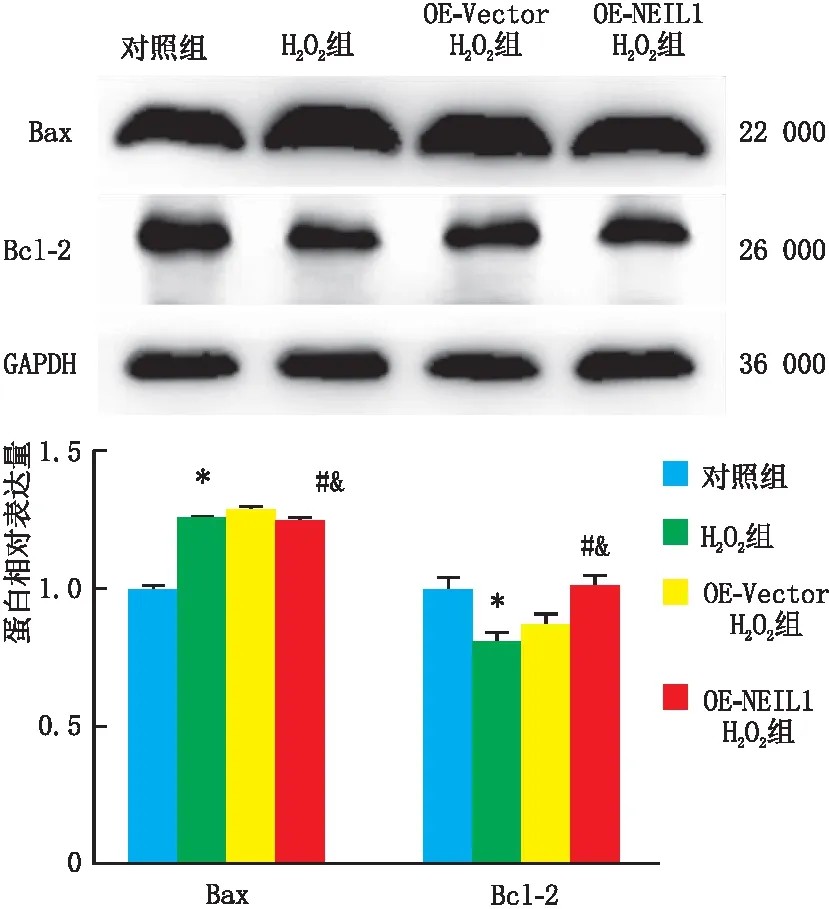
与对照组相比,*P=0.000;与H2O2组相比,#P<0.05;与OE-Vector H2O2组相比,&P<0.05。
荧光染色实验结果(图4)显示,与对照组[(100.00±10.41)个]相比,H2O2组SRA01/04细胞中Mito-Tracker红色荧光标记的保持线粒体膜电位的活细胞数[(17.36±2.86)个]显著减少,Annexin V-FITC绿色荧光标记的凋亡细胞数[(382.54±15.31)个]较对照组[(100.00±10.30)个]显著增多,差异均有统计学意义(均为P=0.000)。与H2O2组相比,OE-Vector H2O2组SRA01/04细胞中红色荧光标记的活细胞数[(19.37±2.89)个]与绿色荧光标记的凋亡细胞数[(391.32±24.38)个]差异均无统计学意义(均为P>0.05)。与OE-Vector H2O2组相比,OE-NEIL1 H2O2组SRA01/04细胞中红色荧光标记的活细胞数[(48.90±5.98)个]明显增加,绿色荧光标记的凋亡细胞数[(221.90±23.13)个]明显减少,差异均有统计学意义(均为P=0.000)。以上结果表明,NEIL1过表达可以抑制H2O2诱导的SRA01/04细胞凋亡。
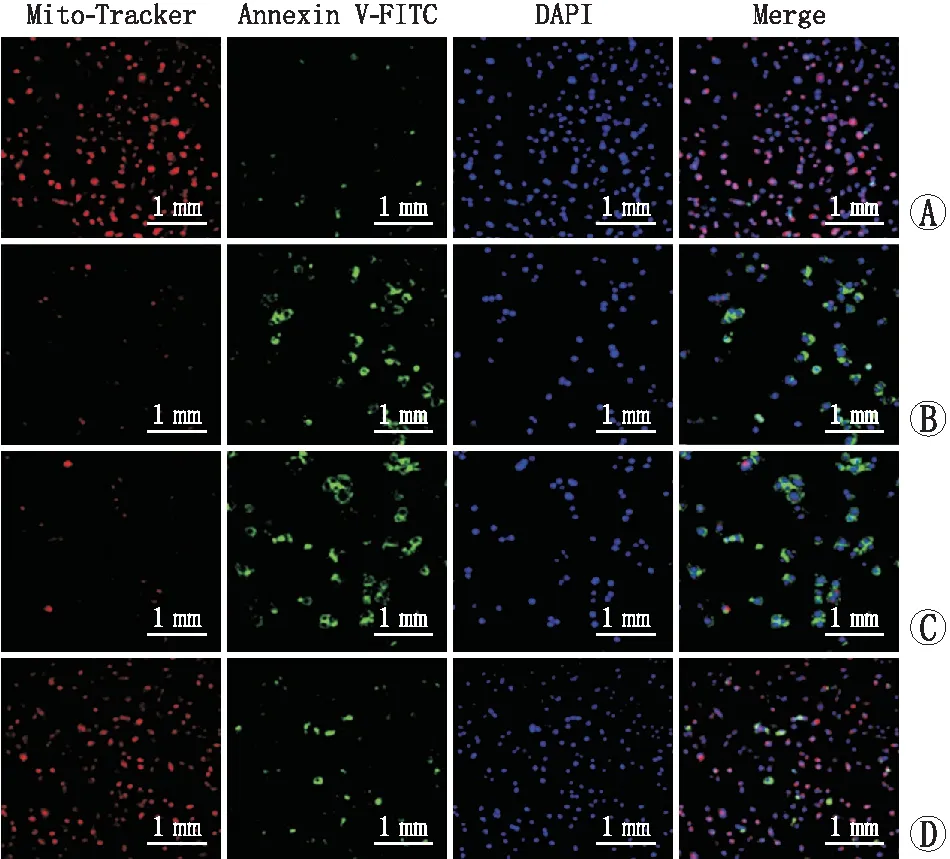
A:对照组;B:H2O2组;C:OE-Vector H2O2组;D:OE-NEIL1 H2O2组。
3 讨论
ARC是一种多因素导致的眼科疾病,其发病机制尚未完全揭示,目前一致认为氧化应激是ARC发病的主要机制之一[10]。随着年龄增长与机体衰老,晶状体内含氧自由基等氧化应激因素的增加和DNA氧化损伤修复功能的减弱使损伤的DNA因无法及时修复而逐渐堆积,从而引起LECs功能障碍,最终导致ARC的发生[11-15]。DNA氧化损伤修复系统主要包括BER、核苷酸切除修复、直接修复和错配修复等途径,这些途径的有效运行依赖于相应的氧化损伤修复基因的稳定表达[16]。NEIL1编码的DNA糖基化酶是启动真核细胞BER途径的关键酶[17]。研究发现,NEIL1基因失活或表达下调引起的DNA氧化损伤堆积与多种疾病的发生关系密切[18-19]。本研究我们观察到,ARC患者晶状体前囊膜样本中NEIL1 mRNA的表达显著下调,这提示ARC的发生与NEIL1的表达下调具有相关性。然而,NEIL1在ARC中的具体作用仍不明确。
细胞凋亡是一种程序性细胞死亡形式,对于维持细胞内稳态至关重要[20]。研究发现,NEIL1能够调节细胞凋亡,参与疾病的发生发展[21-22]。Han等[23]通过CRISPR/Cas9基因组编辑技术分别构建了NEIL1/2/3基因敲除的小鼠胚胎干细胞模型,并发现当NEIL1缺乏时会导致线粒体DNA氧化损伤,从而触发TP53介导的细胞凋亡,导致颅神经嵴细胞发育缺陷。因此,NEIL1可保护神经嵴细胞内的mtDNA在分化过程中免受氧化损伤,抑制其凋亡。此外,Xue等[6]发现在结直肠癌细胞中,NEIL1可显著抑制人结肠癌细胞凋亡,增加细胞活力,从而促进肿瘤细胞增殖。可见,NEIL1对多种细胞的凋亡具有明显的抑制作用。在ARC的发病机制中,LECs凋亡是重要分子病理基础[24]。为探究NEIL1对LECs凋亡的影响,本研究使用外源性H2O2处理LECs模拟氧化应激环境,并观察到凋亡标志蛋白Bax表达上调而抗凋亡标志蛋白Bcl-2表达下调,同时Annexin V-FITC标记的凋亡细胞显著增多,均提示细胞凋亡水平升高。然而,NEIL1过表达明显逆转了上述指标,表明NEIL1可保护SRA01/04细胞免受H2O2诱导的氧化应激损伤,降低细胞凋亡水平。此外我们还检测到,H2O2处理后SRA01/04细胞的线粒体膜电位明显下降,而在NEIL1表达升高的同时,线粒体膜电位得到显著恢复,如前所述,NEIL1也可能对mtDNA具有一定的修复作用,但仍需进一步的实验去探索。
自噬作为另一种形式的程序性细胞死亡,是一个依赖于溶酶体的分解代谢过程,通过降解细胞内的异常物质和功能失调的细胞器来维持细胞稳态[25]。不少研究发现自噬有助于稳定晶状体内环境以保持其透明性[26-27]。然而有研究发现,氧化应激诱导下,晶状体过度活跃的自噬反应反而导致细胞活力丧失,从而进一步促进了白内障的进展[28-29]。在哺乳动物的自噬流过程中,Beclin1作为装配地点将各种自噬蛋白招募至自噬前体,参与自噬体的形成;LC3从可溶性形式(LC3-I)变为脂质修饰形式(LC3-II)是自噬的关键步骤,其中LC3-II代表成熟的自噬小体;ATG7对于LC3-I脂化生成LC3-II至关重要;P62作为自噬底物直接与LC3-II结合,并通过自噬选择性降解[30-31]。因此,本实验将Beclin1、ATG7、LC3-I、LC3-II和P62作自噬发生的生物标志物。为检测NEIL1对氧化应激条件下LECs自噬的影响,我们检测了上述蛋白的表达情况,结果发现,NEIL1过表达显著上调了促LC3-I自噬前体蛋白(ATG7和Beclin1)的表达,与之一致的是,LC3-I型自噬前体也明显增加。此外,我们也检测了成熟自噬小体标志蛋白LC3-II和自噬降解底物蛋白P62的表达,在过表达NEIL1后,LC3-II的表达随着LC3-I型自噬前体的增加也明显升高。尽管一些研究认为P62的表达升高是自噬流阻断的标志[32],然而在本研究中,NEIL1过表达引起P62的表达出现轻微升高。鉴于自噬流是一个动态调控的细胞生物学过程,还涉及多种细胞器(如内质网、线粒体和溶酶体)参与协同调控,因此,在我们后续的研究中会进一步深入探讨这个现象。综上,在氧化应激条件下,NEIL1主要通过促进LC3-I型自噬前体的形成过程维持LECs内环境的稳定,增加LECs的活力,从而减少凋亡的发生。
4 结论
本研究证实NEIL1在ARC患者和细胞氧化损伤模型中表达均显著降低,在机制上,NEIL1可能通过调控LECs的凋亡和自噬参与ARC的发生发展。本研究结果有望为探究ARC的发病机制及其防治策略提供理论基础。
