基于Nrf2/BNIP3通路探讨苓桂术甘汤改善心肌梗死诱导大鼠心力衰竭的作用及机制
2023-12-12莫佳佳汤同娟黄金玲
王 翔,莫佳佳,汤同娟,周 鹏,黄金玲
(1. 安徽中医药大学护理学院,安徽 合肥 230012;2.合肥医工医药股份有限公司,安徽 合肥 230601;3.安徽省药物再创新工程技术研究中心,安徽 合肥 230601;4. 安徽中医药大学中西医结合学院,安徽 合肥 230012)
急性心肌梗死简称心梗,被认为是心力衰竭发生最常见及最重要的起始因素之一[1],而心室重构是心梗后引发心衰的基本病理基础,并贯穿心衰的始终[2]。因此,减缓或逆转心梗后心室重构是治疗心衰的关键。研究发现[3]氧化应激参与了心室重构的病理生理过程,是心室重构的重要启动机制之一。通过调控氧化应激途径进行有效的抗氧化治疗可改善梗死后心室重构,阻抑心衰的发展[4]。课题组前期研究表明中药复方苓桂术甘汤可有效延缓心室重构、改善心衰模型大鼠心功能[5-6]。近期研究发现,该方可以通过调节Nrf2/BNIP3 通路减轻心肌细胞氧化应激损伤,发挥心肌保护作用[7]。基于此,本研究旨在探讨苓桂术甘汤抑制心室重构防治心衰的作用机制是否与调节Nrf2/BNIP3信号通路有关。
1 材料与方法
1.1 动物60只SD大鼠(♂、体质量180~220 g)购自济南朋悦实验动物繁育有限公司,动物许可证号为SCXK(鲁)2019-003,饲养环境:温度(20~24 ℃),湿度(40%~60%)。
1.2 药物苓桂术甘汤由茯苓(2005181)12 g、桂枝(2005181)9 g、白术(2002202)9 g、甘草(1911 041)6 g组成,药物饮片均购于安徽普仁中药饮片有限公司。参照课题组前期的提取方法[8]将苓桂术甘汤制备成含4.8 g生药/g的干浸膏,分装密封后保存于4 ℃冰箱。卡托普利片(1012016080156)购于中孚药业股份有限公司。
1.3 试剂与仪器ROS、SOD检测试剂盒(CA1410、BC0175)、天狼星红染色液试剂盒(G1470)购自北京Solarbio;NT-proBNP、BNP检测试剂盒(RX302959R、RX302462R)购自泉州睿信生物科技有限公司;CytC抗体(11940)购自美国CST 公司;Nrf2抗体(ab137550)、 BNIP3抗体(ab109362)、VDAC抗体(ab154856)、LaminA抗体(ab8980)、GAPDH抗体(ab181602)购自美国Abcam公司。 ACUSON OXANA彩色多普勒超声诊断仪(德国西门子公司),ECG-2303B数字心电图机(广州市三锐电子科技有限公司),ATOM全自动酶联免疫工作站(意大利MAROCHE),Tanon6600发光成像工作站(上海Tanon),H-7500型透射电镜(日本HITACHI)。
1.4 动物分组与给药动物适应性饲养一周后,剔除不合格动物后参考文献[9]并结合课题组前期经验,选用6-0眼科缝合线结扎冠状动脉左前降支制备心梗模型。假手术(Sham)组大鼠采用同样的手术方式,但仅穿线不打结。每只大鼠予8万U/d的青霉素溶液腹腔给药,连续3 d,预防感染。结扎14 d后,将存活的模型大鼠随机分成3组:模型(Model)组、苓桂术甘汤(LGZGD)组(剂量为4.2 g·kg-1)[6,10]和卡托普利(Captopril)组(剂量为0.002 57 g·kg-1),每组各10只。LGZGD组、Captopril组采用灌胃给药,容积为10 mL·kg-1,Model组和Sham组灌以等容积的蒸馏水,每天1次,连续28 d。
1.5 标本制备与采集行超声检测后,于腹主动脉处采取血液样本,分离血清,分装标记好后放入-80 ℃的冰箱中保存备用。腹主动脉取血后,快速取出心脏,用冰的PBS溶液反复冲洗后剪去心耳、脂肪等附属物,并用滤纸将液体吸干。在心脏结扎点之下进行横切,一部分组织固定于4%多聚甲醛中用做天狼星红染色及免疫荧光检测,一部分固定在2.5%戊二醛中用做透射电镜分析,一部分组织剪成小块后立即液氮速冻并放入-80 ℃的冰箱中冻存用做Western blot检测。
1.6 观察指标与检测方法
1.6.1超声心动图检测大鼠心脏功能 于末次灌药后24 h,1%戊巴比妥钠(50 mg·kg-1)腹腔注入对大鼠进行麻醉,固定备皮后在二维超声引导下,通过M超在左室长轴切面水平测量左室收缩末内径(left ventricular internal dimension systole,LVIDs)、左室舒张末期内径(left ventricular internal dimension diastole,LVIDd)、左室射血分数(left ventricular ejection fraction,LVEF)以及左室短轴缩短率(left ventricular fractional shortening,LVFS)。
1.6.2ELISA法检测血清BNP、NT-proBNP浓度 根据试剂盒说明采用ELISA法检测大鼠血清中BNP、NT-proBNP的浓度。
1.6.3天狼星红染色检测心肌组织胶原纤维变化 将固定好的心脏组织切片,厚度6 μm,常规脱蜡水化;weigert铁苏木素染色液染色10 min;水洗5 min,蒸馏水洗一次;天狼星红染色液滴染1 h;切片用水冲洗,脱水,清除,用中性树胶密封;随机选取一个视野运用显微镜(×400)拍照。
1.6.4免疫荧光法检测心肌组织ROS、微量法检测心肌组织SOD 称取新鲜心肌组织,匀浆,低温离心,取上清。ROS检测:在96孔板中加入上清液与探针,混匀避光孵育后采用荧光分光光度计检测荧光强度。SOD按照试剂盒说明书检测。
1.6.5透射电镜检测心肌组织线粒体超微结构 心肌组织用PBS冲洗干净后,修剪成1 mm×1 mm×2 mm长条状,2.5%浓度的戊二醛磷酸缓冲液固定2 h。然后在0.1 mol·L-1磷酸中漂洗和洗涤3次,1%锇酸固定液固定3 h,而后用0.1 mol·L-1磷酸漂洗液漂洗3次;脱水浸透包埋后,取出包埋样品,用切片机将该组织切片切成超薄切片(50~70 nm);用乙酸双氧铀+柠檬酸铅双重电子染色后用透射电镜进行观察。
1.6.6Western blot法检测CytC、Nrf2蛋白表达 提取心肌组织蛋白、线粒体蛋白、细胞浆蛋白、细胞核蛋白,凝胶电泳后转膜,加入合适浓度的一抗(CytC 1 ∶1 000、Nrf2 1 ∶1 000)孵育过夜,加入一定浓度的二抗,洗膜,将膜蛋白面与化学发光剂充分接触5 min,然后用Tanon 6600发光成像工作站进行检测并使用Image Pro Plus 6.0软件分析蛋白相对表达量。
1.6.7免疫荧光法检测心肌组织Nrf2、BNIP3的表达 制作石蜡切片,脱蜡修复,滴入浓度为5%的BSA封闭,滴加一抗(Nrf2 1 ∶200,BNIP3 1 ∶150),4 ℃孵育过夜;PBS清洗。切片甩干后,滴加二抗,室温下孵育60 min,并避光;PBS清洗,滴加DAPI染液,室温下避光孵育5 min;PBS清洗,滴加适量防荧光淬灭剂,树脂封片剂封片,使用荧光显微镜在630×倍视野下随机选择视野进行拍照。
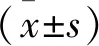
2 结果
2.1 各组大鼠死亡率及行为体征变化情况在药物干预的28 d内,Model组大鼠有2只死亡,其余各组均无死亡。此外,实验过程中Sham组大鼠进食进水量正常,活动状态良好,毛发有光泽,没有稀便;Model组大鼠进食饮水量减少,活动性下降,喜聚堆,毛发不荣偏于萎黄,部分大鼠大便不成形,肛门周围有污物;而LGZGD组及Captopril组活动状态较Model组好,且LGZGD组大鼠,觅食积极性增加,毛发较为光滑,鲜出现稀便。

Fig 1 Ultrasound images of rats and analysis of ultrasonic index of rats in each
2.2 苓桂术甘汤对心梗后心衰大鼠心功能的影响如Fig 1所示,与Sham组大鼠比较,Model组大鼠的LVEF与LVFS均明显降低(P<0.01),表明心肌梗死后大鼠的心功能严重受损;LVIDd和LVIDs均明显增加(P<0.01),表明心梗后心衰大鼠的左室出现了较为严重的扩张,心室重构明显;而用LGZGD或Captopril治疗后LVEF和LVFS均有明显的升高(P<0.01),且左室扩张导致的心室内径的增大也得到了明显的改善(P<0.01),表明苓桂术甘汤可改善心梗后心衰大鼠的心功能。
2.3 苓桂术甘汤对心梗后心衰大鼠血清BNP、NT-proBNP的影响BNP、NT-proBNP被指南推荐为心梗后心衰的诊断、病情严重程度及预后的重要评价指标。如Fig 2所示,Model组BNP、NT-proBNP较Sham组明显升高(P<0.01),表明心肌梗死导致心衰的过程可使大量BNP、NT-proBNP合成并释放入血,而用LGZGD或Captopril治疗后可使上述指标得到明显改善(P<0.01),表明苓桂术甘汤可以防治心衰的发展。
2.4 苓桂术甘汤对心梗后心衰大鼠心肌组织胶原纤维变化的影响细胞外基质成分的改变是除细胞结构和功能的改变之外心室重构的另一重要病理改变。如Fig 3所示,Sham组大鼠心肌组织可见少量红染丝状纤维,但没有明显的红色胶原沉积,且肌丝排列有序且紧密;Model组大鼠心肌组织可看到胶原呈束状浸润性分布,且有大量的红色胶原纤维沉积,肌丝排列紊乱;LGZGD或Captopril的治疗改善了上述病理改变,红色胶原物质在两组的心肌细胞中明显减少,极大改善了胶原沉积。表明苓桂术甘汤可以减轻心肌间质胶原的过度沉积。
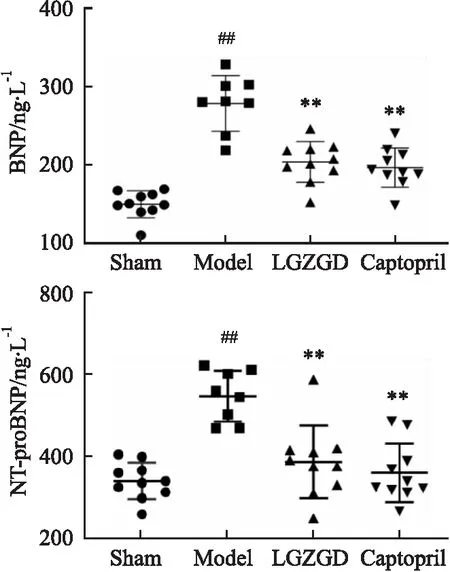
Fig 2 Changes of serum BNP and NT-ProBNP in rats of each
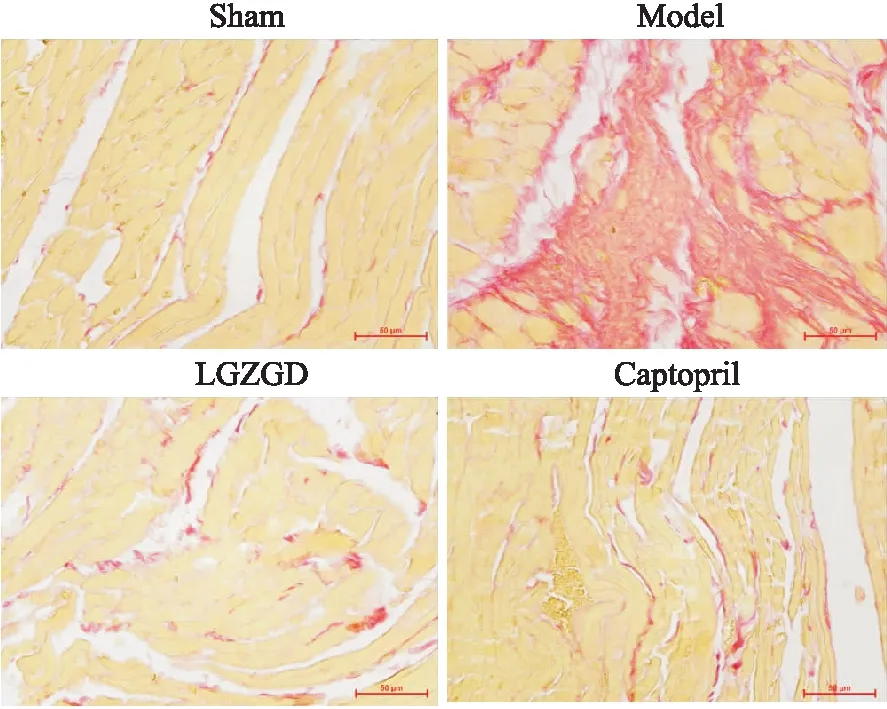
Fig 3 Sirius staining results of myocardial tissue of rats in each group(×400)
2.5 苓桂术甘汤对心梗后心衰大鼠心肌组织ROS、SOD的影响如Fig 4所示:与Sham组相对比,Model组大鼠心肌组织中的ROS水平升高(P<0.01),且伴随着SOD活性明显下降(P<0.01);而经LGZGD或Captopril治疗后,与Model组相比较,ROS水平明显降低(P<0.01),而SOD活性明显提升(P<0.01),上述结果表明苓桂术甘汤具有减轻心梗后心衰大鼠氧化应激的作用。
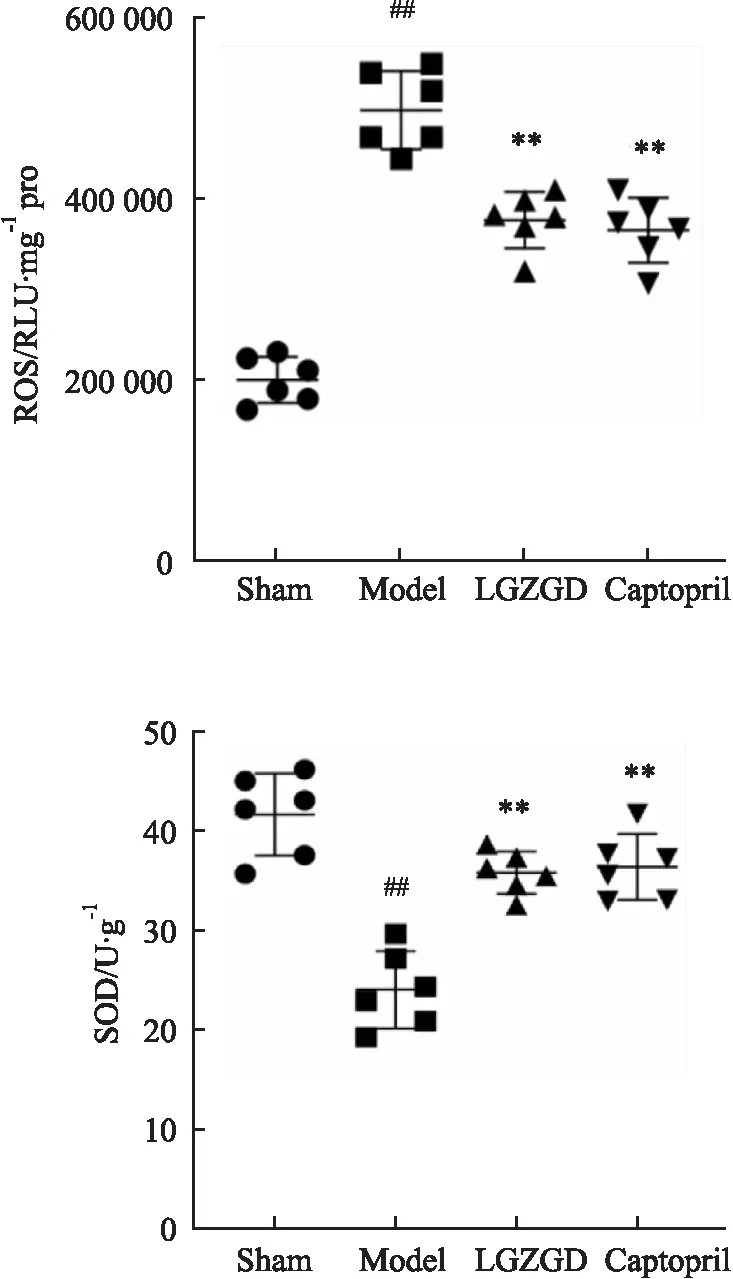
Fig 4 Detection results of oxidative stress indicators |ROS, SOD in rat myocardial )
2.6 苓桂术甘汤对心梗后心衰大鼠线粒体损伤的影响如Fig 5 所示,Sham组线粒体排列有序,形态与数量均正常,线粒体嵴结构清晰、排列整齐;在Model组大鼠心肌组织的线粒体上可观察到一部分发生固缩变小,一部分发生肿胀或者外膜破损或呈明显空泡化,部分线粒体出现嵴断裂;LGZGD或Captopril治疗后,大鼠心肌组织线粒体肿胀程度与空泡化明显减轻,嵴大致趋于正常。上述结果表明苓桂术甘汤可有效抑制氧化应激所致的线粒体损伤。
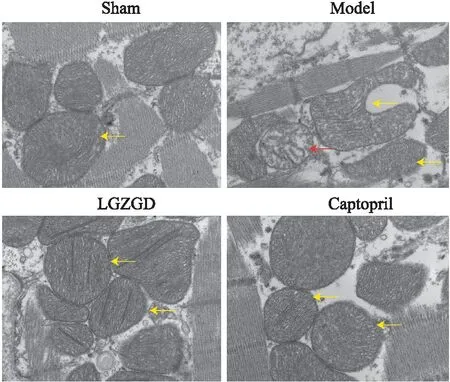
Fig 5 Observation of structure changes of mitochondria in myocardial tissue of rats in each group under electron microscope (×10k)
2.7 苓桂术甘汤对心梗后心衰大鼠心肌组织线粒体CytC、细胞质CytC的影响CytC的释放是细胞线粒体途径凋亡的标志。如Fig 6所示,相对于Sham组,Model组大鼠线粒体CytC降低、细胞质CytC含量升高,差异均具有统计学意义(P<0.01),表明心梗后心衰大鼠心肌细胞线粒体中的CytC释放到细胞质;而经LGZGD或Captopril治疗后,与Model组相比,线粒体CytC含量明显升高(P<0.05),而细胞质CytC含量明显降低(P<0.05),上述结果表明苓桂术甘汤可减少线粒体CytC的释放,抑制线粒体凋亡途径。
2.8 苓桂术甘汤对心肌组织Nrf2、BNIP3表达的影响如Fig 7、8所示,与Sham组相比,Model组Nrf2表达量上升(P<0.01),且有少量Nrf2入核(P<0.05);与Model组相比,LGZGD或Captopril组Nrf2表达量明显上升(P<0.01),且Nrf2大量入核(P<0.01)。如Fig 9所示,Sham组中的BNIP3荧光强度较低,表达量较少;与Sham组相比,Model组绿色荧光强度增强,BNIP3表达量明显上升(P<0.01);与Model组相比,LGZGD和Captopril荧光强度降低,BNIP3表达量明显下降(P<0.01)。提示苓桂术甘汤可以促进Nrf2的表达及核移位,降低BNIP3的表达。

Fig 6 Mitochondrial CytC and cytoplasmic CytC test results of myocardial cell apoptosis indexes in each )
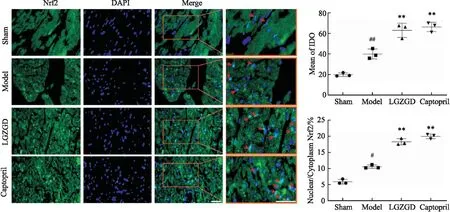
Fig 7 Immunofluorescence staining of Nrf2 in myocardial tissue ,n=3)

Fig 8 Mitochondrial Nrf2 and cytoplasmic Nrf2 test results of myocardial cell apoptosis indexes in each
3 讨论
AMI后心室重构为AMI后心室在大小、形态、结构与功能上发生改变的过程。研究表明[3]心梗后的心室重构涉及氧化应激的产生,而由氧化应激引起的细胞凋亡效应参与心室重构的全过程。心肌细胞的凋亡主要通过线粒体途径与死亡途径产生,其中线粒体途径在细胞凋亡中发挥着不可或缺的作用,当线粒体受氧化应激诱导时,ROS可介导线粒体损伤,线粒体结构与功能会发生亚水平上的重构,激活凋亡细胞激酶,并将凋亡基因调节蛋白如CytC等释放入细胞质,进一步诱导细胞的凋亡,使心肌组织功能受损加剧,心脏重构加重,最终导致心衰。
Nrf2是一种氧化应激敏感的转录因子,已被证明受ROS水平的影响,一旦被激活,它可以由细胞质转移进入细胞核内,通过影响ROS的合成、控制内源性抗氧化剂产生来维持细胞氧化还原稳态,有效抵御细胞的损伤与凋亡。研究发现Nrf2在心血管疾病的防治中发挥着重要的调控作用[11]。敲除Nrf2基因的小鼠会出现左心室舒张功能障碍,并迅速从心脏代偿适应过渡到心衰,而过表达的Nrf2可有效保护受H2O2诱导的心肌损伤后心肌细胞线粒体的形态和功能[12-13]。受Nrf2调控的BNIP3是最新发现的氧化应激线粒体传感器[14],ROS的增加可诱导其激活,激活后的BNIP3可进入线粒体外膜,引起线粒体的肿胀,促进CytC的释放进而介导线粒体功能障碍,导致细胞凋亡或死亡[15]。同时被激活的BNIP3基因亦可促进ROS的产生,加重线粒体功能的失调[16]。研究表明[17]BNIP3参与诱导心梗后的心室重构过程,下调BNIP3可减少体内细胞凋亡,抑制心肌梗死后诱发的心室重构,有效防治小鼠心衰的发展。
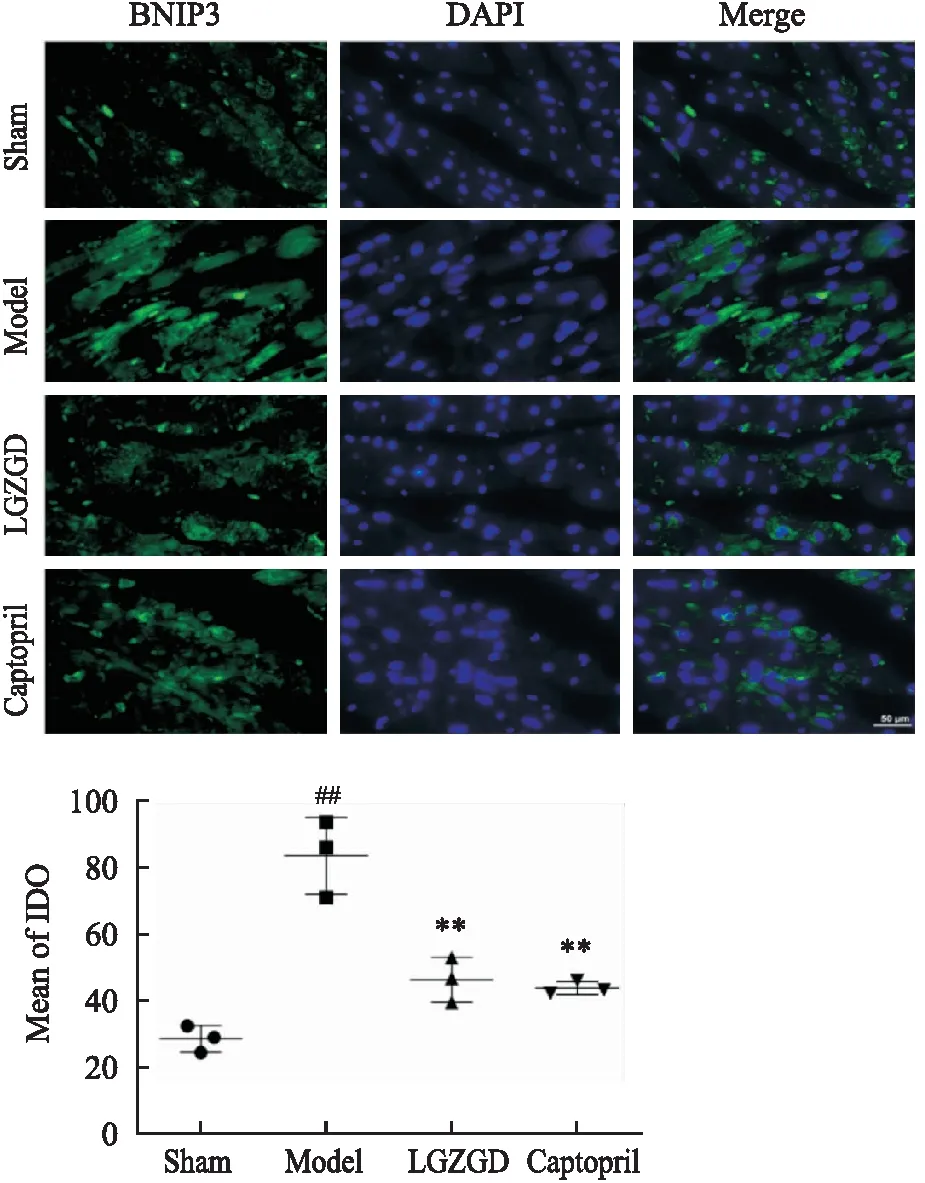
Fig 9 Immunofluorescence staining of
研究发现[18]冠脉成功结扎后的2~6周即可形成心衰。因此本实验在前期研究的基础上,于结扎后的第14 天开始给药,连续给药28 d。超声结果表明模型大鼠出现了左心室的扩张,心室顺应性的降低(LVIDs、LVIDd升高),左室泵血功能降低(LVEF、LVFS下降),结合模型大鼠血清中心衰标志物BNP、NT-proBNP的明显升高,以及心肌细胞出现坏死及严重的纤维化,表明大鼠的心脏功能严重受损,提示心梗后心衰模型建立成功。Captopril为血管紧张素转化酶抑制剂,是临床上治疗心力衰竭的基础用药之一,本研究选择captopril作为阳性对照药物,在研究中发现captopril及LGZGD均能有效降低心衰大鼠的死亡率,但相对于captopril,LGZGD可明显改善模型大鼠的毛发光泽度、提高食欲、减少其稀便症状,在提高心衰大鼠的生存质量上具有独特优势。另本研究发现在模型动物心肌组织中可检测到ROS的升高与SOD的降低,表明氧化应激参与了心梗后心衰的过程,且透射电镜结果显示心梗后心衰模型大鼠出现线粒体结构的损伤。线粒体受氧化应激损伤后,引起模型动物线粒体CytC的大量释放,导致了心脏功能的障碍。此外,免疫荧光及Western blot结果显示模型动物Nrf2 蛋白核转运应激性增加,BNIP3蛋白表达明显增加,这些变化提示氧化应激引起了Nrf2 的解离,促进BNIP3的高表达,从而启动了线粒体凋亡途径。而LGZGD的干预可以减轻心梗后心衰模型大鼠的氧化应激水平,保护线粒体结构,减少心肌细胞的凋亡,且可促进Nrf2的核移位,降低BNIP3的表达,从而发挥治疗心衰的作用。值得注意的是,在本研究中LGZGD干预后随着心肌组织细胞Nrf2的核移位的明显增加,胞质中Nrf2蛋白表达却无明显降低,这可能与LGZGD干扰了Keap1-Nrf2结合,使Nrf2从泛素化系统中释放,从而减少Nrf2的降解,补偿细胞质的Nrf2有关[19-20]。
综上,本研究以影响心衰进程中心室重构的主要影响因素—氧化应激为主要切入点,提出并证实了Nrf2/BNIP3通路参与心梗后心衰病理生理过程的重要分子机制,为心衰的防治提供了潜在的有效治疗靶点。通过实验发现,苓桂术甘汤对心梗后心衰大鼠外在表征、心脏功能、组织病理学、线粒体功能、蛋白表达等各个层面均有较好的改善与调节作用,充分反映了中药复方多层面、多环节、多靶点的综合治疗作用,为经方防治心衰的临床应用提供了一定的理论与实验依据。
