Cuprizone 诱导的多发性硬化疾病动物模型的特点及应用
2023-12-12琳王异民王伟王珊盘美良孙伟强樊卫平石建云
李 琳王异民王 伟王 珊盘美良孙伟强樊卫平石建云*
(1.山西医科大学基础医学,太原 030001;2.山西医科大学细胞生理学教育部重点实验室,太原 030001;3.河南科技学院动物科技学院,河南 新乡 453003)
多发性硬化(multiple sclerosis, MS)是以人类中枢神经系统(central nervous system,CNS)炎性脱髓鞘为主要特点的神经退行性疾病,同时也是自身免疫性疾病[1-2]。MS 的病因未知,遗传因素、环境因素、自身免疫等都可能诱发该病,该病除了以CNS炎性脱髓鞘为主要特点外,还伴有胶质细胞增生、轴突损伤以及淋巴细胞和巨噬细胞的炎性浸润,这些病变能够侵犯CNS 的各个部位从而导致患者出现各种临床症状,如头晕、视力下降、言语不清、四肢无力、震颤、步态不稳、共济失调、疼痛等[3]。在我国MS 的发病率呈逐年升高的趋势,多数患者会反复发作,症状逐渐加剧,最终造成严重的残疾,是青年人致残的主要疾病,同时它的并发症可导致患者死亡,然而目前尚无有效的药物或技术手段来根治此病,因此深入了解动物模型,在研究MS 的发病机制和防治药物上具有重要意义。
MS 常用的动物模型有病毒诱导的模型(泰勒鼠脑炎病毒模型)、通过免疫诱导的模型(实验性自身免疫性脑脊髓炎模型)以及毒性物质诱导的模型(Cuprizone 模 型)。泰 勒 鼠 脑 炎 病 毒(Theiler’ s murine encephalomyelitis virus, TMEV)模型通过脑内注射TMEV 病毒诱导,模拟由病毒介导的急性和原发进展型MS[4]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)模型常由髓鞘少突胶质细胞糖蛋白诱导,适用于研究适应性免疫应答引起的脱髓鞘研究[4]。双环己酮草酰二腙(cuprizone,CPZ)是一种铜离子螯合剂,可诱导小鼠CNS 产生脱髓鞘病变,是研究MS 常用的毒性模型[5]。与TMEV 和EAE 模型相比,CPZ 模型操作简单、重现性高,并且成本相对较低,即给小鼠饲喂CPZ 3~5 周后就可诱导的小鼠CNS 脱髓鞘,停止饲喂后即可发生复髓鞘,因此是研究MS 脱髓鞘和髓鞘再生的理想模型。本文将详细介绍CPZ模型以及在该模型上进行的一些特色疗法,为CPZ模型在科研与医学实践中的广泛应用提供理论依据。
1 Cuprizone 模型构建及其诱导的小鼠CNS 的病理变化
购买3~5 周的C57BL/6 小鼠,正常喂养1 周来减少应激反应并适应新环境,随后在日常饲料中添加0.25%的CPZ 用来饲喂小鼠。CPZ 喂养1 周后,少突胶质细胞出现凋亡,星形胶质细胞和小胶质细胞被激活,但髓鞘未观察到损伤和异常[5]。同时,少突胶质细胞内可以检测到压力变化,此外也可检测到极少量的少胶质细胞祖细胞,但并未被观察到其有明显的增殖现象(图1A)。CPZ 喂养1~3 周后,少突胶质细胞凋亡增多,同时星形胶质细胞和小胶质细胞大量聚集增生(图1B)[5]。组织学染色或电镜可观察到胼胝体发生了脱髓鞘[6],然而在该阶段使用免疫组化技术检测CPZ 小鼠和正常小鼠,只能观察到轻微的差异,此外该阶段初次观察到急性轴突损伤。CPZ 饲喂3~5 周后,大量少突胶质祖细胞出现并激活,星形胶质细胞和小胶质细胞增生更加严重[5]。小胶质细胞被激活并吞噬髓鞘,使得脱髓鞘更加显著,同时急性的轴突损伤也越发明显(图1C)。若此时停止饲喂CPZ,小鼠则会逐步出现髓鞘再生现象(图1D)。若坚持CPZ 饲喂12~13周,则会出现慢性脱髓鞘病变[5]。CPZ 诱导的脱髓鞘主要发生于大脑胼胝体和体感皮质区,少量出现在大脑其他部位(如海马、嗅球、喉前联合、视交叉、脑干、纹状体等)、小脑、脊髓和内囊。胼胝体脱髓鞘后会导致运动协调能力受损。采用CPZ 模型能够很好的观察到MS 的病理变化,如脱髓鞘、轴突损伤、轻度血脑屏障损伤以及严重的氧化损伤,因此是研究MS 的理想模型之一。
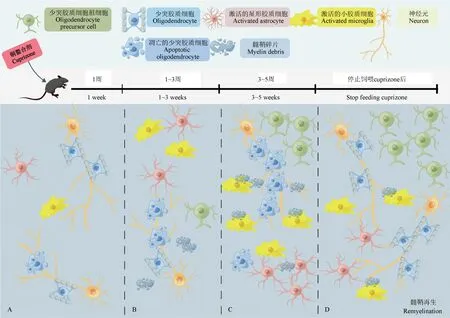
注:A:CPZ 饲喂1 周;B:CPZ 饲喂1~3 周;C:CPZ 饲喂3~5 周;D:CPZ 停止饲喂。图1 CPZ 模型的病理发展过程Note.A, CPZ was fed for 1 week.B, CPZ was fed for 1~3 weeks.C, CPZ was fed for 3~5 weeks.D, CPZ was stopped from feeding.Figure 1 Pathological development of CPZ model
CPZ 饲喂小鼠后会使小鼠体重减轻,因此在建立CPZ 模型的过程中,尚未到剖杀时间点时可通过检测小鼠体重来初步判断是否建模成功,到达剖杀时间点后则可通过组织学检测来判断。因此,CPZ建模时应注意将不同体重的小鼠平均分配到每个小组,同时性别混匀,从而保证数据的可靠性[7]。另外,有文献报道CPZ 饲料制作成颗粒状后,因未知原因会造成CPZ 失活,模型建立不成功[6]。此外,谭笔琴等[8]发现对小鼠采用CPZ 灌胃法要比传统的饲料中添加CPZ 更有优势,不仅缩短了实验时间(灌胃3 周后就可以观察到脱髓鞘现象),同时CPZ 剂量也可以控制从而保证了模型的精准性。王娓娓等[9]通过检测髓鞘碱性蛋白、LFB 染色、转杆测试等方法比较了CPZ 诱导雌性和雄性小鼠的脱髓鞘差异,发现CPZ 更容易诱导雄性小鼠脱髓鞘。因此建议购买雄性小鼠,同时每日的饲料现配现喂,并采用灌胃形式。
2 Cuprizone 模型中各类神经细胞的研究
2.1 少突胶质细胞
CPZ 通过与少突胶质细胞内线粒体呼吸链中的细胞色素C 氧化酶(线粒体复合物IV)的铜离子螯合,造成线粒体功能障碍,引起能量代谢异常,导致少突胶质细胞凋亡继而产生脱髓鞘病变,是CPZ小鼠发生脱髓鞘病变的关键[10]。Fischer 等[11]在MS 患者尸检的脑组织中发现线粒体氧化损伤,能量不足,活性氧增多,表明MS 患者的CNS 出现了线粒体功能障碍,线粒体呼吸链复合物缺乏或酶活性降低可导致轴突能量衰竭而变性,参与MS 发生和发展。因此,CPZ 小鼠是研究线粒体功能障碍和能量代谢诱导的MS 脱髓鞘的的理想模型。
少突胶质细胞由少突胶质细胞祖细胞(oligodendrocyte progenitor cells, OPCs)分化而来,包裹轴突形成髓鞘,并释放营养因子来维持轴突生存,保护神经元。正常情况下,OPCs 存在于前脑脑室下区、后脑和脊髓的腹侧区,处于相对静止状态,数量稳定[5]。当脱髓鞘时,OPCs 被激活,体积增大,表达硫酸软骨素蛋白聚糖。CPZ 模型后期可观察到髓鞘再生现象,髓鞘再生依赖于OPCs 的激活、增殖、迁移和成熟,这一过程被多种转录因子调控。
2.2 星形胶质细胞
在CPZ 模型上星形胶质细胞被激活并增生。星形胶质细胞约占总的神经胶质细胞的30%,活化的星形胶质细胞表达胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP),因此GFAP 抗体可检测活化的星形胶质细胞[12]。星形胶质细胞在脱髓鞘过程中被认为是发挥有害作用,但它在参与髓鞘碎片的清除以及髓鞘再生过程中被认为是有益的[13]。巴雷斯实验室的研究显示,CNS 的神经炎症或缺血会导致星形胶质细胞极化,产生有害和有益的两种星形胶质细胞[13-14]。借用国际上对小胶质细胞极化的分类方法,他们将不同极化的星形胶质细胞命名为A1 星形胶质细胞(有害)和A2 星形胶质细胞(有益)[15]。Liddelow 等[14]在MS、阿尔茨海默病、帕金森等神经退行性疾病中不同的大脑区域内观察到A1 星形胶质细胞上调,发现它的上调与一些神经元变性的基因有关,如补体(complement 3, C3)。而A2 星形胶质细胞则表达了许多神经营养因子,有助于修复受损的突触和神经元[16]。有研究显示活化的小胶质细胞诱导了星形胶质细胞的激活,说明星形胶质细胞极化与小胶质细胞的状态有关[17],反过来活化的星形胶质细胞是否影响小胶质细胞的极化依然不清楚。
2.3 小胶质细胞
在CPZ 模型的病变部位有明显的小胶质细胞聚集和增生。小胶质细胞本质上是神经系统中的巨噬细胞,约占CNS 中总胶质细胞的5%~20%,一般为静息状态,在CNS 受到损伤时被激活。Ca2+结合接头蛋白分子(ionized calcium binding adapter molecule 1,IBA-1)表达于小胶质细胞和巨噬细胞[18]。在CPZ 饲喂1 周时,脑内只有少量巨噬细胞聚集,所以该阶段可用IBA-1 抗体来检测小胶质细胞[5]。此外小胶质细胞的活化标志物3(microglia activation marker 3,MAC-3)表达于活化的小胶质细胞,因此MAC-3 抗体可用于检测活化的小胶质细胞[18-19]。根据局部微环境的不同,小胶质细胞可分化为M1 和M2 两种表型。M1 型小胶质细胞被激活后,分泌IL-1β(interleukin-1β)、IL-6(interleukin-6)、IFN-γ(interferon-γ)、NO(nitric oxide)、TNF-α(tumor necrosis factor-α)等促炎性因子和具有神经毒性的物质,同时减少神经营养物质的分泌,导致神经组织的损伤加重[14,20]。而M2 型小胶质细胞则可减轻局部炎症,清除细胞碎片和嗜酸性粒细胞,分泌抗炎性因子如IL-10(interleukin-10)、IL-3(interleukin-3)、TGF-β(transforming growth factor-β)等,分泌神经营养因子BDNF(brain derived neurotrophic factor)和GDNF,促进髓鞘再生[14,21]。通过检测M1 细胞的标志物iNOS(inducible nitric oxide syntheses)和M2 细胞的标志物Arg1(Arginase-1),发现M1 和M2型小胶质细胞同时存在于CPZ 诱导的小鼠模型中,说明小胶质细胞对小鼠脱髓鞘病变既有利又有害。有报道显示,CPZ 模型中,小胶质细胞对神经元和少突胶质细胞祖细胞发挥了毒性作用,同时释放蛋白酶、炎性因子和自由基等引发CNS 炎症反应[22]。另外,对CPZ 模型小鼠使用小胶质细胞抑制剂(17β-雌二醇、米诺环素)后减轻了脱髓鞘病变[23],说明抑制小胶质细胞活化对髓鞘有保护作用。
3 采用Cuprizone 模型探究髓鞘再生
给小鼠饲喂CPZ 5 周后停止,小鼠则会逐步出现髓鞘再生现象。少突胶质细胞包裹轴突形成髓鞘并跳跃式传导动作电位,而脱髓鞘影响了动作电位的传播导致相应的临床症状如四肢无力、偏瘫等。髓鞘再生能够恢复髓鞘结构,在轴突代谢以及传播动作电位过程中是必不可少的。髓鞘再生依赖于OPC 的激活、增殖、迁移和成熟,从而产生新的少突角质细胞包裹轴突[24]。同时,髓鞘再生也与髓鞘碎片的清除有关,激活的小胶质细胞和星形胶质细胞无法完全吞噬并清除髓鞘碎片并分泌毒性介质,这也是阻碍髓鞘再生的原因之一[15]。
血小板源性生长因子(platelet-derived growth factor, PDGF)是OPCs 的丝裂原,调控OPCs 的增殖[25]。Lampron 等[25]发现PDGFR-α 与胰岛素样生长激素-1 (insulin-like growth factor 1,IGF-1)的低表达与髓鞘碎片清除不足有关,从而导致OPC 募集和增殖受损。Shen 等[26]发现髓鞘碎片的聚集会刺激IFN-γ (interferon-γ)表达增多,抑制OPC 成熟,导致髓鞘形成受损。IFN-β(interferon-β)能够增强小胶质细胞对髓鞘碎片的吞噬能力,Kocur 等[27]发现IFN-β 的低表达导致了髓鞘碎片清除效率低,髓鞘再生不足。Ren 等[28]发现Quaking 信号蛋白参与了髓鞘碎片的清除,该基因的缺失会导致小胶质细胞吞噬碎片能力减弱。Dong 等[29]和Cignarella等[30]发现Trem2 能够调节小胶质细胞对髓鞘碎片的清除。因此,及时清除髓鞘碎片、减少毒性介质分泌和增加OPC 的增殖和分化可在一定程度上促进MS 患者的髓鞘再生。
4 采用 Cuprizone 模型探究MS 的特色疗法
4.1 中药
中药的使用在我国源远流长,是非常具有民族特色的治疗方法。我国有许多学者采用CPZ 模型研究中药对MS 的作用,获得了巨大进展。大麻素通过调节Nkx2.2 (NK2 homeobox 2)蛋白增加了JN(Juxtanodin)蛋白的表达,从而促进髓鞘再生和修复[31]。邢雁霞等[32]发现黄芪多糖能够增加髓鞘碱性蛋白(myelin basic protein,MBP)的表达,减少髓鞘损失,同时还抑制小胶质细胞的聚集,增加了CPZ小鼠的体重。于佳等[33]发现槲皮素增加了MBP、少突胶质细胞转录因子 2 ( oligodendrocyte transcription factor 2,Olig2)以及环核苷酸-3’磷酸水解酶(cyclic nucleotide-3’ phosphate hydrolase,CNPase)蛋白的表达,减少了小鼠胼胝体的脱髓鞘病变。徐芳等[34]发现二氢丹参酮Ⅰ干预后的CPZ小鼠体内M1 型小胶质细胞的百分比减少,胼胝体的脱髓鞘减少,说明二氢丹参酮Ⅰ可能通过调节小胶质细胞极化来减轻CNS 的炎症反应。
4.2 益生菌
Gharehkhani 等[35]在CPZ 模型上发现干酪乳杆菌T2 能够降低炎症小体NLRP (nucleotide-binding and leucine-rich repeat protein)、IFN-γ 以 及IL-4(interleukin 4)的表达,从而减少炎症反应缓解脱髓鞘症状[36-37]。杨昊等[37]发现复合益生菌制剂能够使CPZ 小鼠回肠绒毛排列整齐、结肠腺体增多、炎性细胞浸润减少、黏蛋白即紧密连接蛋白表达增多,改善了肠道通透性,从而通过肠-脑轴使得脑内LPS (lipopolysaccharide)水平降低,TLR4(toll like receptor 4)、NF-κB(nuclear factor-κB)及p-IκB/IκB(inhibitor κB)蛋白表达下降,改善了CPZ 诱导的脱髓鞘症状。
4.3 物理方法
有研究显示对CPZ 小鼠使用低频磁疗干预后,通过LFB 染色和检测MBP 发现低频磁疗组小鼠的胼胝体区脱髓鞘明显减少,同时IL-1β 和TNF-α 的表达均显著降低,说明低频磁疗有助于改善小鼠的脱髓鞘和抑制炎症反应[38]。郑碧娥等[39]发现与CPZ 组相比,磁疗组小鼠体重有增长趋势,MBP 和BDNF 的表达均有显著增多,同时磁疗组小鼠的运动障碍得到了明显改善,说明磁疗可能改善了脑内BDNF 的表达,从而改善了CPZ 小鼠的脱髓鞘。
5 总结
2018 年的MS 患者的生存报告显示我国约有200 万名MS 患者,其中约80%患者为复发缓解型MS。关于MS 的脱髓鞘病变目前存在两种假说:(1)由内向外诱导产生脱髓鞘,即因神经元变性或轴突损伤等引起包裹轴突的髓鞘受损,从而产生脱髓鞘;(2)由外向内诱导产生脱髓鞘,即因少突胶质细胞变性、坏死、凋亡等造成髓鞘损伤,引发脱髓鞘,同时暴露轴突,引起轴突损伤[4]。MS 的发病机制复杂,病因不明,患者需接受长期治疗且不能彻底治愈,因此深入了解动物模型,有助于探究MS 的发病机制和研发更有效的治疗药物。
目前常用的MS 的动物模型有CPZ 模型、TMEV 模型和EAE 模型。TMEV 模型和EAE 模型均适用于模拟由外向内引起的脱髓鞘[4]。与EAE和TMEV 模型相比,CPZ 模型更适用于模拟由内向外引起的脱髓鞘,比如少突胶质细胞损伤 /自噬等引起的脱髓鞘,以及与线粒体障碍、能量代谢异常、氧化应激等相关的研究。另外,与EAE 和TMEV 模型相比,CPZ 模型操作简单、安全、易于使用、成本低,是探究MS 的病理机制和新药研发的理想模型,因其包括脱髓鞘和髓鞘再生两个过程,尤其是适用于研究复发-缓解型MS。因此,根据不同动物模型的特点,选择适合的模型开展研究,对科研工作意义重大。
