基于铁死亡治疗衰老及衰老相关疾病的研究进展
2023-12-12周永昌陶思曼陈胜强蒲秀瑛
周永昌,陶思曼,陈胜强,蒲秀瑛
(兰州理工大学 生命科学与工程学院,兰州 730050)
铁死亡(ferroptosis)是一种非调节性的细胞死亡形式,以铁依赖性和过量脂质过氧化物(lipid peroxides,LPO)为特征[1]。自2012 年这一概念被首次提出至今已有十年,虽然铁死亡的详细机制尚未完全阐述清楚,但已有研究表明铁死亡与各种疾病之间有着千丝万缕的联系。衰老是一种不可逆的生理过程,同时也是衰老相关疾病的致病因素,为了揭示衰老及衰老相关疾病的秘密,人们提出了许多机制来解释它们的发生发展,铁死亡即是其中之一[2]。有报道称,随着年龄的增长,在肾、脾、肝、卵巢、子宫、小脑和骨髓中均有铁死亡发生并伴有铁积累[3]。有鉴于此,许多铁死亡治疗药物也应运而生。如经典的铁死亡抑制剂Ferrostatin-1(Fer-1)、Liproxstatin-1 (Lip-1)等在被使用后能抑制铁死亡延缓疾病进程[4]。其中,传统中医药显现出了极大潜力,黄芩苷、黄芪多糖等都被证明具有良好的铁死亡治疗效果[5-7]。因此,阐述铁死亡与衰老及衰老相关疾病的关系,梳理治疗铁死亡介导的衰老及衰老相关疾病的复方或单一天然化合物显得十分必要。本文将总结近年来中医药在治疗与铁死亡有关的衰老及衰老相关疾病中的研究进展,讨论铁死亡在其中的作用和治疗机制,进一步明确相关靶点,以期为铁死亡治疗药物的开发提供思路。
1 铁死亡概述
铁死亡是新近提出的一种非凋亡细胞死亡模式,主要以铁离子依赖性和脂质过氧化为特征。一经提出便受到了国内外研究者们的热切关注,人们开始深入探索铁死亡的作用机制,寻找铁死亡与疾病间的联系。经过十余年的研究和发展,铁死亡的发生机制有了长足的进步,多种假说陆续提出并被证明。主要有:(1)铁稳态破坏:当铁死亡发生后,铁代谢发生紊乱,细胞内铁稳态被打破,铁离子大量蓄积,引发细胞内氧化应激和脂质过氧化物积累[1,8];(2)胱氨酸/谷氨酸反向转运蛋白(System Xc-):胞外的胱氨酸被SystemXc-(SLC7A11是SystemXc-的轻链亚基) 摄取进入细胞内,在NADPH 的辅助下转化为半胱氨酸,然后经过两步过程合成谷胱甘肽(glutathione,GSH)。当SLC7A11(或抑制System Xc-)被抑制时,会引起GSH 的耗竭,导致铁死亡[9];(3)谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4):GPX4 与GSH 协同作用将细胞膜上过度积累的脂质过氧化物还原为脂质醇,减少ROS 和氧化应激,抑制铁死亡[9];(4)线粒体(mitochondria):线粒体促进铁死亡机制主要有三种。第一,线粒体产生的ROS 促进脂质过氧化诱导铁死亡[10];第二,线粒体是ATP 的生产细胞器,AMPK 失活促进铁死亡[11];第三,线粒体储存着三羧酸(tricarboxylic acid,TCA)循环和各种补充TCA 循环的同源反应,线粒体可能通过调节TCA 循环来促进铁死亡[12]。综上所述,已发现了许多铁死亡调控通路和靶点,相关的作用机制也得到了阐明,但铁死亡的研究仍处在初始阶段,需要更多的研究成果来丰富铁死亡研究领域。
2 铁死亡与衰老及衰老相关疾病的关系
2.1 铁死亡在细胞衰老中的作用
细胞衰老是机体衰老的标志,伴随着细胞衰老,衰老细胞中的铁离子水平呈指数级增长,几乎是正常细胞的十倍有余,并且这种衰老进程可以被N-叔丁基羟胺(N-tert-butylhydroxylamine,一种抗氧化剂)抑制[13],这说明细胞内铁离子的累积会引发氧化应激和细胞功能障碍,导致细胞衰老[14]。而铁死亡的重要标志就是细胞内铁离子的升高和活性氧的产生,这似乎将铁死亡指向了细胞衰老,但是二者之间的关系具体如何不得而知。
最近的研究发现,衰老后的晶状体上皮细胞和肾小管细胞对铁死亡非常敏感。Wei 等[15]研究显示,由Erastin 诱导的铁死亡在55thFHL124 细胞中比15th的FHL124 细胞更加显著;且在体内实验中发现,RAS-selective lethal 3(RSL3)诱导的铁死亡仅在20 月龄小鼠的晶状体外植体中的晶状体上皮细胞发生,在3 月龄的小鼠中无明显诱导作用[15]。另一项研究表明,衰老的肾小管细胞更易发生铁死亡,衰老发生后,肾小管细胞中的花生四烯酸-5-脂加氧酶(properties of 5-lipoxygenases,ALOX5)被上调,GPX4 水平下调;有趣的是,RSL3 诱导的铁死亡可以选择性地消除衰老的肾小管细胞[16]。此外,研究人员在阿霉素诱导的衰老细胞和旁分泌衰老细胞中也发现了铁死亡和亚铁离子积累,并提出了两种广谱的抗衰老方法,分别是铁死亡诱导和亚铁激活前药[17]。Ding 等[18]也发现,当骨骼肌卫星细胞细胞膜上的TfR1 蛋白水平下降,SLC39A14 蛋白水平升高时,老年啮齿类动物(80 周龄)骨骼肌发生不稳定铁积累,进而激活衰老骨骼肌中的铁死亡,在使用Fer-1 抑制这一过程后,小鼠的运动能力得到提高;研究者还收集了临床治疗后发生骨折的年轻(年龄<30 岁)和老年(年龄>60 岁)患者的肌肉样本,观察后发现铁代谢相关基因(Slc39a14)、脂肪生成相关基因(Pparγ、Adiponectin、Fasn和Cd36)和铁生成相关基因(Hmox1、Sat1 和Ptgs2)的失调;这些数据表明,铁死亡可能是衰老骨骼肌中未被认识的细胞死亡形式之一[18]。Zheng 等[3]开发了一种用于特异性检测铁死亡的单克隆抗体-HNEJ-1,检测后发现,随着年龄增长,铁死亡在各个器官中增加,出现显著的年龄依赖性。Zhang 等[19]研究发现,晚期传代的间充质干细胞(mesenchymal stem cells,MSCs)细胞凋亡和铁死亡增加,尤其是线粒体和溶酶体发生了显著变化。这些证据表明,衰老的细胞对铁死亡十分敏感,在细胞衰老的过程中有可能发生了铁死亡。
另外,Shu 等[20]认为,铁死亡是细胞衰老的下游效应;他们发现他汀类药物(Statins)能够诱导脂肪组织衰老,在此过程中香叶基香叶基焦磷酸(geranylgeranyl pyrophosphate,GGPP)的水平被降低,衰老过程在补充GGPP 后受到抑制,但给予Fer-1 并不会影响GGPP 的表达;这说明脂肪组织中的铁死亡可能是由细胞衰老和ROS 增加引起,铁死亡是脂肪组织衰老的促进因素[20]。此外,也有学者认为细胞衰老是拮抗铁死亡的一种手段。Masaldan等[21]报道称,当细胞发生衰老后细胞内的铁离子水平最多达到正常细胞的30 倍,且衰老的过程不受到铁螯合剂的干扰。该研究认为细胞衰老改变了细胞内铁的获取和储存,由于衰老细胞中极高的铁离子水平,所以对铁死亡产生了抵抗作用[21]。另一项研究发现,衰老软骨细胞能够抵抗铁死亡引起的细胞死亡,这种抵抗作用可能是由于兴奋性氨基酸转运蛋白 1 ( recombinant excitatory amino acid transporter 1,EAAT1)增加细胞内谷氨酸(glutamate,Glu)水平并激活GSH 系统实现的[22]。总之,从现有研究来看,铁死亡与细胞衰老之间的关系仍存在分歧,主要集中在二者发生的先后顺序上,需要更多清晰直观的证据来进一步解析它们之间关系。
2.2 铁死亡与衰老相关疾病息息相关
生老病死是自然规律,进入晚年时,许多衰老相关的疾病随之而来, 如阿尔茨海默病(Alzheimer’s disease,AD)、帕金森症(Parkinson’s disease,PD)、 中 风、 心 血 管 疾 病(cardiovascular diseases,CVDs)、糖尿病、慢性炎症、年龄相关性黄斑变性(age-related macular degeneration, AMD)等[23-25],这些疾病通常都显现出年龄依赖性。近些年来,铁死亡作为一种全新的细胞死亡方式而备受关注,许多研究表明铁死亡与多种衰老相关疾病的发病有关。
2.2.1 铁死亡是阿尔茨海默病发病机制中的重要参与者
衰老是阿尔茨海默病唯一且最具影响力的因素[26],据报道,65 岁以后,阿尔茨海默病的发病率几乎每五年翻一番[27]。阿尔茨海默病的病理特征是淀粉样β(amyloid β,Aβ) 和神经纤维缠结(neurofibrillary tangles,NFTs)组成的老年斑累积,而这些神经纤维缠结来源于过度磷酸化的tau 蛋白聚集[28]。在大脑中,铁参与许多基本的生理过程,包括神经递质的合成代谢、氧气运输、DNA 合成等,而铁稳态的丧失往往会引起不同机制的神经毒性[29]。有研究表明铁在tau 蛋白的形成过程中起到了非常重要的作用,铁的过度沉积会导致tau 蛋白的过度磷酸化[30];也有研究表明铁螯合剂可以减少淀粉样蛋白前体蛋白和β-淀粉样肽[31-32],并且β-淀粉样蛋白(25-35)诱导的AD 大鼠中铁死亡关键因子谷胱肽过氧化物酶4(GPX4)和SLC7A11 的表达降低,TfR 水平升高,给予Fer-1 治疗后病理状态得到改善[33]。Bao 等[34]研究表明,在患有AD 的人体组织和动物模型中Ferroportin1(Fpn,唯一被确认的铁转出蛋白)的水平被下调,Fpn 缺失的小鼠会出现AD 样脑萎缩和记忆障碍,恢复Fpn 后可改善小鼠的铁死亡和记忆损伤;应用特异性的铁死亡抑制剂后,因Aβ 聚集引起的神经元死亡和记忆损伤被有效改善[34]。由此可见,铁稳态和铁代谢的变化会直接影响阿尔茨海默病的进展,铁离子引发铁死亡是阿尔茨海默病的发病原因之一。
2.2.2 诱导铁死亡是肿瘤的潜在治疗方法
衰老过程中发生的肿瘤、基质及其通讯的局部代谢改变和全身代谢变化共同建立了独特肿瘤微环境(tumour microenvironment,TME)[35]。衰老细胞会分泌大量的炎症、细胞外修饰和生长因子,统称为衰老相关分泌表型( senescence-associated aecretory phenotype,SASP),通过激活SASP 会导致肿瘤细胞的持久停滞和肿瘤免疫微环境重塑,治疗诱导衰老后产生的SASP 可以促进抗肿瘤免疫,从而提高治疗效果[36]。此外,在癌症幸存者的体内中发现机体的衰老进程被加快[37]。这说明,衰老的细胞与肿瘤之间的关系十分紧密,通过调节衰老相关的途径能够影响肿瘤的发生发展[35-39]。由于肿瘤细胞独特的代谢方式、高负荷的活性氧水平和特定突变使得许多肿瘤细胞对铁死亡十分敏感。另外,许多致癌基因或致癌相关通路已被证明能够控制肿瘤细胞中的铁死亡[40]。因此,铁死亡被认为是多种肿瘤治疗的靶点,铁死亡诱导剂将会在抗肿瘤过程中显示出无与伦比的作用。有研究显示线粒体[41-42]、ROS[43]、Sirtuins 家族[39]等一些抗衰老明星靶点也可以诱发肿瘤,其中的一些靶点恰恰也是调节铁死亡的重要靶点。因此,应有如下两种可行的抗肿瘤方案:方案一:铁死亡的诱导剂通过衰老途径或信号通路来发挥抗肿瘤作用;方案二:抗衰老药物可以通过铁死亡途径来诱导肿瘤死亡。总之,衰老、肿瘤、铁死亡三者之间存在密切联系,抗衰老与抗肿瘤的靶点和药物有共通之处,铁死亡可以将它们连接起来,但是,相互之间具体是如何影响和/或协同的,仍需要进一步解析。
2.2.3 铁死亡能够影响糖尿病及并发症的进展
糖尿病是一种慢性代谢和退行性疾病,其特征是胰岛素分泌缺陷或胰岛素功能障碍引起的高血糖[44]。糖尿病常被认为是一种衰老性疾病。据报道,衰老可以促进糖尿病及并发症的发生,而且某些衰老途径也被用作治疗糖尿病[45-46]。虽然已经开发出了许多糖尿病治疗药物,但糖尿病发病机制仍不是十分清楚。有研究表明,铁过载会导致糖尿病的恶化,人体铁水平升高是2 型糖尿病(type 2 diabetes,T2DM)发生的重要原因[47-48]。
胰岛β 细胞功能衰竭和胰岛素抵抗是糖尿病的主要病理表现,由于胰岛β 细胞缺乏强有力的抗氧化机制,铁死亡在其中更容易发生[49-50]。Stancic等[51]发现,在糖尿病条件下,胰岛β 细胞会发生铁死亡,并且Fer-1 可以保护胰岛免受链脲佐菌素(STZ)的损伤。Li 等[52]的研究结果也表明槲皮素可以缓解2 型糖尿病中胰岛β 细胞的铁死亡。Hao等[53]研究发现,SLC40A1 介导1 型糖尿病的铁死亡和认知功能障碍。此外,铁死亡也是调节糖尿病并发症的重要靶点。糖尿病肾病(diabetic kidney disease,DKD)[54]、 糖尿病视网膜病变(diabetic retinopathy,DR)[55]、糖尿病骨质疏松症(diabetic osteoporosis,DOP)[56]和糖尿病心肌病(diabetic cardiomyopathy,DCM)[57]等都受到铁死亡的影响。总而言之,许多证据都证实铁死亡能够促进糖尿病及其并发症的进展,但它们之间的分子机制尚未得到深入的研究,因此,深入阐明这种相互作用对糖尿病的治疗和降糖药物的开发意义十分重大。
2.2.4 铁死亡与心血管疾病
心血管疾病在广义上定义为中风、冠状动脉疾病、心力衰竭(心衰)、心脏骤停和心肌梗死等[58],人们早就认识到年龄是心血管疾病最重要的致病因素[59]。铁死亡的提出使得人们对心血管疾病的机制和治疗方法有了更加深入的认识。2019 年,王福俤/闵军霞团队在国际上首次报道了铁死亡是心脏疾病的一种重要发病机制[60],作者发现并证明了铁死亡是治疗阿霉素(DOX) 和缺血/再灌注(myocardial ischemia reperfusion injury,I/R)诱导的心肌病小鼠模型的有效策略[61]。由此,打开了铁死亡与心脏疾病的研究大门,并在许多的心血管疾病中都发现了铁死亡的身影。例如:Jiang 等[62]揭示了信号接头蛋白HIP-55 作为分子开关调控心肌梗死中的铁死亡,通过抑制MAPK/JNK 死亡通路的激活,抑制GPX4 依赖的铁死亡,发挥心梗保护作用。此外,Fang 等[63]首次构建了心脏特异性敲除铁蛋白小鼠的心力衰竭和心脏损伤表型,在给予Fer-1后该表型被逆转,进一步研究显示该逆转作用是铁死亡关键调控蛋白SLC7A11 被上调的结果。目前防治铁死亡介导的心脏疾病的策略主要有5 种,王福俤/闵军霞团队将其比作“五色石”,将铁死亡防控心脏疾病的机制形象化地概括为“女娲补天”,包括铁死亡抑制剂(Fer-1)、铁离子络合剂(DXZ)、线粒体还原剂(MitoTEMPO)、卟啉抑制剂(ZnPP)以及低铁膳食(low iron diet)[60]。毫无疑问,现有的证据充分证明了铁死亡是心血管疾病或心脏系统疾病的重要致病原因,但具体的治疗靶点较少,这可能与研究时间较短有关。在未来的研究中,有针对性的进行调控因子的挖掘和调控机制的阐述应是研究的重点,以期为靶向铁死亡防治心脏疾病临床药物的开发和临床诊断标准的建立提供更加充分的科学依据。
3 中医药调控铁死亡介导的衰老及衰老相关疾病的研究现状
衰老已被证明是年龄有关疾病的主要危险因素[64]。中医药应用历史悠久,大量的临床前及临床证据表明中医药在治疗衰老及衰老相关疾病方面效果显著[65],主要的治疗方法有单药提取物治疗、传统中药复方治疗、针灸按摩等。据现有文献报道显示,铁死亡是一种衰老及衰老相关疾病的潜在致病因素,并且已经发现了许多靶向铁死亡的药物,其中中医药显现出良好的治疗前景。
3.1 单药提取物调控铁死亡介导的衰老相关疾病
3.1.1 阿尔茨海默病
在前文中已提供了许多铁死亡与阿尔茨海默病有关的证据,截至目前,已有3 种天然化合物活性成分清晰地表明它们的抗AD 作用是通过抑制铁死亡实现的。第一种为圣草酚(Eriodictyol,ERD),一种广泛存在于各种水果、蔬菜和部分中草药中的天然黄酮类化合物[66]。李琳等研究发现,圣草酚能够有效改善小鼠的认知障碍和AD 样病理变化,通过VDR 介导的Nrf2/HO-1 信号通路抑制铁死亡发挥抗AD 作用[66];第二种是红景天苷(Salidroside)。Yang 等[7]发现,红景天苷可以抑制Aβ1-42诱导的AD 小鼠和谷氨酸(Glutamic acid,Glu)损伤的HT-22细胞的神经元铁死亡,从而发挥神经保护作用,其机制与激活Nrf2/HO1 信号通路有关;第三种是二苯乙烯苷(tetrahydroxy stilbene glycoside,TSG)。Gao等[67]的研究表明,TSG 促进了GSH/GPX4/ROS 和Keap1/Nrf2/ARE 等铁死亡信号通路的激活,减少了铁死亡标志物,通过多种信号通路恢复线粒体功能,逆转Aβ 引起的损伤。除此之外,还有一些天然植物中的活性成分也可能是潜在的抗AD 药物,它们均是铁死亡抑制剂,如Hinokitiol[68]、TanshinoneⅡA[69]等,详见表1。从表中数据不难看出,天然植物中存在许多潜在的抗AD 药物,它们的治疗机制多数都指向了Nrf2 及其下游蛋白,这说明在研究铁死亡调节阿尔茨海默病的分子机制时,Nrf2 是一个值得重点关注的方向。

表1 抑制铁死亡来调控阿尔茨海默病的单药提取物Table 1 Extractions from single Chinese herbal medicine in regulating Alzheimer’s disease via inhibiting ferroptosis
3.1.2 肿瘤
由于肿瘤细胞不同于正常细胞的代谢和生存模式,使得肿瘤细胞对铁死亡更加敏感。因此,人们对铁死亡在肿瘤生物学和癌症治疗的研究尤为深入[74]。在既往的研究中,传统中药具有显著的肿瘤抑制效果,自铁死亡被提出之后,人们发现传统中药可以诱发铁死亡抑制肿瘤细胞增殖。其中,青蒿素衍生物的表现十分亮眼。双氢青蒿素(dihydroartemisinin,DHA) 通过抑制GPX4、上调CHAC1、促进PEBP1/15-LO、抑制PRIM2 /SLC7A11轴等铁死亡拮抗机制来治疗胶质母细胞瘤、肝癌等[75-76];青蒿琥酯(artesunate, ART) 能够激活ATF4-CHOP-CHAC1 信号通路、损伤STAT3 信号通路等机制诱导伯基特淋巴瘤[77]、弥漫性大B 细胞淋巴瘤[78]、胰腺癌[79]、卵巢癌[80]等肿瘤中的铁死亡。此外,还有许多抗肿瘤的天然植物活性成分也具有铁死亡诱导剂的特性(详见表2),其中有两种化合物较为特殊,分别是丹参酮ⅡA(TanshinoneⅡA)和黄芩苷(Baicalin)。在阿尔茨海默病中它们是铁死亡抑制剂[5,69],而在肿瘤中又变成了铁死亡诱导剂[81-82],并且在两种疾病中的作用机制也各不相同,遗憾的是,对此尚未有较为合理的解释,可能与中药本身“多靶点,多通路”治疗疾病的特性有关。

表2 诱导铁死亡来治疗肿瘤的单药提取物Table 2 Extractions from single Chinese herbal medicine in the treatment of tumors via inducing ferroptosis
3.1.3 糖尿病及其并发症
中药治疗糖尿病的研究由来已久,中国古代将其称为消渴症,消渴丸、复方降糖方等许多中药在降血糖方面的效果十分显著。随着自铁死亡机制的逐渐被揭示,许多学者开始探索其在糖尿病中的应用。研究发现,许多中药活性成分通过铁死亡诱发或促进糖尿病的病程,这也为糖尿病治疗药物的筛选提供了更多的选择。Li 等[52]发现,槲皮素(Quercetin)通过抑制胰腺铁沉积和胰腺β 细胞(pancreatic β cells,PBC)铁死亡发挥对T2DM 的有益作用; 另有一项研究表明, 隐绿原酸(cryptochlorogenic acid,CCA)通过激活胱氨酸/谷氨酸转运体系统(System Xc-)/GPX4/Nrf2 和抑制核受体辅激活剂4(nuclear receptor coactivator 4,NCOA4)来抑制糖尿病大鼠的胰腺β 细胞铁死亡[90];此外,白芦藜醇(Resveratrol)可以通过内质网应激途径改善丙烯醛(Acrolein)诱导的小鼠胰腺β细胞MIN6 细胞铁死亡[91]。近期研究显示,中药可以通过铁死亡调节糖尿病心肌病和糖尿病肾病(表3)[53,57]。(1)糖尿病心肌病:Wang 等[92]发现,萝卜硫素(Sulforaphane)通过AMPK 介导的Nrf2 激活来预防糖尿病心肌病中的铁死亡发生;此外,姜黄素和五味子乙素(Schizandrin B)也可以通过Nrf2 途径减轻糖尿病心肌病中铁死亡诱导的心肌损伤[93-94]。(2)糖尿病肾病:研究表明,在糖尿病肾病小鼠模型中,五味子甲素(Schizandrin A) 通过AdipoR1/AMPK-ROS/线粒体损伤减轻铁死亡[95]。上述证据充分证明,在糖尿病及其并发症发生时,胰腺β 细胞会发生铁死亡,给予铁死亡抑制剂治疗后,症状会得到减轻和缓解,各种天然化合物可以作为铁死亡抑制剂在它们的治疗过程中发挥作用。

表3 抑制铁死亡调节糖尿病及其并发症的单药提取物Table 3 Extractions from single Chinese herbal medicine in regulating diabetes and its complications via inbibiting ferroptosis
3.1.4 心血管疾病
随着铁死亡与心血管疾病之间的关系逐渐被揭示,已有研究表明,单味中药提取物可以抑制铁死亡并用于心血管疾病的治疗(见表4)。在心肌缺血/再灌注损伤(I/R)中,阿魏酸(ferulic acid,FA)通过上调AMPKα2 抑制铁死亡来缓解I/R[98];Xanthohumol 通过下调铁死亡标志物PTGS2 和ACSL4 对I/R 引起的心肌损伤起保护作用[99];除此之 外, GossypolAceticAcid[100]、 Cyanidin-3-Glucoside[101]、Icariin[102]、Naringenin[103]、Britanin[104]等化合物也可以通过抑制不同的铁死亡通路来改善I/R 引起的心肌损伤。Liu 等[105]研究发现,在心力衰竭(heart failure,HF)的体内体外模型中都出现了铁死亡特征,葛根素(Puerarin)可以显著阻断这一特征。有报道称,白藜芦醇通过诱导HF 中KAT5/GPX4 信号通路抑制铁死亡来减轻心肌损伤[106];另有研究表明,Nrf2 也是HF 的重要调节靶点,Salvianolic acid B[107]和Fraxetin[108]均可通过调节Nrf2 来保护HF 引起的心肌受损。此外,中药还可以通过抑制铁死亡来治疗心肌病。在阿霉素(Doxorubicin,DOX)诱导的体内或体外的心肌病模型中,Li 等[109]发现Fisetin 通过激活SIRT1/Nrf2 信号通路抑制铁死亡,发挥对心肌病的治疗作用。综上所述,中药通过抑制铁死亡可以在多种心脏系统疾病中发挥治疗作用,然而,从整体水平上来看,现有的治疗药物仍然较少,部分药物的研究只停留在活性评价或简单标志物检测阶段,未能就其详细机理作更加深入和全面的研究。
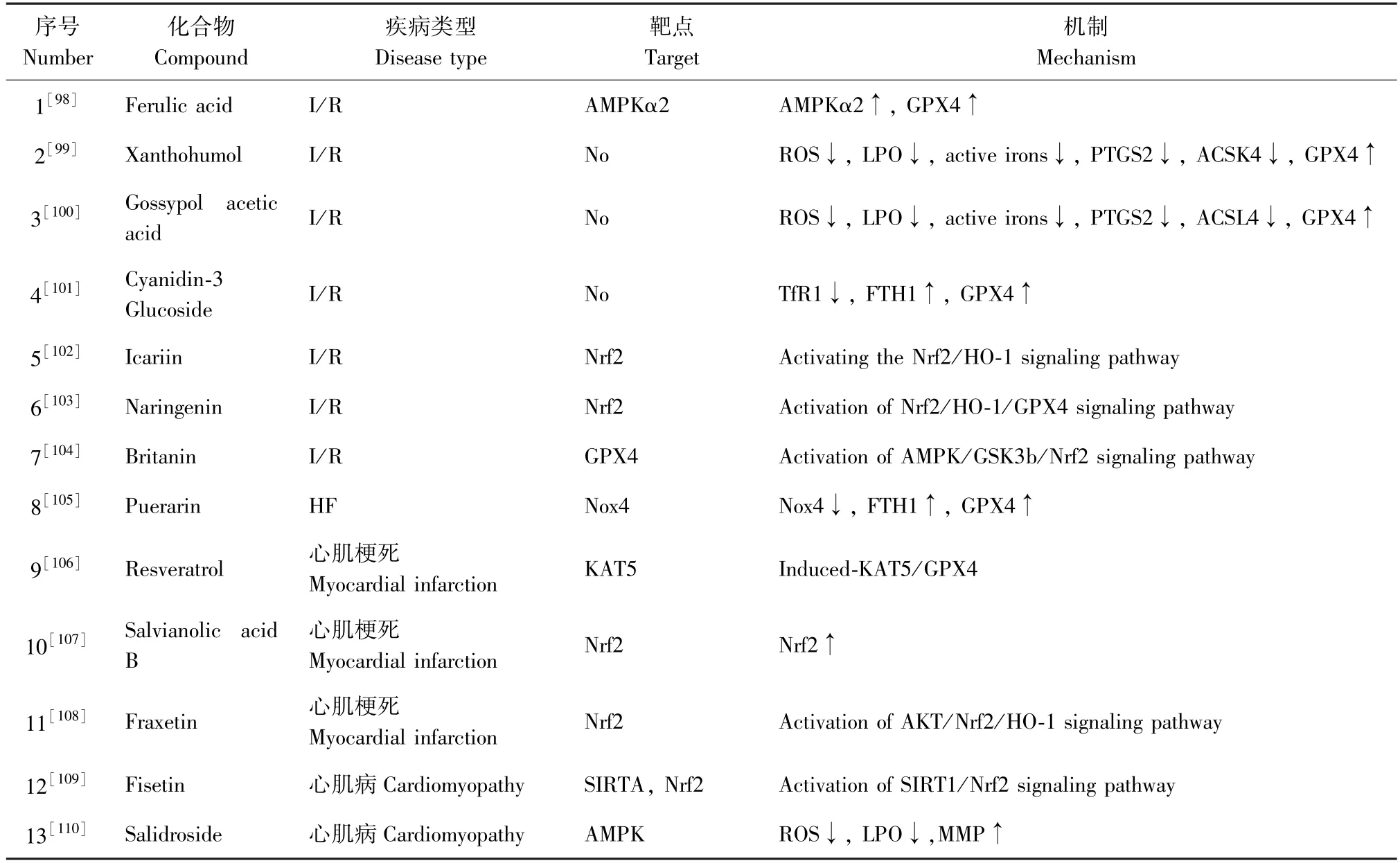
表4 通过抑制铁死亡来调节心血管疾病的单药提取物Table 4 Extractions from single Chinese herbal medicine in regulating cardiovascular diseases via inhibiting ferroptosis
3.2 中药复方调控铁死亡介导的衰老相关疾病
中药复方是传统中医药文化的瑰宝,它以中药“君臣佐使”的配伍理论为基础,多味中药协同发挥作用。经过千百年来的临床验证,其在疾病防治方面显示出卓越的治疗作用。在铁死亡理论被提出之后,药学工作者也对中药复方是否可以利用铁死亡来治疗疾病进行了深入研究,结果表明,许多中药复方在治疗衰老相关疾病中具有很好的疗效。有报道显示, 扶正抗癌汤( Fuzheng Kangai Decoction)对GPX4/System Xc-有很好的抑制作用,从而诱导铁死亡的发生,达到治疗非小细胞肺癌的目的[111];参麦注射液(Shenmai Injection)可以通过激活Nrf2/GPX4 信号通路抑制铁死亡来缓解心肌缺血/再灌注损伤[112];清心解郁颗粒(Qing-Xin-Jie-Yu Granule)对动脉粥样硬化有很好的治疗效果,其机制是通过GPX4/System Xc-信号通路部分抑制动脉粥样硬化易损斑块中的铁死亡[113]。以上证据表明,中药复方基于铁死亡调控机制改善疾病状况是可行的,其可以通过Nrf2、GPX4、System Xc-等靶点发挥作用。
4 总结及展望
铁死亡是一种新提出的细胞死亡方式,迄今为止,在多种疾病中发现了铁死亡标志物,并且铁死亡相关蛋白的水平也发生了变化,充分证实了铁死亡在疾病进程中具有重要地位。衰老及衰老相关疾病是铁死亡介导的疾病中的一种,严重影响人类的生命健康。关于铁死亡如何引发衰老及衰老相关疾病的发病机制已提出了许多,如铁稳态、铁代谢、氧化应激、线粒体障碍等,SLC7A11/System Xc-、p53、GPX4、线粒体、Nrf2、Sirtuin 家族等作用靶点也陆续被发现。然而,截至目前,相关的研究仍然停留在细胞模型和动物模型水平上,尚无临床研究或临床治疗药物的转化,这主要局限于现有的研究进展不能完全揭示相关疾病的致病原因和治疗机制。因此,尚需要进一步阐释铁死亡发病机制,寻找药物作用途径。
铁死亡调控机制复杂多样,涉及到多种致病途径和发病学说。中医药包含着中华民族几千年的健康养生理念及实践经验,具有多靶点多途径的治疗优势。随着铁死亡的提出,中医药研究工作者发现铁死亡在中药活性成分或中药复方治疗衰老及衰老相关疾病中扮演极重要的角色,根据这一发现进一步丰富了中医药的治疗理论和治疗选择。虽然已经证明了中医药调控铁死亡的潜力,但仍然存在着不少的问题。例如,研究内容少、深度和广度不够;药理作用机制模糊,机理研究依赖于铁死亡经典靶点的验证;对中药复方调节铁死亡的研究较少,未能充分利用其复方组合优势。
综上所述,铁死亡是一种重要的致病因素,也是治疗衰老及衰老相关疾病的重要方向之一。中医药应用前景广阔,是开发治疗铁死亡介导的治疗衰老及衰老相关疾病药物重要储存库。但现有的研究工作仍处于早期阶段,亟待在机制研究、药理验证、临床转化等方面打开新的局面,相信在不久的将来中医药一定能在铁死亡相关治疗中显露出属于自己的独特魅力,为提升全民健康水平做出贡献。
