关于炎症性肠病发病机制的研究进展
2023-12-12侯晓婷薛佳辰张华敏王旭德王科斯
侯晓婷,孟 欢,薛佳辰,张华敏,王旭德*,王科斯*
(1.大连大学医学院慢性病研究中心,辽宁 大连 116622;2.大连大学附属中山医院,辽宁 大连 116622;3.延边大学药学院,吉林 延吉 133002)
炎症性肠病(inflammatory bowel disease, IBD)是一种长期反复发作的影响胃肠道各部位的炎症性疾病,包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD)两种类型。进入21 世纪后,IBD 已经成为一种全球性疾病,患病人数高达500 万,在社会日益西方化的新兴工业化国家发病率加快,负担不断提高[1-4]。
UC 和CD 在临床表现、结肠镜检查和组织病理学特征上相似但有所区别。UC 是最主要的IBD 类型,它从直肠持续向大肠近端延伸,病变常局限于黏膜上皮。CD 在胃肠道的任何部位均可发生,但多发于末端回肠和右半结肠。除这些报道的主要表现外,IBD 患者常因肠外并发症而痛苦,这些并发症可能涉及皮肤病(结节性红斑和坏疽性脓皮病)、眼部疾病(结膜炎和葡萄膜炎)、风湿病(强直性脊柱炎和周围性关节炎)、肝胆疾病(原发性硬化性胆管炎)、泌尿系统疾病(肾结石),以及肛周并发症(脓肿、瘘管和狭窄)[5-7]。
目前IBD 病因尚不清楚,但一系列的研究表明,个体的遗传因素和外部环境、肠黏膜屏障功能、氧化应激、自噬功能异常和适应性免疫反应各方面都参与了IBD 的发病过程[8-11]。本文总结归纳了上述五个领域的最新研究进展,以明确了解IBD 的发病机制,为IBD 的治疗提供更多思路。
1 遗传和环境因素
迄今为止,在IBD 的遗传框架研究方面已鉴定出163 个易感位点,大多数位点都有患IBD 的风险。Cleynen 等[12]应用蒙特利尔分类系统对34 819 例患者进行免疫芯片分型测试基因型表型关联,结果显示代表IBD 所有已知危险等位基因的遗传风险评分与疾病亚表型有很强的相关性。越来越多的研究报告IBD 相关的表观遗传学改变,以及基因表达和细胞功能的相关改变。其中DNA 甲基化在IBD患者的黏膜活检和外周血单个核细胞中的变化已被证实,与健康人相比,UC 患者的基因组甲基化程度相对较高[13-15]。
在工业化国家观察发现环境空气污染与IBD的发病率存在正相关关系。居民长期生活在高浓度二氧化氮和二氧化硫的环境中可增加患早发型IBD 的风险[16]。另外西方流行病学研究表示,吸烟能够导致患CD 的风险增加[2]。
此外,发展中国家人群中IBD 发病率的上升原因之一在于饮食习惯的“西方化”,即以碳水化合物和红肉摄入量高、膳食纤维摄入量低为特征[17]。首先,西方饮食对肠道微生物群组成的影响与较低的微生物多样性、较高的类杆菌和肠杆菌科丰度以及较低的厚壁菌门水平有关,而传统的东方饮食则与短链脂肪酸(short-chain fatty acids, SCFAs)和较低的肠杆菌科丰度(志贺氏菌和大肠杆菌)有关。其次,高脂肪、高糖的西方饮食降低了黏液层厚度,增加了肠道通透性,使易感小鼠肿瘤坏死因子(tumor necrosis factor, TNF)-α 分泌增加[18-19]。西方饮食中omega-6 (n-6)/omega-3 (n-3)多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)之间的不平衡,可能会增加IBD 的风险[17]。在小鼠模型中,高脂肪饮食特别是饱和动物脂肪会增加炎症,补充omega-3长链脂肪酸则可以预防肠道炎症[16,20-22]。
2 肠黏膜屏障
肠黏膜屏障在保护生物体免受来自外部环境的病原体和有害物质中发挥重要功能,由黏液和上皮层以及下面的固有层组成,包括机械屏障、化学屏障、免疫屏障和生物屏障。免疫细胞、肠道微生物群和抗微生物肽在维持肠道屏障功能中具有至关重要的作用。
2.1 机械屏障
机械屏障包括肠上皮细胞、上皮细胞紧密连接等。紧密连接(tight junction, TJ)在肠道屏障功能中起着重要的作用。肠上皮细胞中的TJ 蛋白由不同的连接分子组成,调节邻近细胞中水、离子和大分子的细胞旁渗透性,而TJ 屏障的完整性缺失和结构受损导致免疫细胞的强制激活和不同组织中的慢性炎症,最近的研究表明肠道TJ 屏障可以作为一个潜在的目标预防和减少不同的炎症性疾病[23-24]。在自发性结肠炎的白介素(interleukin, IL)-10 基因敲除模型中,屏障通透性的增加先于疾病的发生,过度表达TJ 蛋白的小鼠模型导致屏障通透性增加[25]。其他整合性膜蛋白对泄漏途径的调控和维持至关重要。例如, 闭锁小带蛋白( zonula occludens, ZO)-1 具有一个肌动蛋白结合域,部分通过肌动蛋白环调控泄漏途径[26-27]。Ibrahim 等[28]发现磷脂酰肌醇-3-激酶(phosphatidylin-ositol-3-kinase, PI3K)家族成员之一,PIK3R3 的表达水平随着结肠炎的发生而增加。体外研究显示,上调的PIK3R3 降低ZO-1 的表达,而下调PIK3R3 能够增加ZO-1 的表达。Sturgeon 等[29]报道了ZO-1 依赖性小肠屏障损伤是导致耐受破坏的早期步骤,随后发展为慢性炎症性疾病。
2.2 化学屏障
化学屏障由肠黏膜上皮分泌的黏液、消化液及肠腔内正常寄生菌产生的抑菌物质构成。黏液是由杯状细胞产生和分泌的一种复杂的黏附液体,能够保护上皮免受损伤并维持细胞水合作用。结肠隐窝是结肠中肠腺的结构,杯状细胞位于结肠隐窝中。IBD 导致进行性肠隐窝破坏,使杯状细胞减少并破坏肠黏液层。在肠道中,黏液的主要成分黏蛋白(mucin, MUC)以MUC2、MUC3 为主[30-34]。在活动期UC 期间结肠黏膜微生物的增加降低了负责产生MUC2 的杯状细胞的分泌活性。除此之外,在UC中几种不同的空间上不同的杯状细胞表型发生了改变。MUC 翻译后修饰异常,而MUC2 糖基化降低且结构改变并降解,这对黏蛋白表达水平有影响,并导致UC 患者结肠黏膜变薄。较薄的结肠黏膜导致腔内微生物成分与结肠上皮细胞的浸润和接触增加,从而驱动炎症反应[35-38]。
2.3 生物屏障
肠黏膜生物屏障的实质是由肠道常驻菌群组成的一个相互依赖又相互作用的微生态系统。与健康人比较,IBD 患者肠道内具有抗炎能力的细菌减少,而炎症性细菌增多[39]。此外,对患者和实验动物的研究表明肠道细菌会促进与IBD 相关的慢性炎症,其中双歧杆菌与乳酸菌在维持肠道生物屏障功能中发挥着重要作用[40-42]。乳酸菌和双歧杆菌属能够有效缓解IBD 的发生并降低疾病活动指数[43]。含有双歧杆菌的益生菌能够促进活动期UC患者的病情缓解,而不含双歧杆菌的益生菌则没有有益效果。与健康人群相比,IBD 患者肠道内的微生物多样性较低且厚壁菌门丰度减少,双歧杆菌水平降低[30,44-46]。共生细菌产生的SCFAs 可抑制组蛋白去乙酰化酶(histone deacetylase, HDAC)活性,在IBD 动物模型中均具有抗炎和维持上皮屏障功能的作用[47-49]。此外,微小核糖核酸(micro RNA,miRNA)也参与调节UC 的发病机制,包括调节免疫细胞、肠上皮屏障和肠道菌群与宿主之间的动态平衡。miR-18a*和miR-4802 可恢复具核梭杆菌对结直肠癌(colorectal cancer, CRC)化疗诱导的凋亡基因表达、肿瘤凋亡和自噬体形成的抑制作用。Yu等[50]发现miR-18a*和miR-4802 通过阻断具核梭杆菌诱导的自噬激活来调节具核梭杆菌介导的化疗耐药。具核梭杆菌通过激活Toll 样受体(toll-like receptor, TLR ) 4/髓样分化因子 ( myeloid differentiation factor 88, MyD88)通路抑制miR-18a*和miR-4802 的表达,降低miR-18a*和miR-4802 对其靶基因自噬相关蛋白7 重组蛋白(recombinant autophagy related protein 7, ATG7)和UNC-51 样激酶1(UNC-51 like kinase 1, ULK1)ULK1 的抑制作用,导致自噬通路的激活和CRC 化疗反应的改变。
2.4 免疫屏障
免疫屏障由肠黏膜淋巴组织(gut-associated lymphoid tissue, GALT)和肠道内分泌型免疫球蛋白A(secretory immunoglobulin A, SIgA)构成。GALT是IBD 发生的关键部位,患者的炎症结肠富含与组织的淋巴样结构相关的细胞和分子[51-55]。Perna等[56]研究发现谷氨酰胺能够增加SIgA 的产生,SIgA 可以促进细菌在肠腔中的聚集,防止细菌在上皮表面的黏附从而避免细菌移位。当SIgA 进入肠道后能选择性地包被革兰氏阴性菌,形成抗原抗体复合物,阻碍细菌与上皮细胞受体相结合,同时刺激肠道黏液分泌并加速黏液层的流动,可有效阻止细菌对肠黏膜的黏附[56-57]。
单核吞噬细胞(巨噬细胞和树突状细胞)存在于肠道相关淋巴组织和肠道固有层,具有多种功能,包括吞噬抗原样本和清除致病物质,以及产生细胞因子和维持上皮屏障功能。多项研究表明,肠道巨噬细胞释放细胞因子和其他可溶性因子有助于维持组织稳态,向受损的结肠上皮传递再生信号,促进肠道再生反应[58-60]。IBD 患者炎症部位有大量的树突状细胞,这些细胞激活CD4+和CD8+T淋巴细胞、自然杀伤(natural killer, NK)细胞等效应细胞,并抑制调节细胞的活化。树突状细胞在识别共生菌群后不会引发炎症反应,而是通过主动诱导耐受性细胞因子和诱导调节性T 细胞(regulatory T cells, Tregs)分泌。因此,根据对抗原和细菌的识别,树突状细胞可以启动促炎反应或者抗炎反应[21,53,61]。巨噬细胞通过识别病原体、吞噬微生物和调节肠道炎症来控制肠道内环境平衡。机体发生IBD 时,巨噬细胞可以促进肠黏膜屏障愈合,并协调免疫反应的发展。根据激活状态的不同,巨噬细胞分为代表促炎状态的经典激活巨噬细胞(M1巨噬细胞)和代表抗炎状态的交替激活巨噬细胞(M2 巨噬细胞)。M1 巨噬细胞的存在将局部巨噬细胞室的平衡转变为促炎状态。M1 巨噬细胞和上皮细胞共同培养后,上皮屏障的完整性将受到负面影响,破坏TJ 蛋白并诱导上皮细胞凋亡,从而推动IBD 的发展[62-65]。当组织发生炎症时,体内的各种细胞,如巨噬细胞和间充质干细胞(mesenchymal stem cells, MSC)在炎性细胞因子的刺激下可以分泌肿瘤坏死因子诱导蛋白(tumor necrosis factor stimulated gene, TSG)-6,而TSG-6 能够通过调节炎症细胞因子和诱导M2 巨噬细胞标记物的表达来减轻肠道炎症[66-71]。
3 氧化应激
哺乳动物细胞生存所必需的氧代谢产生活性氧(reactive oxygen species, ROS),在生理条件下对肠道稳态至关重要。然而,肠道炎症通常伴随ROS的过量产生。高水平的ROS 在细胞内产生氧化应激,体内氧化还原失衡,肠黏膜层损伤和上皮细胞凋亡,导致肠道中的细菌入侵,并刺激免疫反应和组织损伤[72-73]。
上皮细胞在宿主和各种生物之间的胃肠道内形成细胞屏障,这对于维持黏膜稳态是必不可少的。一旦肠道中产生过量的ROS,氧化应激可以通过改变蛋白质的功能、引起脂质过氧化来加速细胞损伤。ROS 含量超过一定阈值可以破坏细胞骨架蛋白,导致TJ 和上皮细胞通透性的改变,最终导致屏障破坏。通过这种方式,氧化应激使胃肠道发生炎症反应,并引发IBD[74-76]。在小鼠结肠炎模型中,巨噬细胞或嗜中性粒细胞的缺失减少了ROS 和促炎细胞因子的产生,并减轻了肠道炎症损伤。活跃的中性粒细胞和巨噬细胞以及胃肠道中的肠黏膜上皮细胞(intestinal epithelial cell, IEC)产生更多的ROS,这可以通过血液中氧化损伤的生物标志物8- 羟基脱氧鸟苷(8-hydroxy-deoxyguanosine, 8-OHdG)的水平来推断。黏膜中炎症细胞的浸润进一步损害胃肠道组织,形成恶性循环[77-80]。
氧化应激可导致氧自由基代谢异常和细胞凋亡过度激活。此外,氧自由基会导致炎症介质(如细胞因子和趋化因子)的释放增加,这不仅会损伤上皮细胞,还会加剧氧化应激,导致肠道机械屏障的破坏。高水平的ROS 还会对脂质造成直接损害引起脂质过氧化,导致膜性能的损失。丙二醛(malondialdehyde, MDA)是脂质过氧化的标志[81]。Sengul Samanci 等[82]对IBD 患者眼部血管研究改变发现,与健康对照组相比,CD 组的MDA 水平最高,其次是 UC 组。抗氧化酶超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPX) 和过氧化氢酶(catalase, CAT) 可以改善肠炎中的过氧化反应[27,73]。临床数据已经证明IBD 患者三种SOD 亚型的不同黏膜表达:SOD2 表达显著上调,而SOD1受影响较小,SOD3 表达降低。SOD 活性在UC 和CD 患者中也高于健康人群,当患者处于缓解期时,SOD 水平可以恢复正常。谷胱甘肽(glutathione,GSH)是一种可溶性抗氧化剂,高表达于细胞质、细胞核和线粒体中,能够在肠黏膜中形成抗氧化屏障。GPX 可以维持GSH 水平,保护细胞免受过氧化损伤。对DSS 诱导的结肠炎小鼠给予药物治疗后可有效恢复小鼠结肠GSH、GPX 的表达,抑制促炎细胞因子的分泌并增强对结肠炎的抗氧化防御。此外,由IEC 分泌的GPX3 有助于提高肠黏膜中的细胞抗氧化活性。CD 患者的CAT 活性降低,在动物实验中增强CAT 活性能够降低结肠炎和结肠癌的发生率[83-84](图1)。
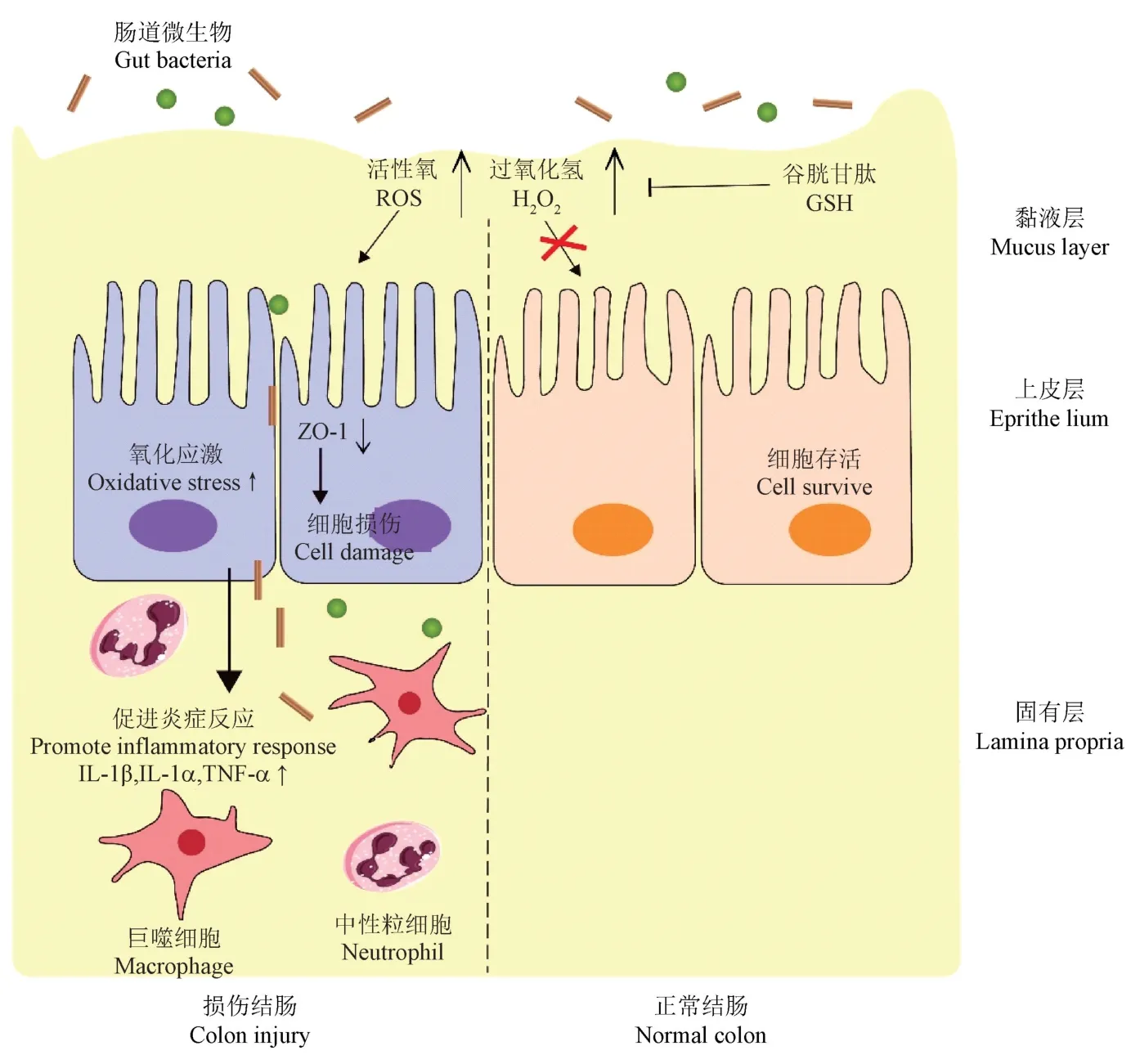
图1 过量ROS 加剧肠道炎症Figure 1 Excessive ROS aggravates intestinal inflammation
4 自噬
自噬是真核生物进化中的一个过程,细胞质物质可以在溶酶体内发生降解。自噬包括微自噬、分子伴侣介导的自噬和巨自噬三种类型。巨自噬简称为自噬,在维持肠道内环境稳定、调节肠道微生物群与先天免疫和适应性免疫之间的相互作用以及宿主防御肠道病原体方面起着关键作用。自噬功能障碍与包括IBD 在内的几种人类疾病有关[85-90]。
在肠道上皮,自噬通过促进溶酶体介导的人封闭蛋白2(claudin-2) 降解调节上皮屏障功能。Claudin-2 是肠上皮中一种重要的水合小阳离子选择性成孔紧密连接蛋白,失活后可减轻小鼠结肠炎症状,这表明claudin-2 是抗肠道炎症的潜在靶点。功能失调性自噬可以导致claudin-2 水平升高,增加肠道通透性和宿主对管腔抗原的接触,从而导致持续的炎症反应发生[91-92]。自噬能够通过促进线粒体稳态,抑制TNF 诱导的IEC 凋亡,维持肠黏膜屏障的完整性[93]。有大量文献阐明了自噬缺陷与IBD 之间的牢固联系。最常见的突变体自噬相关16 样蛋白1 (autophagy related 16-like protein 1,ATG16L1)中的Thr 300-to-Ala(T300A)使该蛋白成为半胱氨酸-天冬氨酸蛋白酶(cystein-asparate protease, Caspase)-3 依赖裂解的靶点,增加了CD的发生风险[94-96]。T300A 突变中低表达或敲除ATG16L1 能够增强小鼠对共感染病毒的敏感性,同时增强小鼠对DSS 诱导的肠损伤的炎症反应。ATG蛋白能够维持细胞器稳态,在小鼠和人体内促进肠道屏障对代谢和恢复免疫介导损伤的功能。潘氏细胞特异性缺失多个ATG 基因,与剪切型X-盒结合蛋白1(spliced X-box binding protein 1, Xbp1)一起缺失时,会导致肠道炎症[95]。内质网应激期间缺陷性自噬使内质网核心信号 1 (endoplasmic reticulum to nucleus signalling 1, ERN-1)聚集物清除障碍,导致内质网应激增加和小鼠自发性CD 样回肠炎[97-99]。
在树突状细胞中,自噬降解细胞内病原体,参与抗原向T 细胞提呈过程,诱导适应性免疫反应发生。缺陷性自噬导致细菌清除和抗原提呈受损,从而损害T 细胞活化。T 细胞代谢通过多种机制对效应细胞发挥强大的抑制作用,包括分泌抗炎细胞因子、溶解效应细胞和促进组织修复以防止肠道炎症的发展[100]。自噬的改变会损害T 细胞的代谢转变和增殖,导致CD4+和CD8+T 细胞数量减少,CD8+T细胞发育受损,Tregs 存活率下降,辅助性T 细胞(T helper cells, Th)2 和Th17 反应增加[101-103]。
研究发现在IBD 中,线粒体自噬对肠道微环境具有抗炎作用。CD 相关的ATG16L1T300A 变异能够导致线粒体自噬缺陷、ROS 积累、增加IL-1β 的生成、促炎巨噬细胞的极化,从而减少细菌杀伤。自噬缺陷的巨噬细胞中细胞凋亡的易感性增加与细胞ROS 过度产生有关。在肠干细胞中,自噬能够限制ROS 积累,抑制干细胞分化,促进上皮细胞再生。缺陷性自噬能够导致ROS 积累和上皮再生受损,自噬相关蛋白的丢失通常与功能失调的线粒体和ROS 的积累增加有关,并导致细胞坏死。当自噬功能失常时,细胞的生物能量状态达到绝对最小值,而膜通透性增加的线粒体不再被清除,迫使细胞发生凋亡[104]。对IBD 小鼠模型中巨噬细胞的评估发现,由于IL-10 或IL-10 受体的基因缺失导致线粒体自噬减少,炎症小体激活和肠道炎症发生,加重ROS 诱导的细胞凋亡。除了IL-1β 分泌增加,潘氏细胞异常还与免疫相关GTPase 家族M 蛋白(immunity-related GTPase family M protein, IRGM)-1缺失的小鼠肠道细胞线粒体自噬缺陷有关。线粒体自噬是选择性清除老化、受损、功能失调或其他不必要线粒体的机制。在IBD 发展过程中,线粒体自噬被激活并清除受损线粒体,从而更有效地减轻炎症过程中氧化应激反应[105-108]。
5 适应性免疫
适应性免疫系统包括T 淋巴细胞和B 淋巴细胞,并诱导对某些抗原的特异性记忆反应。白细胞介素参与防御肠道感染,调节适应性免疫,在淋巴组织的形成和体内平衡以及组织再生中发挥重要作用。
5.1 T 细胞及其细胞因子
5.1.1 辅助性T 细胞
目前,Th17 被认为是IBD 的主要致病因素。IBD 患者肠黏膜中存在大量Th17 细胞浸润,炎症组织中释放IL-17 和Th17 相关细胞因子的细胞数量也较正常组织增加[105,109]。与Th17 细胞相比,Treg细胞不仅能抑制自身免疫性疾病的发生,还能控制肠道炎症。UC 小鼠模型中小鼠外周血Treg 细胞降低,并通过增加IL-10 和转化生长因子(transforming growth factor, TGF)-β 的分泌,显著改善小鼠腹泻症状。Treg 细胞表达叉头状家族转录因子(forkhead box, Fox)p3 并产生抗炎细胞因子IL-10 和TGF-β,从而发挥抗炎作用[61,110]。Th17 细胞促进肠道炎症的发生,Treg 细胞抑制肠道炎症。Th17/Treg 细胞失衡是影响IBD 发生发展的重要因素,这种平衡主要受到T 细胞受体信号、共刺激信号、细胞因子、胆汁酸代谢物、肠道微生物群等因素的影响[21,111]。
5.1.2 细胞因子
研究发现紊乱的细胞因子调节会破坏肠道稳态,而IBD 是细胞因子通路缺乏或激活增强的结果。在IBD 患者结肠黏膜中能够检测出高水平的IL-1β 和IL-18 活性[112-113]。IL-6 和TNF 也在炎症反应中起主导作用。IL-6 是一种多效性细胞因子,能够激活结肠上皮细胞中的信号转导和转录激活因子(signal transduction and activator of transcription,STAT),并与其可溶性受体一起在IBD 发展过程中增加。TNF 能够导致IL-1β、IL-6 和IL-23 的表达增加,加速IBD 病情恶化[55,114]。此外,IBD 患者中TNF 可溶性受体的血清浓度显著增加[53]。与健康人群相比,IBD 患者血清中的IL-17 和IL-23 水平显著升高,血清水平与疾病严重程度和持续时间相关,可以用作反映IBD 活动性的生物标志物[115-118](表1)。

表1 IBD 主要细胞因子作用靶点Table 1 Main cytokine targets of IBD
5.2 B 细胞及调节性B 细胞
B 细胞是骨髓来源的多能干细胞,机体发出的外源信号刺激B 细胞后,可使其产生促炎细胞因子或抗炎细胞因子,参与免疫调节和炎症反应。调节性B 细胞(regulatory B cells, Bregs)是一类可以抑制免疫应答并分泌IL-10 的B 细胞亚群,IL-10 的保护功能已经在许多结肠炎模型中得到证实,Breg 细胞可通过直接接触和间接接触来发挥其免疫效应[124-126]。尽管T 细胞系统在有关IBD 发病机制和治疗方法的研究中占主导地位,但新的数据表明B细胞谱系在IBD 中也发挥了作用。Breg 细胞通过分泌IL-10 促进T 细胞转化为Treg 细胞,并促进Foxp3 的表达。此外,B 细胞通过产生上皮细胞特异性自身抗体加重UC 病情。最近研究表明,DSS诱导结肠炎小鼠结肠Breg 细胞持续减少,提示慢性肠道炎症导致的黏膜B 细胞群体持续改变可能参与IBD 的发病[127-128]。在大肠杆菌刺激B 细胞后,多效调节细胞因子IL-6 的分泌上调,促进Breg 细胞分化和IL-10 的产生[129]。UC 患者外周血和肠组织中Breg 细胞明显降低,同时伴有较低的血清IL-10水平[128,130-131]。Breg 细胞和Treg 细胞在体内的增加,建立了免疫同稳状态。综合上述,这两个关键的调节细胞群体可能会形成强大的抗炎环境,能够抑制各种自身免疫性疾病的炎症[132]。
6 结语与展望
炎症性肠病是慢性复发性肠道炎症,已经成为一个世界性健康问题。尽管IBD 的病因学仍不清楚,但它涉及遗传、环境、微生物群与免疫反应多因素的相互作用。目前常见临床药物有水杨酸类、糖皮质激素类、免疫抑制剂类等,但长期或过剂量使用时,引起的不良反应较多,耗费的时间与经济压力也较大,许多患者不能维持治疗。为了找到新的治疗策略来改善患者的治疗,理解IBD 的发病机制是至关重要的。遗传学相关的基因位点的数量和多样性的增加给研究IBD 如何影响易感个体的免疫和炎症带来了重大突破。肠黏膜屏障在维持肠道稳态以及宿主免疫系统的发育和激活中也起着重要作用。最新研究进展揭示了肠黏膜屏障破坏和肠道菌群失调,与IBD 的发病机制密切相关。随着研究的深入,自噬影响肠上皮细胞稳态和恢复的各种方式,自噬缺陷能够通过破坏肠道稳态、影响肠道菌群组成、损害细胞内细菌清除和增强肠道炎症反应等途径对IBD 的病程产生强烈影响。此外,氧化应激被认为是IBD 发生发展和严重程度的潜在致病和关键因素,活性氧生成增加和抗氧化活性降低进一步促进IBD 的发展。越来越多的研究使我们对IBD 发病机制的理解取得了前所未有的进展,个体的遗传因素和外部环境、肠黏膜屏障功能、氧化应激、自噬功能异常和适应性免疫反应各方面都参与了IBD 的发病过程,然而,不同IBD 患者亚群的发病机制、疾病特征和肠道炎症驱动因素仍存在未知的问题,有待进一步探讨。未来的研究希望能够进一步阐明和整合微生物组和环境对免疫反应的影响,进一步对基因组、环境因素、肠道菌群以及免疫反应进行综合分析,通过高基因组方法、环境变化调查、肠道菌群的分子分析以及对先天和适应性免疫反应之间的相互作用的更全面理解,并且有必要进一步了解肠道菌群如何调节先天和适应性免疫反应的机制和途径。
