雅致小克银汉霉与芽孢杆菌联合降解义马煤产腐植酸
2023-12-11陈林勇刘建民崔宇翔任恒星宋燕莉关嘉栋牛江露李国富王保玉
陈林勇 , 刘建民 , 崔宇翔 , 任恒星 , 赵 晗 , 赵 娜 , 宋燕莉 , 关嘉栋 , 牛江露 ,李国富 , 王保玉 , 何 环
(1.河南理工大学 资源环境学院, 河南 焦作 454000;2.煤与煤层气共采国家重点实验室, 山西 晋城 048000;3.易安蓝焰煤与煤层气共采技术有限责任公司, 山西 晋城 048000;4.中国矿业大学 化工学院, 江苏 徐州 221116;5.中国矿业大学 煤炭加工与高效洁净利用教育部重点实验室, 江苏徐州 221116)
自20 世纪80 年代COHEN 等[1]发现微生物可将褐煤降解为黑色液滴以来,微生物溶煤作为煤的清洁高效利用的技术手段之一引起了国内外学者的广泛关注,基于微生物溶煤的地下煤炭原位生物开采技术被认为是煤炭化学开采关键技术之一[2]。经过近40 a的发展,已经有上百种与煤降解相关的微生物被分离出来,研究涵盖了褐煤[3]、亚烟煤[4]、硬煤[5]、风化煤[6]等各种煤,降解的机理可概括为碱性物质[7]、生物氧化酶[8-9]、螯合剂[10]、表面活性剂[11]、酯酶[12]作用。煤的生物降解液可被酸沉淀,沉淀的主要成分为腐植酸(HA)[4,13]。腐植酸的产率通常有3 种计算方法:第1种是通过实验前后煤的质量差来计算[14-15],当煤因颗粒较小或被菌丝包裹等原因不易收集时该方法引起的误差较大;第2 种方式是通过降解液的酸沉淀产物即腐植酸的质量来衡量[16];第3 种途径是以降解液在450 nm 处的吸光度来表征[17],相对于前2 种方法,测量吸光度仅需少量发酵液,因此更适用于实验过程的监测,用于反映实验所处的阶段。
微生物与煤的作用方式可分为单一菌降解、真菌细菌联合培养和菌群发酵[18]。然而对于真菌细菌联合培养对煤的降解作用尚无定论。卢丽丽[12]的研究表明混合菌种对煤的降解率大于单一菌种对煤的降解率,王龙贵等[19]、张明旭等[20-21]的研究具有类似的结论。李非杨[16]的研究则显示相对单一菌种来说,混合菌对预处理风化煤的液化并未达到很好的效果。MAKA 等[22]报道了一种真菌细菌组合对煤的降解作用,但未做混菌与纯菌的对比。
武俐等[23]发现As、Ba、Co、Ni 和Pb 等微量元素在煤生物气化过程中从煤中转移到了降解液,导致降解液微量元素的质量浓度升高。接种嗜酸氧化亚铁硫杆菌(Acidithiobaillus ferroxridans)的煤矸石,其锰铬等金属元素的释放明显增加[24]。这些研究表明在煤的微生物降解过程中金属元素会发生迁移转化,而目前对煤的好氧降解过程中金属元素在煤与降解液之间的转移研究较少。
笔者利用从腐木中分离得到的一株真菌和一株细菌开展了联合降解义马煤研究,对降解液及其酸沉淀产物腐植酸进行了分析,为深入分析煤的真菌细菌联合降解过程提供参考。
1 材料与方法
1.1 煤样与菌源
(1)硝酸氧化煤。河南义马煤,破碎筛分至80~120 目(0.125~0.200 mm),80 ℃烘干48 h。在500 mL 烧杯中加入煤样100 g、7.6 mol/L 硝酸150 mL,反应过程中将烧杯放入室温水中避免反应物溢出,同时不断搅拌至黄烟消失后静置反应24 h,用纯水清洗煤至上清液pH > 6 后将煤样在80 ℃下烘干72 h 备用。
(2)菌源。实验室分离的真菌雅致小克银汉霉(Cunninghamella elegans),简称F11;细菌芽孢杆菌(Bacillussp.),简称B1。
1.2 培养基
(1) PDA 培养基。市售PDB(环凯生物)培养基干粉24 g、琼脂粉25 g、纯水定容至1 L。
(2) LB 培养基。蛋白胨10 g、氯化钠10 g、酵母粉5 g、纯水定容至1 L。LB 固体培养基另加入琼脂粉12 g。
1.3 实验方法
1.3.1 真菌细菌混合物联合降解
用接种环从保存的F11 斜面上刮取适量菌丝转入含有5 mL 无菌水的离心管中,充分震荡离心管使菌液均匀,取200 µL 菌液滴加于PDA 培养基,用涂布棒均匀涂布,30 ℃恒温倒置培养5 d,菌丝铺满平板。
用接种环从保存的B1 斜面上蘸取少量菌体转入含有5 mL 无菌水的离心管中,充分震荡离心管使菌液均匀,取200 µL 菌液滴加于LB 固体培养基,用涂布棒均匀涂布,30 ℃恒温倒置培养2 d,菌落铺满平板。
在250 mL 三角瓶中加入150 mL LB 培养基,湿热灭菌后,用打孔器分别接入4 孔真菌(4F)、3 孔真菌+1 孔细菌(3F1B)、2 孔真菌+2 孔细菌(2F2B)、1 孔真菌+3 孔细菌(1F3B)、4 孔细菌(4B)、50 孔真菌+1孔细菌(50F1B),放入恒温振荡器在30 ℃、150 r/min条件下恒温振荡培养4 d,加入2 g 灭菌的硝酸氧化煤振荡均匀,静置4 h 后取上清液测pH、吸光度A450作为第0 天的数据。放入恒温振荡器在30 ℃、150 r/min 条件下继续培养,每4 d 取降解液测pH、吸光度A450(尤尼柯,UV-4802)。对照组(CK)的培养基中不接种。每组实验做3 个平行样。
1.3.2 降解液中金属元素质量浓度测定
待A450稳定后(A450为降解液在450 nm 处的吸光度),将降解液在10 000 r/min 下离心10 min,收集上清液,按照HJ 700—2014《水质 65 种元素的测定 电感耦合等离子体质谱法》测上清液中Cr、As、Mn、Pb、Co、Ni、Cu、Zn、Mo 的质量浓度。
1.3.3 腐植酸收集与分析
待A450稳定后,将降解液在10 000 r/min 下离心10 min,收集上清液,用盐酸将上清液pH 调至2 以下[15],静置沉淀24 h,10 000 r/min 下离心10 min,收集沉淀(腐植酸),在80 ℃下烘干48 h 后称重,根据腐植酸的质量计算产率。
腐植酸产率计算公式为
式中,ηi为实验组i的 腐植酸产率,i取1F3B、2F2B、3F1B、50F1B、4B、4F;Mi为实验组i的腐植酸质量,g;MCK为对照组CK 的腐植酸质量,g;M0为实验启动时加煤的质量,g。
取烘干后的腐植酸1 g 加入5 mL 甲醇, 50 ℃浸泡萃取72 h[25]。萃取完成后,将上清液用氮吹仪在45 ℃浓缩至1 mL,采用气质联用仪(Agilent 7890A-5795C)进行组分分析。色谱柱采用Agilent VFWAXms(30 m×250 µm×0.25 µm),载气为高纯度的氦气,进样量0.8 µL,柱流速1.0 mL/min,柱子初始温度60 ℃,保持2 min,以10 ℃/min 的速率升温至250 ℃,保持20 min。分析完成后用NIST08 数据库进行有机物鉴定。
采用岛津IRAffinity-1S 对腐植酸进行红外光谱扫描,样品与溴化钾质量比为1∶200,扫描范围为400~4 000 cm-1,扫描24 次,分辨率0.5 cm-1。
2 结果与讨论
2.1 产物元素分析
研究表明,煤的硝酸氧化反应可以将煤中的脂肪结构、酚羟基和醌结构氧化破裂生成腐植酸、草酸和小分子脂肪酸[26],煤的微生物好氧降解产物是腐殖酸[27]。因此经过盐酸沉淀后对照组的产物是化学提取的腐植酸(chemically extracted humic acid, cHA),实验组是生物提取的腐植酸(bio-extracted humic acid,bHA)。由表1 可知,原煤经过硝酸氧化后氮、氧质量分数升高,这是因为煤硝酸氧化反应过程中存在着硝化反应[26]。DONG 等[28]的研究说明褐煤好氧降解过程中腐植酸(bHA)结合了培养基中的氮,VERHEYEN 等[29]研究发现原煤氧化过程中40%的氢生成了脂肪化合物,其中乙酸、丁二酸和丙二酸是主要产物。本文所用LB 培养基中的蛋白胨和酵母粉都是富含氮元素的试剂,由表1 可知氮、氢质量分数呈现出bHA >cHA > 氧化煤的趋势,说明bHA 和cHA 均可结合培养基中的氮且在微生物的作用下bHA 结合氮能力大于cHA,腐植酸生成的过程中还富集了煤中的氢元素,这一现象与文献[30-31]一致。

表1 样品元素分析Table 1 Ultimate analysis of samples %
2.2 降解机理分析
以实验结束时的吸光度及腐植酸质量作图,结果如图1 所示,2 组数据变化趋势一致。经相关性分析可知其相关系数为0.998,说明2 者间存在强相关性。将吸光度与产物质量进行线性拟合,如图2 所示,判定系数R2=0.997,说明吸光度可以指示煤的降解程度[32]。

图1 不同组降解液吸光度与腐植酸质量变化趋势Fig.1 Trend of absorbance of degradation solution and humic acid quality in different groups

图2 不同组降解液吸光度与腐植酸质量拟合Fig.2 Fitting of absorbance of degradation solution and humic acid quality in different groups
实验组(1F3B、2F2B、3F1B、50F1B、4B、4F)及对照组(CK)的产物质量分别为1.23、1.38、1.34、1.31、1.25、1.20、0.03 g,根据式(1)计算得混合菌(1F3B、2F2B、3F1B、50F1B)降解的产物产率分别为60.00%、67.17%、65.17%、63.67%,真菌(4F)、细菌(4B)分别为58.17%、61.00%,降解率整体上呈现出混合菌大于纯菌、细菌大于真菌的规律。
实验过程中各组的pH 变化规律如图3 所示,对照组(CK)的pH 从5.33 缓慢降低到4.46 后稳定,与文献报道的现象一致[31,33],而实验组的pH 从第4 天至实验结束在7.86~8.72 的碱性范围内波动,说明真菌、细菌及其混合物在实验过程中产生了碱性物质。纯菌作用下的pH 始终略低于混合菌,结合吸光度变化规律(图4)可知相应的混合菌的降解率高于纯菌,说明真菌细菌联合降解煤时具有相互促进的作用,混合菌产生的碱性物质比纯菌多,碱性物质在煤降解过程中发挥了重要作用。实验启动时,真菌实验组的pH 与其他实验组相差约1,而吸光度则约为其他实验组的1/3,也说明了碱性物质对煤降解产生了重要影响。

图3 不同组降解液pH 变化趋势Fig.3 Trend of pH in different degradation solutions

图4 不同组降解液吸光度变化趋势Fig.4 Trend of absorbance in different degradation solutions
2.3 降解液金属元素变化规律
如图5 所示,Cr、Mn、Co、Ni、Cu、Zn、As、Mo、Pb 等9 种金属元素在对照组(CK)中均检出,说明即使无微生物的降解作用也会有一定量的金属元素从煤中迁移到降解液中,这是因为强酸氧化处理过的煤即使无生物或化学试剂的作用也可在水中部分溶解[34]。

图5 降解液中金属元素质量浓度分布Fig.5 Distribution of metal element content in degradation solution
Cr、Co、Ni、Cu、Zn、As、Mo、Pb 等8 种金属元素在实验组降解液中质量浓度高于对照组(CK),说明真菌、细菌及其混合物在降解煤的同时具有促进金属元素从煤中向降解液中迁移的作用,这与武俐等[23]在煤的生物气化过程中发现的As、Ba、Co、Ni 和Pb 等金属元素元素从煤中转移到了降解液的现象类似。
将金属元素质量浓度与吸光度进行线性拟合,结果如图6 和表2 所示,Cr、As、Pb、Ni、Cu、Mo 等6种金属元素与A450拟合的判定系数(R2)大于0.6 且模型检验结果为显著,即Cr、Ni、Cu、As、Mo、Pb 与A450正相关,也即煤降解液中的金属元素Cr、Ni、Cu、As、Mo、Pb 质量浓度越高,相应的煤降解率也越高。
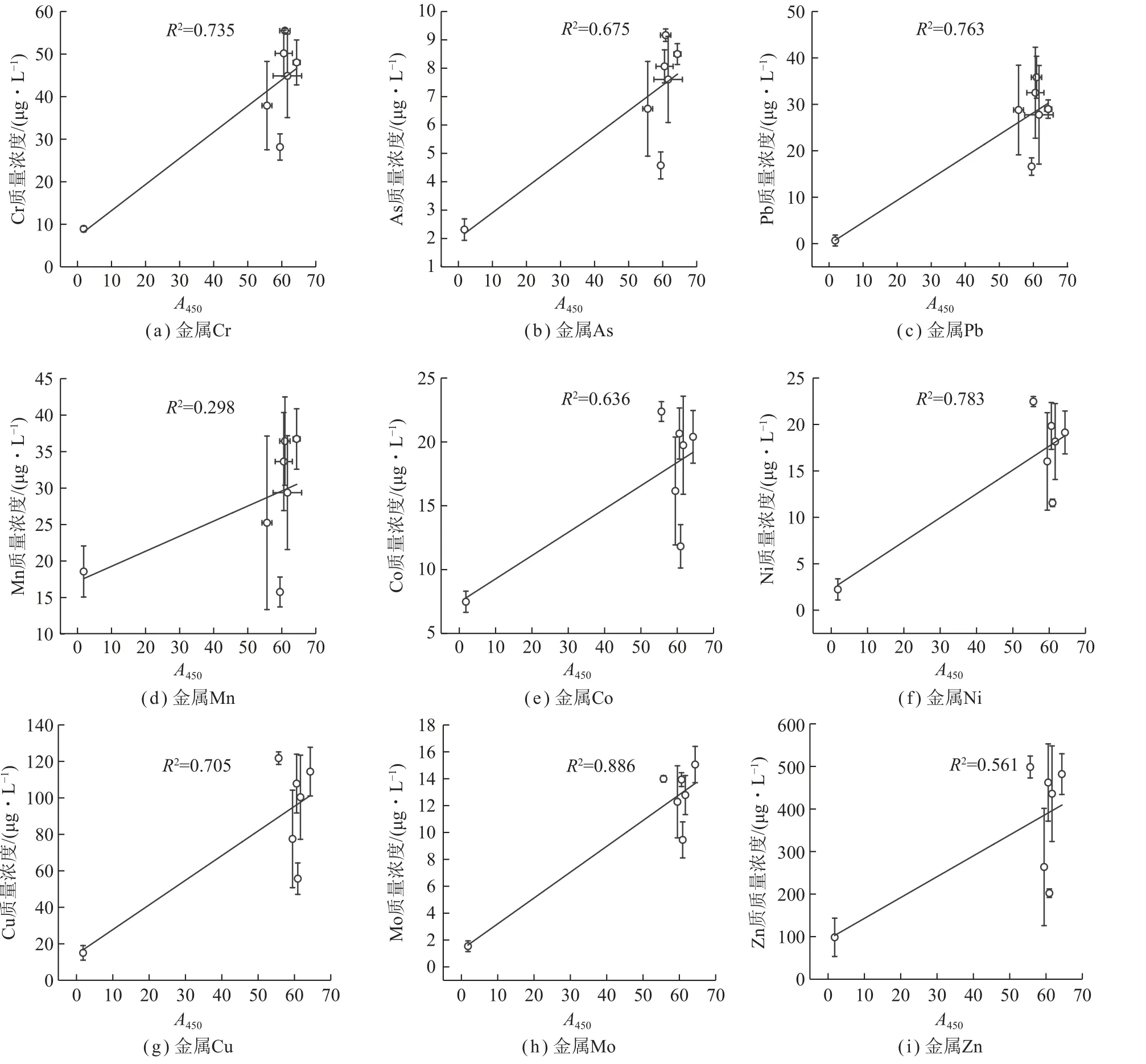
图6 金属元素质量浓度与吸光度拟合Fig.6 Fitting of metal element content and absorbance
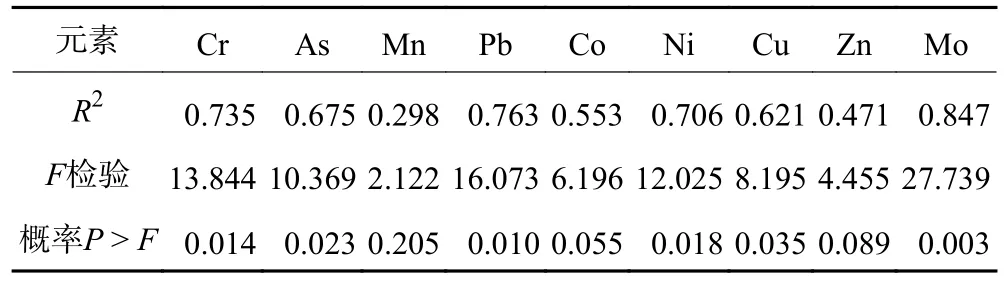
表2 金属元素与吸光度拟合参数Table 2 Fitting parameters of metal elements and absorbance
如图6(d)所示,Mn 元素在对照组(CK)中质量浓度高于细菌实验组(4B),与吸光度间无显著的相关关系。对照组中含有锰元素说明煤中含有该元素。一方面由上文分析可知细菌(4B)实验组的煤发生了降解,因此煤中的Mn 元素会转移至降解液中导致Mn元素质量浓度升高。另一方面,微生物分离过程中发现真菌F11 和细菌B1 均可使苯胺蓝平板褪色而苯胺蓝可以指示锰过氧化物酶的存在,说明两株菌均可产生锰过氧化物酶。研究表明锰过氧化物酶的反应需要Mn 的参与[35-36],因此降解液中的锰因参与反应而导致质量浓度降低。综上所述,在煤的降解过程中Mn 元素存在着释放与利用平衡。混合菌实验组的Mn 元素质量浓度高于对照组(CK)且与之存在显著差异(P< 0.05),说明真菌与细菌混合具有协同作用,锰元素的释放大于利用,因此在降解液中的质量浓度升高,这与pH 分析的结果一致。Co、Zn 的质量浓度与吸光度间无显著的相关关系,具体原因还有待进一步研究。
2.4 腐植酸甲醇萃取物GCMS 分析
由图7 及表3 可知,2、3、9、11、13、14、18、19号峰为对照组及实验组共有的峰,对应的化合物为乙二酸、十六烷酸、十八烷酸、吡咯、4 种吡咯衍生物。

图7 不同组腐植酸甲醇萃取物GCMSFig.7 GCMS of methanol extracts of humic acid in different groups
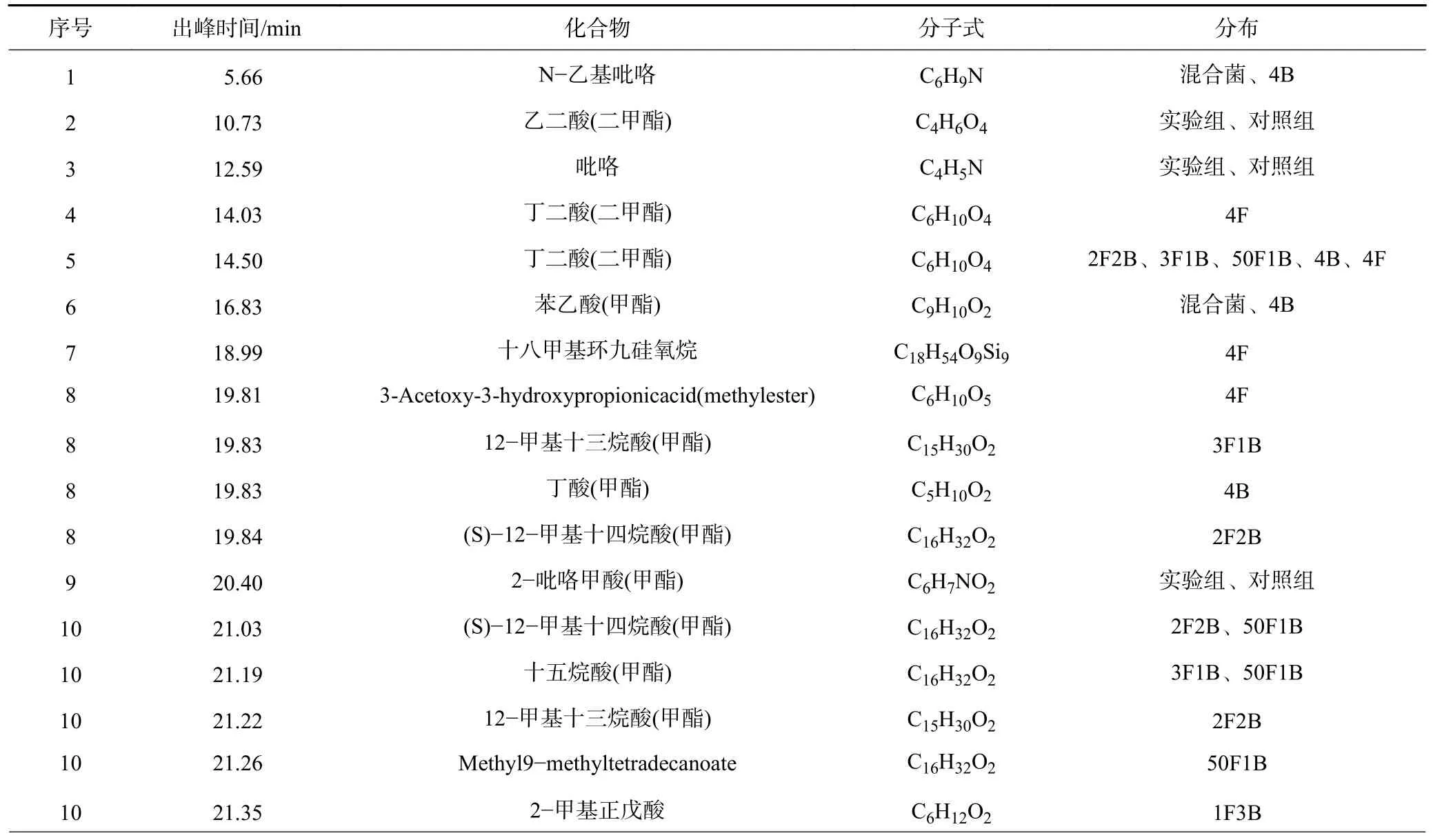
表3 腐植酸甲醇萃取物GCMS 定性结果Table 3 GCMS qualitative results of methanol extracts of humic acid
由对照组、4F、4B 组的色谱图(图7)可知,7、17号峰仅出现在4F 实验组,因此对应的化合物十八甲基环九硅氧烷、顺-13-二十二碳烯酸为真菌特征性产物。1、6、16 号峰仅出现在4B 实验组,对应的N-乙基吡咯、苯乙酸、4-羟基苯乙酸为细菌的特征性产物。结合混合菌实验组的色谱图可知,细菌的特征性产物在混合菌实验组中检出而真菌的特征性产物则未检出,说明混合后细菌占主导作用。由图3 可以看出,在整个实验周期内尤其是第4 天之前混合菌降解液的pH 始终与细菌降解液接近,也从侧面说明混合后细菌占主导作用。
4、5、8、10、12 号峰在对照组未检出,其中4、5号峰定性为丁二酸,8、10 号峰为长链脂肪酸(C13、C14、C15)、挥发性脂肪酸(C3、C4、C5),12 号峰为2种吡咯衍生物。与对照组的cHA 相比,除了共有的十六烷酸(C16)、十八烷酸(C18)、4 种吡咯衍生物之外,实验组的bHA 中含有更多脂肪链较短、分子量较小的脂肪酸和种类更丰富的吡咯衍生物。GHANI M J等[13]的研究表明相对于cHA,bHA 的分子量和芳香性降低,与本文的研究结果类似。
15 号峰在实验组及对照组均可定性为芳香族化合物,在对照组为含氧稠杂环化合物,在实验组中为含氮稠杂环化合物或有含氮官能团的化合物,说明bHA 的含氮化合物更多,与元素分析的结果一致。
2.5 腐植酸红外光谱分析
如图8 所示,各组产物的红外光谱图相似,3 500~2 000 cm-1有一个弥散的强吸收谱带,对应羧基COOH 的O—H 和NH+伸缩振动[37]。2 362 cm-1处为羧基的氢键缔合伸缩振动[38-39]。1 720、1 666 cm-1处为羰基C=O 的伸缩振动[37,40-41]。1 543、1 407 cm-1处苯环骨架振动[37]。说明腐植酸大分子的基本结构含有芳香环并富含羧基、羟基、羰基等活性官能团。如前文所述,实验组含有更多的含氮稠杂环化合物或含氮官能团,其中吡咯、呋喃和噻吩的结构是与苯环类似封闭的芳香共轭体系[42]。杂环的骨架吸收峰与苯环相似[43],因此在1 407 cm-1处吸收峰比对照组强。

图8 不同组腐植酸红外光谱Fig.8 FTIR of humic acid in different groups
3 结 论
(1)雅致小克银汉霉(C.elegans)和芽孢杆菌(Bacillussp.)均可通过碱性物质作用机理实现硝酸氧化煤的降解,腐植酸产率分别为58.17%、61.00%。两株菌混合具有协同作用,腐植酸产率可提高到67.17%。
(2)芽孢杆菌(Bacillussp.)的特征性产物在混合菌实验组中检出而雅致小克银汉霉(C.elegans)的特征性产物则未检出,混合菌降解液的pH 始终与芽孢杆菌(Bacillussp.)降解液接近,说明混合后芽孢杆菌(Bacillussp.)占主导作用。
(3)在煤的生物降解过程中Cr、As、Mn、Pb、Co、Ni、Cu、Zn、Mo 等9 种金属元素从煤迁移到了降解液中,其中Cr、Ni、Cu、As、Mo、Pb 等6 种与吸光度A450具有显著的正相关性,可以表征煤降解率的相对大小。Mn 在煤的生物降解过程中存在释放与利用平衡。
(4) cHA 与bHA 均富含羧基、羟基、羰基等活性官能团、含有长链脂肪酸、4 种吡咯衍生物。同时,bHA 还含有分子量较小的脂肪酸(C3、C4、C5、C13、C14、C15)及含氮化合物,bHA 结合氮、富集氢的能力大于cHA。
