Glisson蒂横断式肝切除术在小儿肝脏肿瘤手术中的应用效果分析
2023-12-11陈晋宇席红卫
陈晋宇, 席红卫
小儿原发性肝脏肿瘤占儿童所有腹部肿瘤的5%~6%[1],其中良性肿瘤占三分之一,恶性肿瘤占三分之二[2]。不同类型原发性肝脏肿瘤的治疗方法各不相同,大多数良性肿瘤的治疗是通过手术切除或仅需保守观察。恶性肿瘤则多以手术、化疗等多种方式相结合来进行治疗,完全手术切除是可切除恶性肿瘤在早期诊断时的首选治疗方法。Glisson蒂横断式肝切除术在成人肝脏外科中已广泛应用,取得了较好效果,但该方法在儿童原发性肝脏肿瘤中的应用较少。本文回顾性分析我院普外科收治的原发性肝脏肿瘤患儿的临床资料,对其病史、临床症状、实验室指标参数、手术和随访资料等进行总结分析,旨在探讨Glisson蒂横断式肝切除术在小儿原发性肝脏肿瘤手术中的应用效果,现报道如下。
1 资料与方法
1.1临床资料 选择2019年10月至2022年10月山西省儿童医院普外科收治的18例原发性肝脏肿瘤患儿的临床资料。纳入标准:(1)术后组织病理学检查确诊为原发性肝脏肿瘤;(2)术前均行三维重建成像,并计算术后残肝量[预计残肝体积(residual liver volume,RLV)>标准肝体积25%;化疗后>30%];(3)术前完善心、肺、肾等功能检查,排除手术禁忌证;(4)接受Glisson蒂横断式肝切除术进行治疗;(5)患儿监护人签署化疗和手术同意书,术后随访依从性良好。排除标准:(1)合并严重器官功能障碍和不耐受手术的患者;(2)肿瘤侵犯门静脉、肝静脉、下腔静脉,出现肝内肿瘤血栓或肝外转移者;(3)临床资料及随访资料不全者。本研究获山西省儿童医院伦理委员会批准(批号:IRB-KY-2019-002)。
1.2手术方法 18例原发性肝脏肿瘤患儿均接受Glisson蒂横断式肝切除术。患儿取平卧位,进行全身麻醉及气管插管,常规消毒皮肤后,取剑突至右肋下缘反“L”形切口或剑突至右肋下缘+左肋下缘“人”形切口。见图1ⓐ。逐层入腹,探查腹腔及肝脏有无肿瘤转移。离断肝周韧带,游离第一肝门,绕第一肝门预置一阻断带。逆行游离胆囊板至肝门板水平,下降肝门板,暴露肝门。见图1ⓑ。锐性游离逐渐显露左、中、右三支Glisson蒂,阻断带悬吊三支Glisson蒂。见图1ⓒ。切除胆囊,根据肿瘤所在区域,选择性地阻断相应Glisson蒂,可见肝脏显露缺血线。见图1ⓓ。使用柯惠ForceFX-8C高频电刀和美国强生CEN11超声刀进行肝实质离断。见图1ⓔⓕ。应用5-0 Prolene线缝合创面血管及胆管,防止术后出血或胆漏。肝段面常规留置引流管。
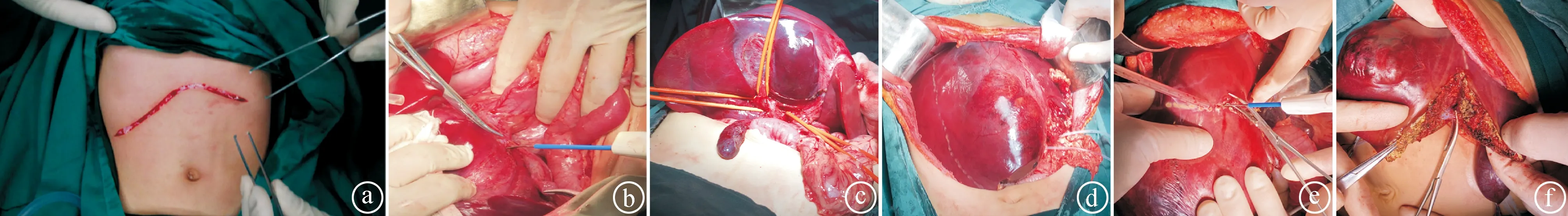
ⓐ反“L”形切口;ⓑ解剖肝门板;ⓒ三支Glisson蒂悬吊;ⓓ阻断肝蒂后显露缺血线并做标记;ⓔ离断肝实质;ⓕ肝脏切缘
1.3资料收集 通过医院电子病历系统收集患者的临床资料,包括:(1)一般资料:性别、年龄、体重、首发症状、体征、化疗情况,以及肿瘤的生长部位、体积、转移情况、临床分期等;(2)围术期相关指标资料:手术时间、术中出血量、输血量、术后并发症、腹腔引流管留置时间、术后住院时间等;(3)实验室检测资料:使用日本Sysmex XN-350全自动血细胞分析仪及配套试剂测定血红蛋白(haemoglobin,Hb)、红细胞(red blood cells,RBC)、白细胞(white blood cells,WBC)、血小板(platelets,PLT)。使用美国贝克曼Coulter AU5800全自动生化分析仪及配套试剂检测谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆汁酸(total bile acid,TB)、白蛋白(albumin,ALB)、甲胎蛋白(alpha-fetoprotein,AFP)、乳酸脱氢酶(lactate dehydrogenase,LDH)。(4)影像学检查资料:采用PHILIPS-EPIQ7彩色多普勒超声仪进行腹部检查;采用西门子SOMATOM 128层螺旋CT进行腹部普通扫描和增强扫描。
1.4统计学方法 应用SPSS26.0统计软件进行数据分析。不符合正态分布的计量资料以中位数(下四分位数,上四分位数)[M(P25,P75]表示,指标手术前后比较采用配对设计秩和检验。P<0.05为差异有统计学意义。
2 结果
2.118例原发性肝脏肿瘤患儿临床特征 18例原发性肝脏肿瘤患儿,男11例,女7例,发病年龄8个月~9岁。良性肿瘤10例,包括血管瘤5例,肝囊肿3例,错构瘤2例;恶性肿瘤8例,包括肝母细胞瘤7例,肝细胞癌1例。本组患儿中,肝右叶受侵犯10例,肝左叶受侵犯6例,肝左右叶均受侵犯2例,均未发生转移。首发临床表现以腹部膨隆为主。见表1。
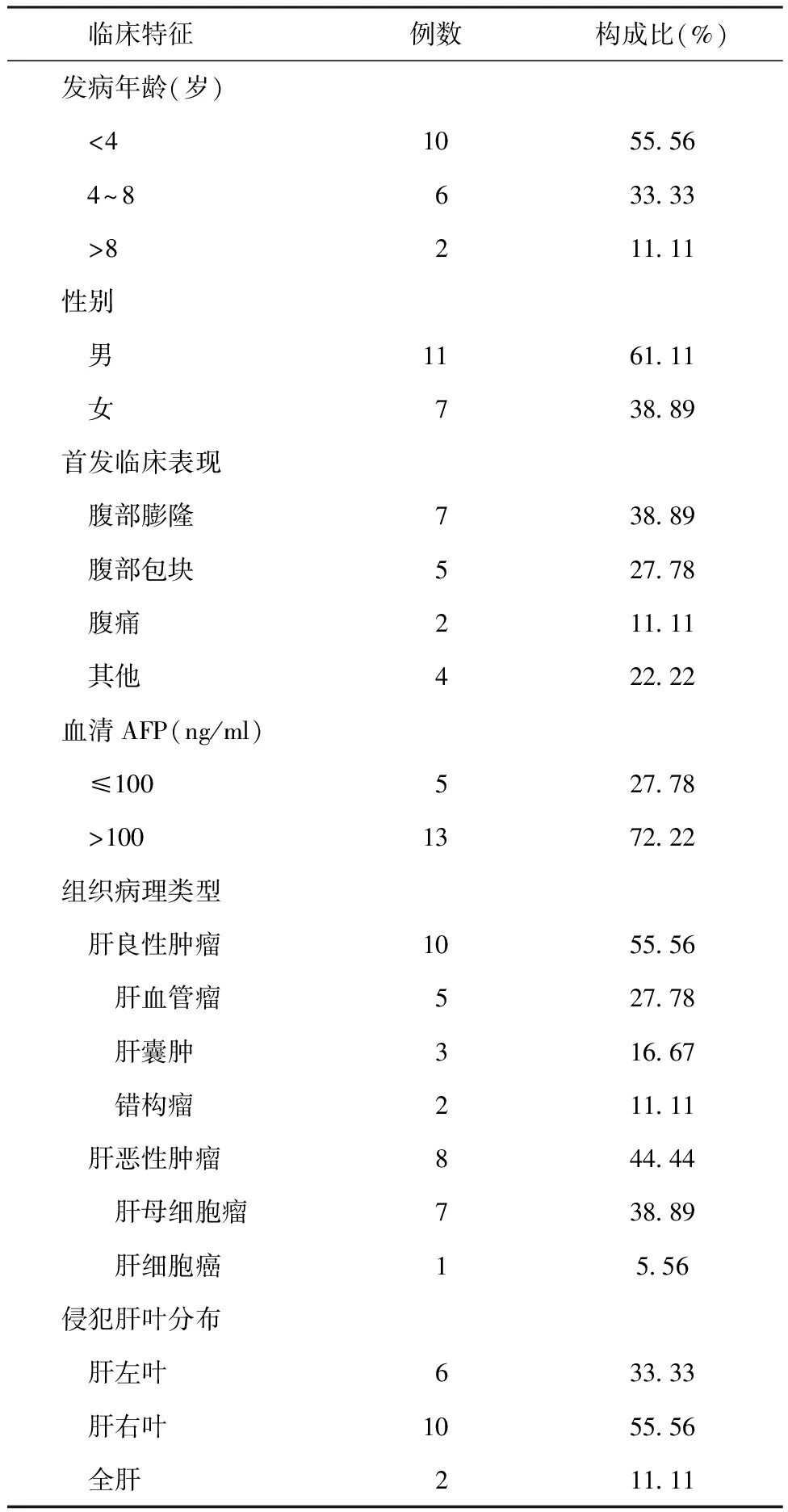
表1 18例原发性肝脏肿瘤患儿临床特征
2.218例原发性肝脏肿瘤患儿手术结果 18例患儿均通过Glisson蒂横断式肝切除术成功行相应的肝段或肝叶切除,手术时间为(204.52±46.84)min,术中出血量为(245.73±56.86)ml,术中输血量为(200.84±50.57)ml。18例患儿均未发生围术期死亡,无术后出血、肝功能衰竭等并发症发生。
2.318例原发性肝脏肿瘤患儿手术前后实验室指标比较 与术前相比,患儿术后1周PLT和TB水平降低,差异有统计学意义(P<0.05)。WBC、RBC、Hb、AFP、ALB、AST、ALT和LDH等指标在手术前后比较差异无统计学意义(P>0.05)。见表2。7例肝母细胞瘤患儿术后血清AFP较术前显著升高[234.00(44.00,550.00) vs 140.00(23.00,495.00);Z=4.846,P=0.018]。
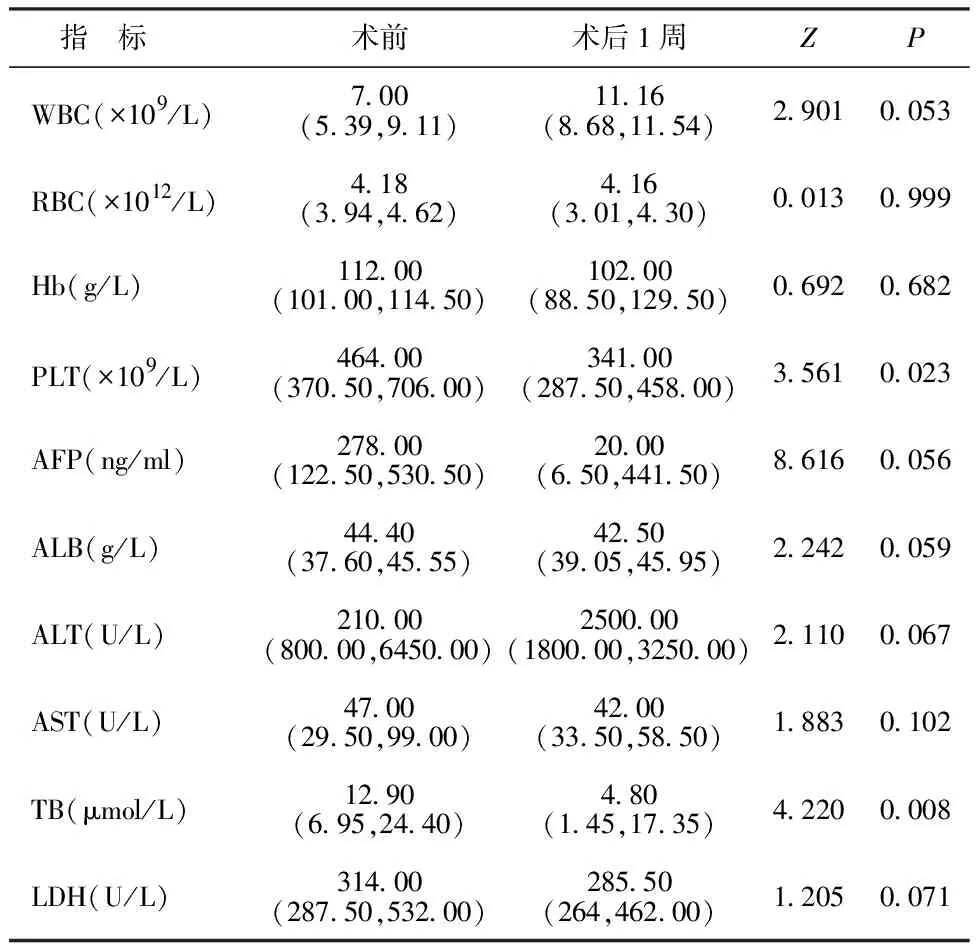
表2 18例原发性肝脏肿瘤患儿手术前后实验室指标比较[M(P25,P75)]
2.418例原发性肝脏肿瘤患儿术后随访情况 18例患儿术后随访时间2~18个月,10例良性肿瘤患儿的生长发育、智力等方面与同龄健康儿童相似,均未发现肿瘤复发,生存率为100%。8例恶性肿瘤患儿中,1例肝母细胞瘤患儿在术后6个月复发,予C5VD(顺铂+氟尿嘧啶+长春新碱+阿霉素)方案化疗3个疗程,复查腹部CT示肿瘤体积明显缩小,随访截至2023年6月仍带瘤生存;其余7例患儿出院后1、3、6个月复查血常规、AST、ALT均正常,复查腹部超声未见复发情况,术后第12、18个月复查腹部平扫及增强CT未见复发。随访截至2023年6月未见感染、肝功能衰竭等严重并发症发生,未复发。
3 讨论
3.1儿童原发性肝脏肿瘤的发病率约占所有儿童恶性肿瘤的1%,占肝脏肿瘤的2/3[3],包括肝母细胞瘤、肝细胞癌、恶性横纹肌样肿瘤、未分化胚胎肉瘤和血管肉瘤等[4-5]。Glisson蒂横断式肝切除术,是由东京女子医科大学外科部高崎健(Ken Takasaki)教授于1984年首创并报道[6],其总结了与肝脏解剖技术有关的理论依据、具体的手术技术、并发症和患者预后的详细临床资料和手术经验,经多年的实践发展,现已成为一项成熟、安全、可靠的肝切除方法。该方法的肝脏解剖基础是肝外Glisson膜向肝内延伸为Glisson鞘,肝内门管三联与肝外部分属于同样的解剖结构——同一个Glisson系统。将肝脏解剖按门静脉走行分为左叶(SⅡ、Ⅲ、Ⅳ段)、中叶(SⅤ、Ⅷ段)、右叶(SⅥ、Ⅶ段)及尾状叶,分支的血管供应每个肝段,肝段之间有肝静脉及其分支通过,根据手术部位的需要进行相应区域Glisson蒂阻断,相关的肝动脉、门静脉和肝内胆管分支被一起处理,从而避免了晚期胆管剥离造成的血管和胆管创伤,使手术更加精确,达到解剖性切除病变的目的。这种技术可以解剖三级门静脉分支,并对肝段进行解剖性切除,以达到精确的手术效果。该手术方法的优点在于:(1)符合恶性肿瘤治疗原则,预防术中经门静脉的肿瘤播散;(2)肝门部门管三联不需要解剖,减少了手术时间,避免了对胆道和血管不必要的损伤;(3)切除分界线清晰;(4)不影响残肝血供,无残肝功能损伤;(5)无血流动力学改变及内脏淤血发生;(6)特别适合于小肝癌的肝段和亚段的切除;(7)可以从肝前入路,减少术中对肝脏的过度挤压,减少肿瘤扩散;(8)阻断时间充足,可以从容处理肝内管道和肝脏的其他部分。Glisson蒂横断式肝切除术在成人肝切除中已广泛应用,取得了较好效果[7]。但该方法在儿童原发性肝脏肿瘤切除手术目前研究较少。
3.2本组18例患儿术前经过三维肝容量测定法和虚拟切除术对接受肝切除术的患者进行RLV的估计,为术后严重肝功能障碍的个体风险评估提供了重要信息。残肝分数(RLV %)是公认的用于评估术后残余肝脏体积容量大小的指标。也有学者认为,根据RLV/体重比率(body weight ratio,BWR)预测术后残余肝功能较单纯RLV%有更高的特异性,尤其是对于儿童肝脏部分切除术的安全切除范围有较重要的参考价值[8]。术中有以下几点需要注意:(1)仔细分离Glisson鞘。门静脉、肝动脉和胆管共同构成门管三联,在肝外和肝内均被同一纤维结缔组织所包绕,成为一管状结构Glisson鞘。Glisson鞘肝外部分为肝十二指肠韧带。Glisson鞘的处理是手术操作的重点。(2)肝门板显露。Couinaud在1957年首次提出了肝门板的概念[9],是指肝门处胆管和血管周围的Glisson鞘结缔组织相互融合增厚形成肝门板系统。门静脉系统由位于左右肝管交界处的门板、与胆囊相连的胆囊板、位于门静脉左支上方的脐静脉板或脐带板以及围绕静脉韧带的Aranti板组成[10]。肝门板上方没有主要的胆管或血管分支,有一些小的胆管和血管在门板和肝脏之间通过,游离时较安全,是肝门板下降的解剖学基础。(3)下降肝门板技术:逆行游离胆囊,牵拉胆囊,于肝圆韧带右侧抬高肝缘,肝门板处剪开Glisson鞘薄层腹膜,解剖游离肝脏与Glisson蒂,血管钳经肝门板后方向下穿出血管钳头端,留置阻断带[11]。以肝脏缺血线为标志,再参考肝静脉走行,可完成解剖性肝脏切除术。在肝脏解剖过程中,维持中心静脉压力在3~5 mmH2O,降低术中渗血,以及术后胆漏和出血的风险。术后可留置引流管,以早期发现和预防胆汁渗漏和出血。同时,引流出腹腔内积液,降低感染风险。本组患儿中有1例术后发生低流量胆漏,经引流保守治疗愈合。10例良性肿瘤患儿术后均无复发,8例恶性肿瘤中有1例肝母细胞瘤患儿复发,复发率为5.5%,低于相关文献报道的结果[12]。有研究发现,Glisson蒂横断式肝切除术可有效减少肝脏创面出血,不影响残肝血供,降低肝切除术后肝功能异常、黄疸等并发症发生率,是一种简单有效的解剖性肝段切除方法[13-14]。近年来,腹腔镜下Glisson横断法肝切除术也在国内逐渐开展,且技术日趋成熟[15-17]。另外,吲哚青绿染色荧光成像等技术的发展也提高了肿瘤所在节段腹腔镜解剖性肝切除术的准确性[18-19]。尤其是对于儿童肝脏肿瘤患者,在进行个体化评估后,采用精准肝切除手术可以达到完整去除肿瘤病灶、减轻手术打击、减少术后并发症的目的,患者预后良好[20],使肝切除手术进入了“精准肝切除时代”[21]。
综上所述,对于原发性肝脏肿瘤患儿,完善术前检查及剩余肝脏功能的评估,熟练分离Glisson鞘,精准把控肝脏切除平面,Glisson蒂横断式肝切除术对于小儿原发性肝脏肿瘤是一种出血少、操作简便、安全有效的手术方法。此种手术方式在成人应用较多,对于儿童肝脏肿瘤应用为初步探索,本研究结果为儿童肝脏肿瘤手术提供参考。
