载药微球经肝动脉化疗栓塞术联合系统性抗肿瘤方案治疗不可切除原发性肝癌的临床疗效及安全性研究
2023-12-11梁国栋
梁国栋, 彭 勇, 丛 鹏
原发性肝癌(primary hepatic carcinoma,PHC)是全球癌症发病率第六位的恶性肿瘤,其病死率居第三位[1]。在我国常见肿瘤中,PHC发病率为第四位,病死率居第二位,对人民生命健康造成了严重的威胁[2]。PHC病理类型包括肝细胞癌(hepatocellular carcinoma,HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)、混合型肝细胞-胆管细胞癌(combined hepatocellular carcinoma-cholangiocarcinoma,HCC-CCA)[3],其中以HCC最为常见。外科手术是PHC患者获得长期生存的重要方法,但大部分患者发病较为隐匿,确诊时已至中晚期,错过了最佳的手术治疗时机。因此,此类肝癌患者常常采用非手术治疗方案,包括消融治疗、经动脉化疗栓塞、放射治疗、系统抗肿瘤治疗,其中经肝动脉化疗栓塞(transarterial chemoembolization,TACE)是不可切除肝癌的常用非手术治疗方法。TACE是指将带有化疗药物的碘化油乳剂或载药微球、补充栓塞剂[明胶海绵颗粒、空白微球、聚乙烯醇(polyvinyl alcohol,PVA)]等经肿瘤供血动脉支的栓塞治疗,根据栓塞剂不同,分为常规TACE(conventional-TACE,c-TACE)、载药微球经肝动脉化疗栓塞术(drug-eluting bead transarterial chemoembolization,DEB-TACE)。c-TACE是采用以碘化油为主,辅以化疗药物形成混合乳剂,在短时间内作用于肿瘤供血血管的栓塞治疗。DEB-TACE则是持续性作用于肿瘤供血血管,并作为化疗药物载体,使肿瘤局部药物浓度达到最高,是更精细化、作用时间更长的一种治疗方法[4]。程序性死亡蛋白受体-1(programmed cell death protein-1,PD-1)是肿瘤免疫检查点,肿瘤细胞表面高表达的PD-1与免疫细胞表面程序性死亡蛋白配体-1(programmed cell death-ligand-1,PD-L1)结合,会导致肿瘤免疫逃逸[5]。近年,随着国产PD-1/PD-L1抑制剂的上市,更多患者因此受益,生存期得到延长。靶向药物主要针对肿瘤的血管生成及增殖,从而起到抗肿瘤作用[6]。系统性抗肿瘤方案包括免疫治疗、靶向治疗、化学治疗、中医中药治疗等。《原发性肝癌诊疗指南(2022年版)》[4]提倡TACE联合系统性抗肿瘤方案进行综合治疗。为了进一步明确联合治疗的临床疗效,本研究回顾性分析DEB-TACE联合系统性抗肿瘤方案治疗不可切除PHC患者的疗效及安全性,为临床医师选择安全、有效的治疗方案提供参考。
1 资料与方法
1.1临床资料 选择2021年1月至2022年12月于南充市中心医院接受DEB-TACE治疗的99例不可切除PHC患者的临床资料,根据接受联合系统性抗肿瘤方案治疗情况将其分为对照组(单纯接受DEB-TACE治疗,44例)、联合A组(接受DEB-TACE联合靶向治疗,24例)、联合B组(接受DEB-TACE联合免疫治疗,16例)和联合C组(接受DEB-TACE联合免疫+靶向治疗,15例)。四组治疗方案见表1。四组基线资料比较差异无统计学意义(P>0.05),具有可比性。见表2。本研究南充市中心医院伦理委员会批准[批号:2023年审(068)号]。

表2 四组基线资料比较
1.2纳入与排除标准 纳入标准:(1)符合《原发性肝癌诊疗指南(2022年版)》[4]中关于PHC的诊断标准;(2)肝功能Child-Pugh分级为A级或B级;(3)CNLC分期为Ⅰ~Ⅲ期;(4)ECOG评分为0~2分;(5)临床资料完整。排除标准:(1)肝功能Child-Pugh分级为C级;(2)ECOG评分≥3分;(3)合并血液系统、肾功能衰竭、自身免疫性疾病或其他器官功能不全者;(4)有化疗药物、免疫药物、靶向药物禁忌证者;(5)妊娠妇女。
1.3治疗方法
1.3.1 DEB-TACE 患者取仰卧位,常规消毒、铺巾、局部麻醉。采用经皮穿刺(Seldinge)方法穿刺右侧股动脉,置入5F血管鞘,插入5FRH导管行腹腔干造影。采集包括动脉期、实质期及静脉期的数字减影图像,仔细分析造影表现,明确肿瘤部位、大小、数目以及供血动脉支。在透视监视下经导管缓慢注入氟尿嘧啶1 g,碘化油8 ml行灌注化疗,一般灌注时间不少于20 min,采集图像可见肝内病灶碘化油沉积。再在透视下经导管缓慢注入含载药微球的混合液(根据肿瘤直径大小进行选择,载药微球直径为100~300 μm或300~500 μm,同时载表柔比星60 mg),推注速度为1 ml/min,必要时可以给予明胶海绵颗粒、空白微球、PVA补充栓塞。栓塞终点是肿瘤血管显影消失,有造影剂向后方反流,则停止注射,栓塞满意。
患者术后平卧,右下肢制动24 h,穿刺点压迫8 h。观察穿刺点有无出血。予一级护理,水化利尿、止痛、抑酸、保肝等对症治疗,24 h后根据患者情况调整护理级别,观察不良反应发生情况并及时处理。
1.3.2 药物种类及给药方法 (1)靶向药物。仑伐替尼:甲磺酸仑伐替尼胶囊(泽万欣,南京正大天晴制药有限公司,国药准字H20213638,4 mg/粒),体重<60 kg者,日剂量为8 mg(2粒),1次/d;体重≥60 kg者,日剂量为12 mg(3粒),1次/d。阿帕替尼:甲磺酸阿帕替尼片(艾坦,江苏恒瑞医药股份有限公司,国药准字H20140105,425 mg/片),日剂量为850 mg(2片),1次/d。索拉非尼:甲苯磺酸索拉非尼片(迪凯美,重庆药友制药有限责任公司,国药准字H20203403),以索拉非尼计,200 mg/片,日剂量400 mg(2片),1次/d。贝伐珠单抗:贝伐珠单抗注射液[达攸同,信达生物制药(苏州)有限公司,国药准字S20200013,4 ml∶100 mg/瓶],静脉输注,15 mg/kg,每3周给药1次,每次输注30 min以上。与联合信迪利单抗联用时,应首先给予信迪利单抗,间隔至少5 min,再给予贝伐珠单抗。(2)免疫药物。信达利单抗:信达利单抗注射液[达伯舒,信达生物制药(苏州)有限公司,国药准字S20180016,10 ml∶100 mg/瓶],静脉输注,每次剂量200 mg,每3周给药1次,与贝伐珠单抗使用时,同上述方法。卡瑞丽珠单抗:注射用卡瑞利珠单抗(艾瑞卡,江苏恒瑞医药股份有限公司,国药准字S20190027,200 mg/瓶),静脉输注,3 mg/kg,每3周1次。替雷利珠单抗:替雷利珠单抗注射液[百泽安,百济神州(北京)生物科技有限公司,国药准字S20190045,10 ml∶100 mg/瓶],静脉输注,每次剂量200 mg,每3周给药1次,每次输注30 min以上。
1.3.3 联合治疗方案 (1)联合口服给药方法。DEB-TACE治疗后,术后第3天复查血常规、肝功能、肾功能等指标,排除禁忌证后分别按上述给药方法口服仑伐替尼、阿帕替尼或索拉非尼,直至出现严重不良反应,则先减少剂量,进而停止服用。可能出现的不良反应有手足反应、肺炎、乏力、发热、皮疹、胃肠道反应、肝功能异常、肾功能异常、甲状腺功能异常、高血压等。(2)联合静脉给药方法。DEB-TACE治疗后,术后第3天复查相关指标,排除相关禁忌证后分别按上述方法给药,总计用药4次,静脉滴注信迪利单抗及贝伐珠单抗、替雷利珠单抗或卡瑞丽珠单抗,直至疾病进展或出现不可耐受毒性。可能出现的不良反应有胃肠道反应、反应性毛细血管增生症、肝功能异常、肾功能异常、乏力、骨髓抑制表现等。
1.4随访及疗效、安全性评估
1.4.1 随访 患者术后第1月复查,之后每隔3个月复查1次。复查内容包括血常规、肝功能、肾功能、凝血功能、肝癌标志物、上腹部CT或MRI等。通过电话及门诊方式随访患者疾病进展情况及不良反应发生情况。本次研究随访时间截至2023年6月30日。无疾病进展(progression-free survival,PFS)时间:开始治疗到肿瘤发生进展或随访结束的时间。总体生存(overall survival,OS)时间:开始治疗到随访结束或死亡的时间。
1.4.2 临床短期疗效评估 于术后6个月内根据改良实体瘤疗效(modified Response Evaluation Criteria in Solid Tumors,mRECIST)标准[7]进行评价:(1)完全缓解(complete response,CR):目标病灶动脉期强化消失。(2)部分缓解(partial response,PR):目标病灶长径总和减少≥30%。(3)疾病进展(progression disease,PD):目标病灶的长径总和增加至少20%,且长径总和增加的绝对值>5 mm;或者出现新的病灶。(4)疾病稳定(stable disease,SD):疾病变化情况介于PR与PD之间。客观缓解率(objective response rate,ORR)=(CR+PR)/总例数×100%。疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。
1.4.3 安全性评价 截至随访结束,记录每组不良反应及栓塞后并发症发生情况,根据美国国家癌症研究所制定的不良反应事件评价标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0[8]进行评价,分为Ⅰ~Ⅴ级。

2 结果
2.1四组临床短期疗效比较 四组临床短期疗效差异有统计学意义(P<0.05)。联合A组、联合B组及联合C组的ORR、DCR均高于对照组,差异有统计学意义(P<0.05)。联合A组、联合B组及联合C组间ORR、DCR比较差异无统计学意义(P>0.05)。见表3。
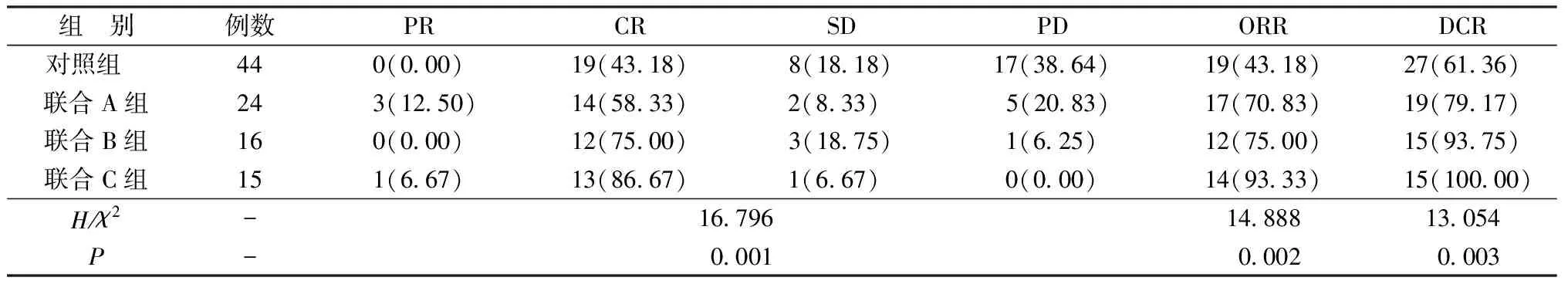
表3 四组临床短期疗效比较[n(%)]
2.2四组预后情况比较 对照组中位OS时间为15.0个月,联合A组中位OS时间为17.0个月,联合B组中位OS时间为21.0个月,联合C组中位OS时间为22.0个月,四组OS时间比较差异有统计学意义(log-rank:χ2=8.234,P=0.041)。联合A组、联合B组和联合C组间OS时间比较差异无统计学意义(log-rank:χ2=1.879,P=0.391)。对照组中位PFS时间为11.0个月,联合A组中位PFS时间为13.0个月,联合B组中位PFS时间为14.0个月,联合C组中位PFS时间为15.0个月,四组PFS时间比较差异有统计学意义(log-rank:χ2=8.514,P=0.037)。联合A组、联合B组和联合C组间PFS时间比较差异无统计学意义((log-rank:χ2=1.369,P=0.504)。见图1,2。
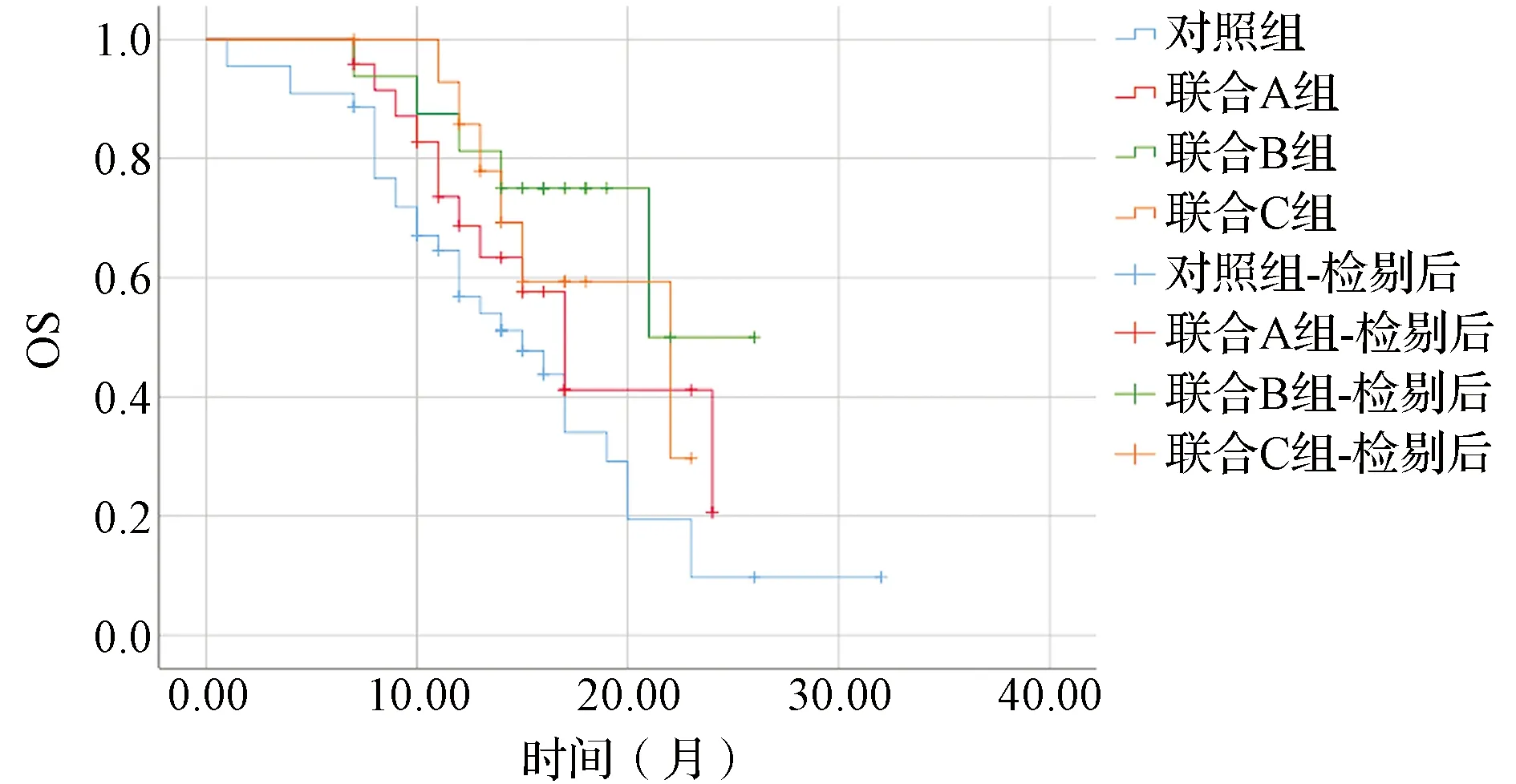
图1 四组OS的生存曲线图

图2 四组PFS的生存曲线图
2.3四组不良反应发生情况比较 截至随访结束,四组均出现有栓塞综合征、乏力及肝功能异常,但发生率差异无统计学意义(P>0.05)。对照组未出现高血压。联合A组以靶向药物不良反应多见,发生皮疹9例,骨髓抑制6例,胃肠道反应15例,手足综合征5例。联合B组以免疫相关不良反应为主,发生甲状腺功能减退5例,免疫相关性肺炎2例,反应性毛细血管增生症5例。四组皮疹、高血压、蛋白尿、骨髓抑制、胃肠道反应、手足综合征、甲状腺功能减退、免疫相关性肺炎、反应性毛细血管增生症发生率比较差异有统计学意义(P<0.05)。见表4。经对症处理后,相关不良反应症状均减轻或消失,不良反应等级均未超过Ⅲ级。
3 讨论
3.1PHC早期手术切除机会较少,疾病发展至中晚期以非手术治疗为主,在介入手术及免疫靶向治疗未能得到广泛应用前,中晚期治疗以全身化疗为主,患者的生存预后及生活质量不理想。TACE是国际上认可的一种治疗中晚期肝癌的成熟方法[9],DEB-TACE是将载有化疗药物的微球精准送入肿瘤供血血管,不仅可使化疗药物持续靶向释放,而且有肿瘤栓塞的治疗作用[10]。表柔比星又称表阿霉素,属于蒽环类抗生素类抗肿瘤药物,其药物机制是抑制DNA复制,干扰转录过程,抑制肿瘤细胞增殖的作用[11]。与cTACE相比,DEB-TACE能延长患者OS、PFS时间,且不会提高不良反应发生率[12],且DEB-TACE在一定程度上能延缓肝纤维化进展,减轻肝损伤[13]。但TACE会引起组织缺氧,导致血管内皮生长因子(vascular endothelial growth factor,VEGF)上调,这可能会导致肿瘤血运重建和局部复发[14],而分子靶向药物能够拮抗肿瘤血管生成并抑制VEGF转导通路,起到协同抗肿瘤作用。Peng等[15]的研究结果表明,cTACE联合仑伐替尼组的OS及PFS时间均显著长于单用仑伐替尼组(11.5个月 vs 0.45个月;6.4个月 vs 0.43个月)。本研究结果表明,DEB-TACE联合靶向治疗的患者ORR、DCR均高于对照组,且OS和PFS时间更长,不良反应以皮疹、高血压、手足综合征等可耐受的症状为主,安全性较好。
3.2肿瘤细胞生长、侵袭和转移与免疫应答反应有关。PD-1是T细胞免疫功能的负调节因子,与PD-L1结合后,可抑制T细胞增殖及干扰素γ、肿瘤坏死因子α、白细胞介素2的产生,导致T细胞功能障碍,抑制抗肿瘤免疫反应,促进肿瘤生长和疾病进展[16]。因此,通过抑制PD-1通路可改善患者生存率。乔师师等[17]使用PD-1抑制剂治疗晚期肝细胞癌患者,其ORR为21.8%,DCR为76.4%,中位OS时间为11.4个月,中位PFS时间为5.0个月,治疗过程中不良反应发生率为81.8%,免疫相关不良反应发生率为58.2%。本研究中,DEB-TACE联合免疫治疗患者的ORR、DCR分别为75.00%、93.75%,高于对照组,且中位OS时间为21.0个月,中位PFS时间为14.0个月,有免疫相关的反应性毛细血管增生症、免疫相关性肺炎等不良反应发生。
3.3信迪利单抗是一种全人源化的IgG4单克隆抗体,能特异性结合T细胞表面的PD-1分子,阻断免疫逃逸通路,重新激活T细胞,释放细胞因子杀伤肿瘤细胞。贝伐珠单抗通过阻断VEGF与血管内皮细胞表面上的受体结合,抑制血管内皮细胞的生长、增殖、迁移以及血管新生,降低血管渗透性,阻断肿瘤组织的血液供应,抑制肿瘤细胞的增殖和转移,诱导肿瘤细胞凋亡,从而达到抗肿瘤的治疗效果。柴喆[18]应用cTACE联合信迪利单抗及贝伐珠单抗治疗中晚期肝癌患者,其DCR显著高于应用cTACE治疗者(83.87% vs 51.61%),但两组不良反应发生率差异无统计学意义(P>0.05)。本研究结果显示,DEB-TACE联合免疫+靶向治疗的患者短期疗效更优,但长期预后与DEB-TACE单独联合免疫治疗或靶向治疗相比无显著差异,提示相较于单纯DEB-TACE或DEB-TACE单独联合免疫治疗或靶向治疗,DEB-TACE联合免疫+靶向治疗可减缓疾病进展速度,有一定的临床获益。
3.4本研究也存在一些不足之处,包括:(1)纳入指标较少,未能通过多因素Cox回归分析探讨不同治疗组生存预后的影响因素。(2)本研究为单中心回顾性研究,存在一定的选择偏倚,且样本量较少,代表性存在不足。(3)本研究随访时间短,需要长期随访验证生存预后的长期疗效。(4)本研究对于短期疗效未进行多时间段比较。(5)可能存在某些不良反应记录缺失等问题。
综上所述,DEB-TACE联合系统性抗肿瘤方案治疗PHC的临床疗效及安全性较好,但结论尚需进一步通过大样本量的多中心前瞻性研究加以验证。
