硫氢化钠减轻高糖高脂诱导的大鼠心肌细胞系H9C2线粒体损伤
2023-12-11张伟才刘肆仁王尚农
张伟才,刘肆仁,王尚农
北京市第六医院 1.心内科,2.内分泌科,北京 100070
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者的主要并发症之一,早期表现为心肌顺应性降低和舒张期充盈受阻的舒张功能不全,晚期以收缩功能不全为主的充血性心力衰竭[1-2]。已有报道,糖尿病心肌病发生与线粒体分裂增加,自噬受损,引起线粒体功能失调和线粒体ROS生成增加有关[3]。但其具体机制尚未阐明。
硫化氢(hydrogen sulfide,H2S) 在哺乳动物体内主要由胱硫醚 β 合成酶(cystathionine-β-synthase, CBS)、胱硫醚 γ 水解酶(cystathionine-γ-synthase, CSE)和 3-巯基丙酮酸硫转移酶(3-mercaptopyruvate sulfurtransferase, 3-MST)催化合成[4]。CSE和CBS分布具有组织学差异,CSE在心血管系统中表达较高。已证明,H2S在低氧条件下可以维持线粒体ATP产生,表明H2S对线粒体功能和呼吸具有保护作用[5-6]。气体分子H2S进入细胞解离为HS-,NaHS进入体内也解离HS-,因此本文选择NaHS作为H2S供体。帕金森病相关蛋白7(Parkinson′s disease-associated protein 7,DJ-1)是同源二聚体蛋白,包含三个半胱氨酸残基(Cys46、53和106);其对氧化还原反应非常敏感,可作为氧化应激的感受器,调节相关信号转导途径,介导抗氧化应激反应[7]。本实验探究在高糖高脂条件下硫氢化钠调节线粒体形态对心肌细胞保护的机制。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级10周龄雌性db/db小鼠 (瘦素受体基因纯合突变的小鼠)60只,体质量45~55 g(南京动物实验中心研究所)和雌性野生型 C57BL小鼠25只,体质量27~35 g (哈尔滨医科大学动物实验中心)。细胞:大鼠心肌细胞系H9C2(中科院上海细胞库)。
1.1.2 药品: 硫氢化钠(sodium hydrosulfide, NaHS) 和N-乙酰半胱胺酸 (N-acetyl-L-cysteine, NAC) (Sigma-Aldrich公司)。
1.1.3 试剂:RIPA裂解液、BCA蛋白定量试剂盒、ECL发光试剂盒(上海碧云天生物科技公司);CSE,CBS、DJ-1、Mfn、Fis和GAPDH抗体(Proteintech公司);ELISA试剂盒(武汉优尔生公司); MitoTracker Green染液(Sigma-Aldrich公司)和lipofectamine 3000脂质体 (Invitrogen公司);探针7-azido-4-methylcoumarin (Sigma-Aldrich公司)。
1.2 方法
1.2.1 动物的分组及取材: 饲养在昼夜交替的照明条件下,自由进食和饲水。若连续3 d血糖>16.7 mmol/L证明模型成功,进行随机分组。实验动物随机分为四组:野生型(WT),野生型给药组(WT+NaHS)(腹腔注射4.8 mg/kg NaHS,隔天1次),db/db组和db/db给药组(db/db+NaHS)(腹腔注射4.8 mg/kg NaHS,隔天1次),持续12周。实验结束后处死大鼠,取心脏,部分保存于-80 ℃,另一部分固定于4%多聚甲醛中。
1.2.2 H2S含量的检测: 取心肌组织冰冻切片于室温平衡放置15~20 min,或细胞样品用PBS洗3次,用H2S探针7-azido-4-methylcoumarin(C-7Az,50 μmol/L)对心肌组织冰冻切片进行染色,37 ℃恒温箱放置30 min,PBS洗3次,每次5 min,全程防止干片,荧光显微镜下观察荧光激发情况。
1.2.3 透射电子显微镜检测心肌超微结构:将小鼠心脏左心室固定于2.5%戊二醛磷酸缓冲液中,4 ℃过夜后,1%锇酸处理2 h,饱和醋酸铀酰整体染色1 h,乙醇脱水,环氧树脂包埋后制成 50~70 nm的超薄切片,然后进行醋酸铀酰和柠檬酸铅染色。透射电镜下观察心肌组织超微结构的变化。
1.2.4 心动超声检测心功能指标:使用阿佛汀(240 mg/kg)麻醉小鼠后,用GEVIVID 7 10S探头,10 MHz进行彩色多普勒超声心动图二维成像与TDI(tissue doppler imaging, TDI)技术分别测定WT组,WT+NaHS组,db/db组及db/db+NaHS治疗组小鼠心脏功能参数。一般采取3~5个心动周期测量的数据,取其平均值。实验过程中保持动物心率恒定。
1.2.5 细胞的培养及分组:将H9C2细胞于含10%胎牛血清的DMEM培养基中培养,在加药培养48 h后分为:1)正常对照组(control):含有10%胎牛血清低糖DMEM(5.56 mmol/L);2)高糖高脂组(HG+Pal+Ole):40 mmol/L葡萄糖+200 μmol/L oleate+200 μmol/L palmitate(HG+Ole+Pal);3)高糖高脂组+ NaHS(HG+Ole+Pal+NaHS):100 μmol/L的NaHS;4)高糖高脂组+100 μmol/L NAC;5)高糖高脂组+DJ-1-siRNA: 将转染试剂lipofectamine 3000和 DJ-1 siRNA孵育20 min以形成复合物,然后将其加入细胞中, DJ-1 siRNA处理H9C2细胞48 h。
1.2.6 Mito-Tracker Green检测线粒体的形态: Mito Tracker Green是一种用于检测活细胞线粒体的特异性绿色荧光探针。将细胞接种于24孔板并进行加药处理,PBS清洗细胞3次,加入无血清DMEM稀释的MitoTracker Green染液(200 nmol/L),在37 ℃下避光孵育 30~40 min。PBS洗3次,使用荧光显微镜观察各组细胞线粒体的形态。
1.2.7 Western blot检测蛋白质表达: 加药处理 H9C2细胞后,PBS洗2次,加入1 mL PBS将细胞收集于1.5 mL EP管中,在4 ℃,3 000 r/min离心10 min,弃上清,在细胞沉淀物中加入Western blot及IP裂解液(含1% PMSF),充分裂解细胞30 min。在4 ℃,12 500 r/min离心30 min,将上清蛋白转移至新EP管中。取少量上清液使用BCA蛋白定量方法检测蛋白的浓度,其余加入相应体积的蛋白上样缓冲液,100 ℃蛋白变性5~10 min,-80 ℃保存备用。
1.2.8 细胞线粒体蛋白的提取: PBS清洗已加药的细胞2次,用细胞刮刀刮取细胞,并吸取至EP管中,按细胞线粒体分离试剂盒方法提取细胞线粒体蛋白,之后使用BCA测定法检测蛋白浓度,如上述方法处理蛋白并保存。
1.3 统计学分析
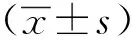
2 结果
2.1 硫氢化钠对db/db小鼠心功能的影响
与野生型(WT) 及野生型给药组(WT+NaHS)小鼠相比,db/db小鼠的射血分数(EF),短轴缩短率(FS)和左心室舒张末期容积(LV Vol)降低,但db/db小鼠的左心室质量(LV mass)明显增加(P<0.01)(表1)。与db/db组相比,NaHS给药组能改善上述指标(P<0.01)。
表1 心动超声检测小鼠心脏功能Table 1 The cardiac function of mice was examined by
2.2 db/db 小鼠心肌组织CSE表达及H2S水平变化
与野生型组小鼠相比,db/db 小鼠心肌组织中的H2S 含量和 CSE 的表达明显降低,给予NaHS 12周后心肌组织中H2S 含量和CSE表达明显高于 db/db 小鼠(图1A, B)。NaHS可以恢复db/db小鼠的H2S含量以及CSE蛋白的表达(P<0.05)。

A.the content of H2S was detected with H2S probe; B.Western blot analyzed the expression of CSE;*P<0.05 compared with WT group;#P<0.05 compared with db/db group.
图 1 小鼠心肌组织中 H2S的含量和CSE表达水平
Fig 1 H2S level and CSE expression in mouse cardiac tissues(n=4)
2.3.硫氢化钠对db/db小鼠心肌组织超微结构和心肌组织中线粒体分裂蛋白的影响
野生型组肌丝排列整齐,细胞内基本没有脂滴,线粒体形态正常;db/db小鼠心肌组织中肌丝紊乱,细胞内脂滴大小及数量均明显增加,线粒体发生肿胀,线粒体面积明显减小,数目明显增加。 db/db+NaHS 给药组小鼠心肌组织肌丝排列较整齐,胞内脂滴的大小和数量明显减少,线粒体形态和数目较为正常(图2A)。
与野生型组相比,db/db小鼠心肌组织中线粒体分裂蛋白1(mitochondrial fission protein 1, Fis1)表达升高,线粒体融合蛋白2( mitochondrial fusion protein 2,Mfn2)的表达下降。而给予NaHS处理后降低Fis1表达,增加Mfn2的表达(图2B)。与正常对照组相比,HG+Pal+Ole组中Fis1表达升高,Mfn2的表达下降(P<0.01)。而给予NaHS及NAC处理后降低Fis1表达,增加Mfn2的表达(图2C)。
2.4 硫氢化钠和DJ-1 siRNA抑制高糖高脂诱发线粒体分裂的发生
DJ-1具有分子伴侣作用,降低线粒体ROS的产生。在神经元中证实DJ-1可抑制线粒体分裂。与正常对照组相比,HG+Pal+Ole组中DJ-1表达降低,NaHS增加DJ-1蛋白水平(图3A)。DJ-1 siRNA转染72 h后,DJ-1的表达明显降低(图3B), 转染 siRNA 对照载体,高脂组线粒体(直径<2 μm,即线粒体分裂)增多,明显多于NaHS给药组(图3C);转染DJ-1 siRNA载体后,给予高糖高脂及NaHS后,线粒体分裂没有明显变化。

A.the expression of DJ-1 in H9C2 was examined by Western blot; B.after siRNA transfection, the expression of DJ-1 was detected Western blot; C.after DJ-1 siRNA transfection, mitochondrial fission was tested by Mitotracker;*P<0.01,**P<0.001 compared with control;#P<0.05, ##P<0.001 compared with HG+Ole+Pal.
在高糖高脂处理H9C2细胞,并给予NaHS 24 h后,转染DJ-1 siRNA对照,Western blot结果显示,在高糖高脂组,Fis1的表达明显高于NaHS及正常对照组。然而在高糖高脂组Mfn2的表达明显低于NaHS组及正常对照组(P<0.05)。DJ-1 siRNA转染H9C2细胞72 h后,检测Fis1和Mfn2的表达,各组间的表达没有明显差异(图4)。
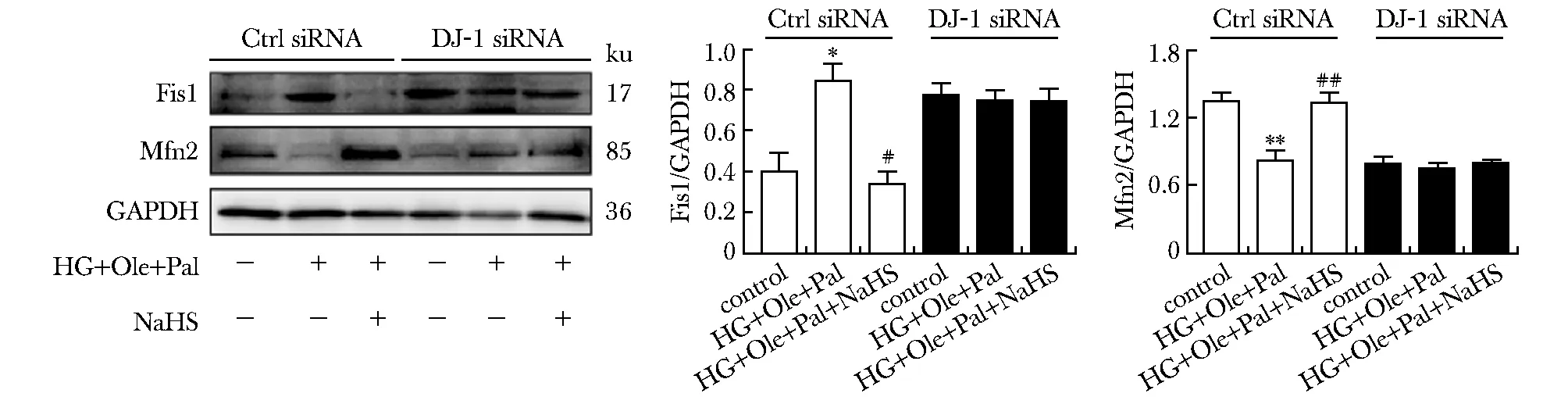
*P<0.05,**P<0.001 compared with control; #P<0.05, ##P<0.001 compared with HG+Ole+Pal.
3 讨论
糖尿病心肌病的发病机制与高血糖和脂质积累引起氧化应激增加、钙超载、线粒体功能障碍、肾素-血管紧张素系统激活等密切相关[7-8]。氧化应激一旦发生,就会形成一个恶性的自我维持的循环,产生更多的活性氧对细胞内多种成分造成破坏作用。
线粒体被认为是ROS的主要细胞内来源,其结构和功能易受到ROS的破坏,引起细胞死亡。线粒体是双层膜的亚细胞细胞器,具有多种代谢功能,包括通过氧化磷酸化产生能量。线粒体的分裂和融合过程都是由鸟苷三磷酸酶(GTPases)介导的[7-8]。通过融合和分裂,线粒体共享膜、代谢物和蛋白质,以及电化学梯度,促进它们电耦合。线粒体融合的增加伴随着分裂被认为是在发育、细胞周期或在各种细胞毒性条件下对抗氧化应激的一种保护机制。然而,氧化应激可导致线粒体过度分裂,从而导致线粒体功能障碍[11]。Fis1蛋白通过C端跨膜结构域定位于线粒体外膜。有研究表明,Fis1过表达可以诱导线粒体分裂,部分胞质中Drp1通过与Fis1相互作用从而被募集到线粒体中。Mfn2定位于线粒体外膜,介导线粒体融合[12-14]。DJ-1是一种帕金森相关蛋白,其表达增多或缺失,可引起细胞死亡。在生理条件下,DJ-1位于胞质和细胞核内;在氧化应激状态下,DJ-1可从胞质转位到线粒体上,参与线粒体的融合分裂[7,15]。本实验研究结果显示,与对照组相比,db/db小鼠心肌组织中Fis1的表达增加,Mfn2表达减少。
H2S通过与各种氧化剂的直接化学反应,以及通过激活谷氨酰胺半胱氨酸合成酶提高细胞内谷胱甘肽水平、细胞内caspase和激酶通路的调节、刺激环腺苷酸的产生、调节细胞内钙离子水平同时打开钾依赖ATP通道,发挥抗氧化作用[4]。本实验给予NaHS处理,作为外源性H2S供体,可以明显提高db/db小鼠心肌组织中H2S含量,显著改善db/db小鼠的心功能和心肌结构及线粒体形态,同时可以减少线粒体分裂。因此,硫氢化钠可能通过促进DJ-1的表达抑制线粒体分裂,促进了线粒体融合,减轻心肌细胞线粒体损伤。
