过表达APMAP减轻阿霉素肾病肾小球足细胞损伤
2023-12-11吴静漪范文静严冬华
吴静漪,范文静,严冬华
江苏盛泽医院 1.儿科;2.普外科,江苏 苏州 215228
慢性肾脏病(chronic kidney disease,CKD)是一类由多种病因引起的肾脏疾病,常表现为肾损伤,主要特征为蛋白尿[1]。既往研究常以阿霉素(adriamycin,ADR)诱导啮齿动物模拟CKD发病,发现肾小球足细胞在CKD进展中发挥重要作用[2],但机制有待探讨。脂肪细胞膜相关蛋白质(adipocyte plasma membrane-associated protein,APMAP)是一种新型整合膜蛋白,在肝脏、胎盘和肾脏中含量最高[3],参与多种生物学过程,包括脂肪细胞分化、肿瘤转移、炎性反应和β-淀粉样蛋白生成[4]。在成熟脂肪细胞中抑制APMAP表达可激活NF-κB炎性反应通路,可能参与糖尿病的调控[5]。然而,目前暂不明确APMAP在CKD发生发展中的作用。故本研究拟采用ADR构建阿霉素肾病模型,探讨APMAP在阿霉素肾病肾小球足细胞损伤中的分子机制,以期为研究CKD靶向药物提供潜在靶点。
1 材料与方法
1.1 材料
实验动物、细胞及主要试剂:SPF级SD大鼠30只,雄性,8周龄,体质量300~350 g [湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2021-0002]。鼠源肾小球足细胞系MPC-5(安徽巨洲生物科技有限公司);ADR、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒和CCK-8试剂盒(北京百奥莱博科技有限公司);核因子-κB(nuclear factor-κB,NF-κB)信号通路激活剂CU-T12-9(MedChemExpress公司);胎牛血清、DMEM培养基和胰蛋白酶(Gibco公司);IL-1β、IL-6和TNF-α ELISA试剂盒、BCA蛋白定量检测试剂盒(武汉菲恩生物科技有限公司);APMAP过表达慢病毒(pCMV-MCS-APMAP)及其对照空载慢病毒(pCMV6-MCS-Vector)(上海汉恒生物技术有限公司),其慢病毒滴度均为1.5×108TU/mL;Nephrin 抗体、APMAP抗体、NF-κB p65抗体、TNF-α抗体和GAPDH抗体(Abcam公司);p-NF-κB p65抗体(Santa Cruze公司);First Strand cDNA Synthesis Kit(武汉塞维尔生物科技有限公司);实时荧光定量PCR(qRT-PCR)试剂盒(Takara公司);annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司)。
1.2 实验方法
1.2.1 大鼠的分组:将大鼠随机分为正常组(n=15)和模型组(n=15)。模型组尾静脉注射5 mg/kg ADR构建阿霉素肾病模型[6],而正常组注射等体积0.9%氯化钠溶液。饲养期间观察、记录大鼠一般状态及死亡情况。收集大鼠24 h尿液。饲养35 d后采腹主动脉血,分离血清冻存备用;留取大鼠肾脏组织于4%多聚甲醛中浸泡固定。
1.2.2 尿蛋白含量及血清生化指标的检测:全自动生化仪检测各组大鼠尿液中尿蛋白和血清中总蛋白(total protein,TP)、白蛋白(albumin,ALB)、血尿素氮(blood urea nireogen,BUN)、血肌酐(serum creatinine,Scr)、总胆固醇(total cholesterol,TC)和三酰甘油(triglyceride,TG)水平。
1.2.3 HE染色检测肾组织病理学:将已固定24 h的大鼠肾组织进行常规制片,苏木精-伊红染色,脱水封片,于400倍镜下观察肾小球损伤情况。
1.2.4 免疫组织化学染色检测肾组织中APMAP和NF-κB p65表达:将肾组织石蜡切片脱蜡至水,进行抗原修复,3%双氧水溶液阻断内源性过氧化物酶,血清封闭,分别滴加一抗APMAP(1∶200)和NF-κB p65(1∶100),将切片平放于4 ℃湿盒内孵育过夜。滴加与一抗相应种属的二抗覆盖组织,室温孵育30 min,进行 DAB显色,流水冲洗切片终止显色,复染细胞核,脱水封片。阳性染色为棕黄色,随机选取5个视野进行免疫组化阳性信号分析,分别计算各组肾组织中APMAP和NF-κB p65平均阳性表达率。
1.2.5 免疫荧光检测肾组织中APMAP和Nephrin定位情况: 将已脱蜡至水的石蜡切片进行抗原修复,血清封闭,加一抗APMAP(1∶200)和Nephrin(1∶500)于4 ℃孵育过夜,加荧光素标记的二抗(1∶500)室温孵育50 min,DAPI复染细胞核,自发荧光淬灭,封片。红色荧光为APMAP,绿色荧光为Nephrin,使用荧光显微镜观察肾组织APMAP和Nephrin定位情况。
1.2.6 细胞的培养及慢病毒感染:将鼠源肾小球足细胞系MPC-5培养于含 10% 胎牛血清、1%双抗的DMEM 培养基中,置于37 ℃、5% CO2的培养箱中培养。观察细胞增殖状态,当细胞汇合度达到80%~90%时,进行传代培养。取对数增殖期MPC-5细胞培养于6孔板中,将携带pCMV-MCS-APMAP质粒的重组慢病毒载体(pCMV-APMAP)及其对照载体(pCMV6-MCS-Vector)按照感染复数为100对体外培养的MPC-5细胞进行慢病毒感染,并将细胞分为Vector组和pCMV-APMAP组,另设空白(blank)组。感染6 h后更换新鲜培养基,继续培养48 h。qRT-PCR和Western blot法检测感染后MPC-5细胞中APMAP mRNA和蛋白表达水平,验证感染效率。取对数增殖期MPC-5细胞,待细胞增殖至70%汇合度时,采用0.5 μmol/L ADR处理24 h构建足细胞损伤模型[7]。将MPC-5细胞分成:1)对照(control)组:正常培养;2)ADR组:用0.5 μmol/L ADR处理;3)ADR+vector组:MPC-5细胞感染慢病毒后,再经ADR处理;4)ADR+pCMV-APMAP组:感染慢病毒后,再经ADR处理;5)ADR+pCMV-APMAP+CU-T12-9组:感染慢病毒后,再经ADR和5 μmol/L CU-T12-9处理24 h。
1.2.7 qRT-PCR检测APMAPmRNA:收集感染慢病毒后的各组细胞沉淀,提取各组细胞中的总RNA,测定总RNA浓度及纯度。按照First Strand cDNA Synthesis Kit说明书步骤,将总RNA反转录成cDNA,然后将cDNA作为模板,GAPDH作为内参,按照qRT-PCR试剂盒说明书进行两步法PCR扩增。扩增参数如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。采用2-ΔΔCt法计算APMAPmRNA相对表达量。引物序列如下,APMAP引物F:5′-CTGTCCTCCGAGACAC CCAT-3′,R:5′-ACTTCCCTGGTCAGTATCAT-3′;GAPDH引物F:5′-TGACTTCAACAGCGACACCCA-3′,R:5′-CACCCTGTTGCTGTAGCCAAA-3′。
1.2.8 CCK-8检测细胞增殖活性:取对数增殖期MPC-5细胞,调整细胞约2×103个/孔细胞接种至96孔板中,同时设置调零孔(培养基对照),每组3个复孔。分组处理后,提前4 h向每孔中加入10 μL CCK-8溶液。孵育结束后,用酶标仪测定在450 nm处的吸光度值(absorbance,A)。细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.2.9 流式细胞术检测细胞凋亡率:收集各组细胞,将5×105个/mL的细胞制成悬液,取1 mL悬液,1 000 r/min离心5 min,弃上清,加入 195 μL结合液重悬细胞,再依次加入 5 μL annexin V-FITC和10 μL碘化丙啶染色液混匀,室温避光孵育15 min,立即进行流式细胞仪检测。
1.2.10 ELISA检测LDH活性及IL-1β、IL-6和TNF-α含量:取大鼠血清及各组细胞上清液,按照试剂盒说明书进行操作,采用酶标仪测定各孔A值,根据标准曲线计算LDH活性及IL-1β、IL-6和TNF-α含量。
1.2.11 Western blot检测蛋白质表达:收集细胞沉淀,提取细胞总蛋白,采用BCA法测定蛋白浓度。取30 μg总蛋白经煮沸变性,进行10% SDS-PAGE凝胶电泳,将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗涤3次,加入一抗APMAP抗体(1∶1 000)、NF-κB p65抗体(1∶1 000)、p-NF-κB p65抗体(1∶1 000)、TNF-α抗体(1∶1 000)和GAPDH(1∶1 000)抗体稀释缓冲液,于4 ℃孵育过夜。TBST洗涤3次,加入辣酸根过氧化物酶(HRP)标记IgG二抗(1∶10 000)室温孵育1 h,TBST洗涤3次,滴加ECL混合溶液进行显影、定影。使用Alpha软件处理系统分析目标带的A值,计算目的蛋白的相对表达量=目的蛋白的A值/内参蛋白的A值。
1.3 统计学分析
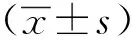
2 结果
2.1 各组大鼠状态及死亡情况
正常组大鼠状态正常,动作敏捷且活跃,毛色柔顺光滑,粪便成形,垫料干燥,实验期间无死亡。而模型组大鼠自造模第14天时,开始毛色灰黄、杂乱无章, 精神萎靡,饮食减少,粪便不成形,垫料潮湿,实验期间出现5只死亡。
2.2 各组大鼠24 h尿蛋白、血清生化指标及炎性因子变化
第14、21、28、35 天时,模型组大鼠24 h尿蛋白含量较正常组显著升高(P<0.01)(表1)。与正常组比较,模型组大鼠血清中BUN、Scr、TC和TG含量显著升高(P<0.001),ALB含量显著降低(P<0.01)(表2)。与正常组比较,模型组大鼠血清中IL-1β、IL-6和TNF-α含量显著升高(P<0.01)(表3)。

表1 各组大鼠尿蛋白含量

表2 各组大鼠血清生化指标变化Table 2 Changes of serum biochemical indexes of rats in each
表3 各组大鼠血清中炎性细胞因子水平Table 3 Serum levels of inflammatory cytokines in each pg/mL)
2.3 各组大鼠肾组织病理学变化及APMAP、NF-κB p65蛋白表达
正常组大鼠肾小管、肾小球和肾小囊形态、结构正常;模型组大鼠肾小球球囊萎缩,肾小管呈蛋白管型,说明阿霉素引起肾损伤(图1)。与正常组比较,模型组大鼠肾组织中APMAP蛋白表达阳性率显著降低(P<0.01),而NF-κB p65蛋白表达阳性率显著升高(P<0.01)(图2)。
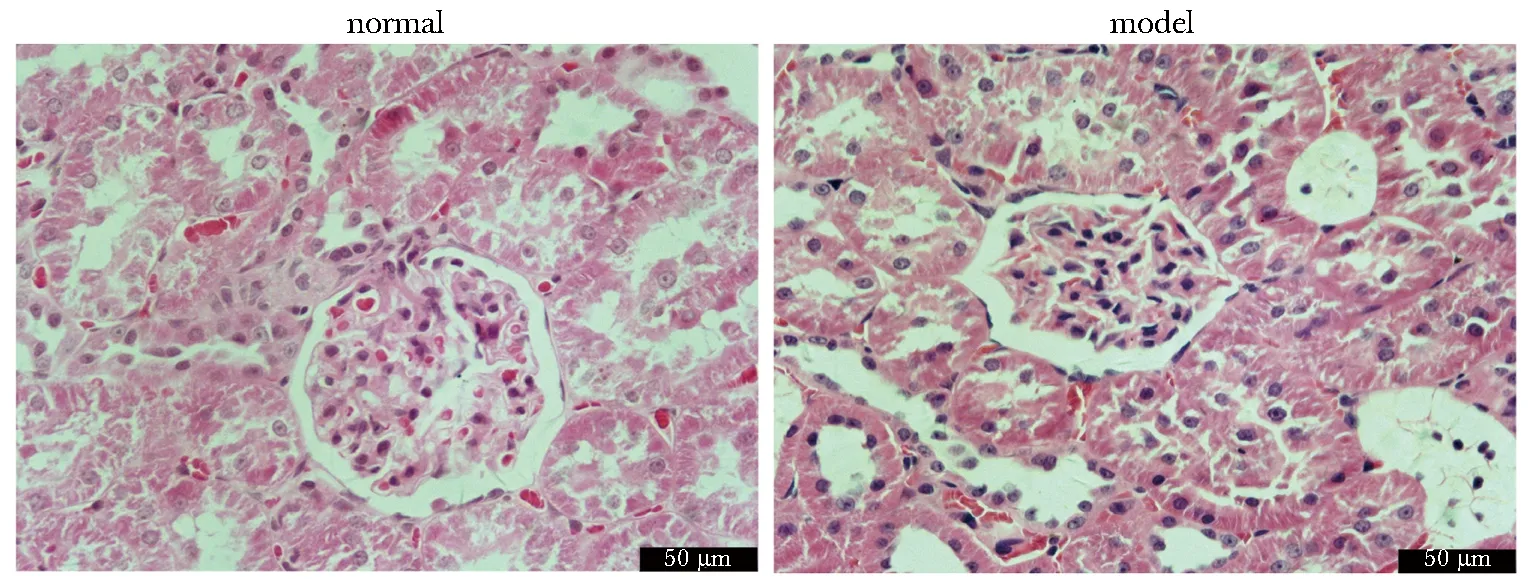
图1 肾组织病理学变化Fig 1 Histopathological changes of kidney (HE, ×400)
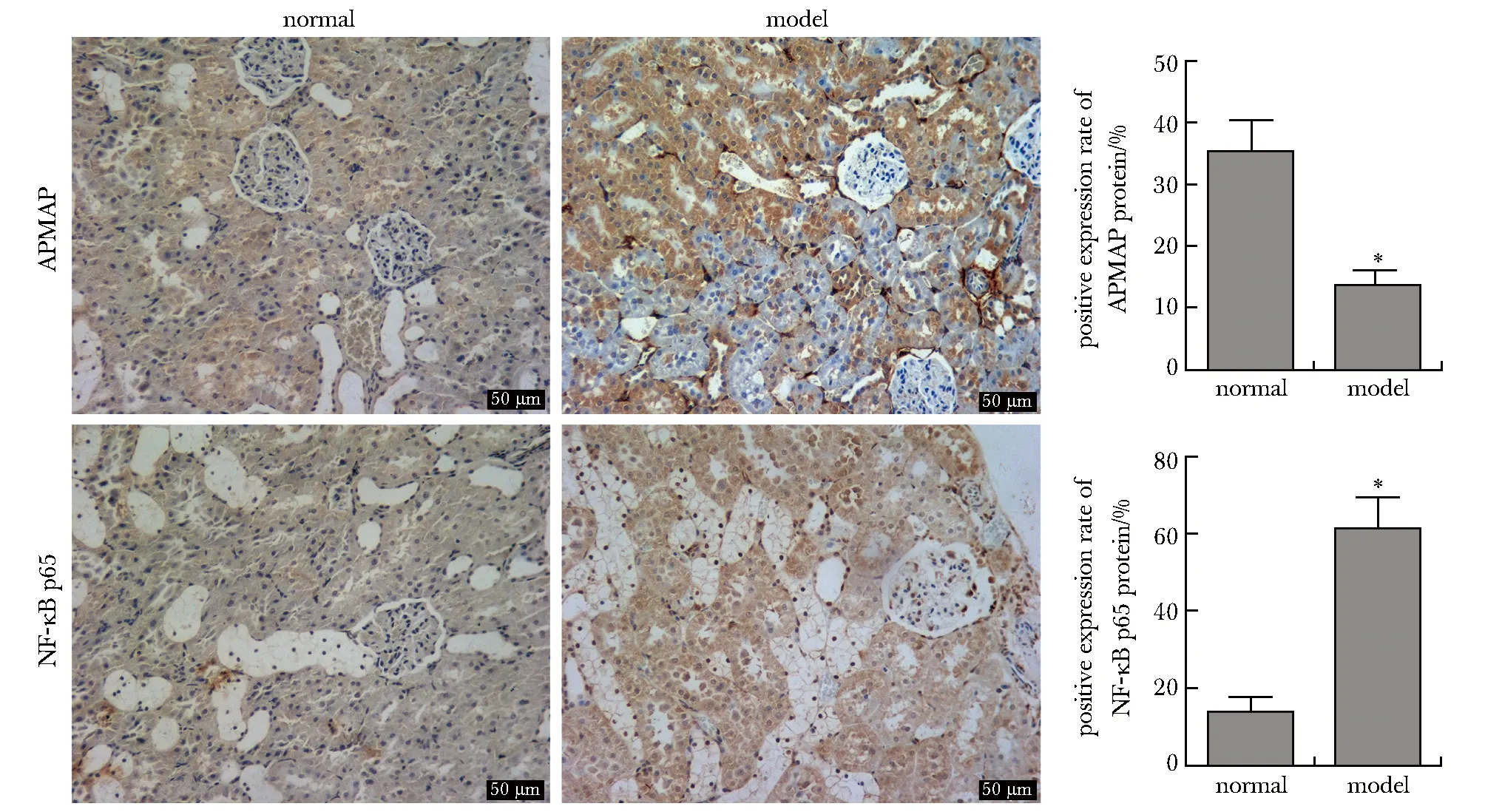
*P<0.001 compared with normal group.
2.4 各组大鼠肾组织APMAP和Nephrin定位
APMAP蛋白在大鼠肾小管和肾小球中均有表达,而Nephrin呈串珠样连续性均匀分布于肾小球;与对照组比较,模型组大鼠肾小球中APMAP蛋白荧光减弱,Nephrin呈不连续分布(图3)。
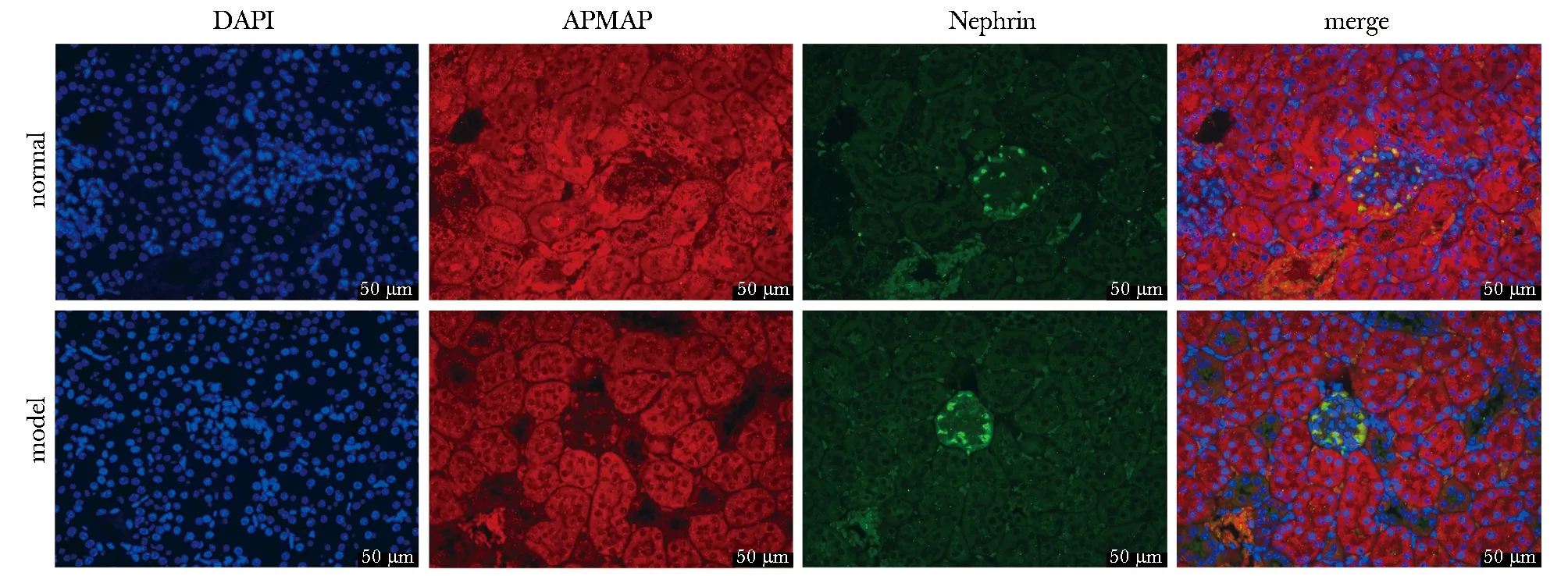
图3 各组大鼠肾组织APMAP和Nephrin定位情况Fig 3 Location of APMAP and Nephrin in renal tissue of rats in each group(IF,×200)
2.5 APMAP过表达对ADR暴露下MPC-5细胞增殖活性的影响
与空白组或vector组比较,pCMV-APMAP组MPC-5细胞中APMAP mRNA和蛋白表达水平显著升高(P<0.01)(图4A,B)。与对照组比较,ADR组MPC-5细胞增殖活性显著降低(P<0.001);与ADR组比较,ADR+ pCMV-APMAP组MPC-5细胞增殖活性显著升高(P<0.001);与ADR+pCMV-APMAP组比较,ADR+pCMV-APMAP+CU-T12-9组MPC-5细胞存活率显著降低(P<0.001)(图4C)。
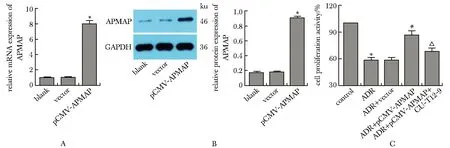
A.APMAP mRNA expression in MPC-5 cells after infection; B.APMAP protein expression in MPC-5 cells after infection; C.cell proliferation activity in each group.*P<0.001 compared with vector group/control group; #P<0.001 compared with ADR group; △P<0.001 compared with ADR+ pCMV-APMAP group.
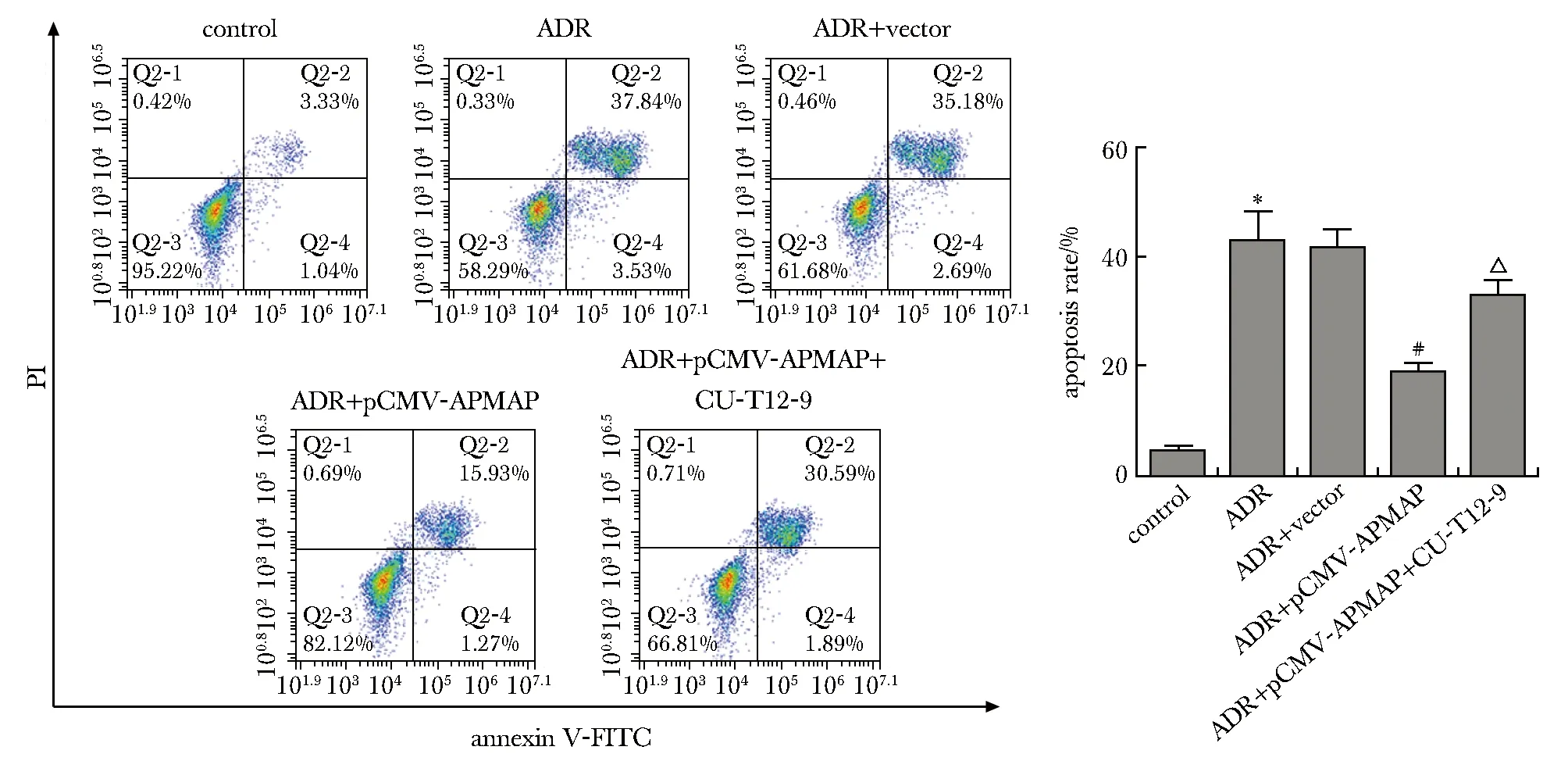
*P<0.001 compared with control group; #P<0.001 compared with ADR group; △P<0.05 compared with ADR+pCMV-APMAP group.
2.6 APMAP过表达对ADR暴露下MPC-5细胞LDH活性及IL-1β、IL-6和TNF-α含量的影响
与对照组比较,ADR组MPC-5细胞中LDH活性及IL-1β、IL-6和TNF-α含量显著升高(P<0.001);与ADR组比较,ADR+pCMV-APMAP组MPC-5细胞中LDH活性及IL-1β、IL-6和TNF-α含量显著降低(P<0.001);与ADR+pCMV-APMAP组比较,ADR+pCMV-APMAP+CU-T12-9组MPC-5细胞中LDH活性及IL-1β、IL-6和TNF-α含量显著升高(P<0.05)(表4)。
表4 各组细胞LDH活性及IL-1β、IL-6和TNF-α含量Table 4 LDH activity and contents of IL-1β, IL-6 and TNF-α of cells in each n=3)
2.7 APMAP过表达对ADR暴露下MPC-5细胞凋亡率的影响
与对照组比较,ADR组MPC-5细胞凋亡率显著升高(P<0.001);与ADR组比较,ADR+pCMV-APMAP组MPC-5细胞凋亡率显著降低(P<0.001);与ADR+pCMV-APMAP组比较,ADR+pCMV-APMAP+CU-T12-9组MPC-5细胞凋亡率显著升高(P<0.05)(图5)。
2.8 APMAP过表达对ADR暴露下MPC-5细胞中NF-κB通路蛋白表达影响
与对照组比较,ADR组细胞NF-κB p65、p-NF-κB p65、TNF-α、p-NF-κB p65/NF-κB p65蛋白表达水平显著升高(P<0.05);与ADR组比较,ADR+pCMV-APMAP组细胞NF-κB p65、p-NF-κB p65、TNF-α、p-NF-κB p65/NF-κB p65蛋白表达水平显著降低(P<0.01);与ADR+pCMV-APMAP组比较,ADR+pCMV-APMAP+CU-T12-9组细胞NF-κB p65、p-NF-κB p65、TNF-α、p-NF-κB p65/NF-κB p65蛋白表达水平显著升高(P<0.01)(图6)。

*P<0.001 compared with control group; #P<0.01, ##P<0.001 compared with ADR group; △P<0.001 compared with ADR+ pCMV-APMAP group.
3 讨论
CKD已经成为全球性公共健康问题,其患病率和病死率高。目前大多数慢性肾病难以根治,主要采取的治疗方式为控制并发症和延缓疾病进展,避免进入尿毒症期[7]。寻找新的治疗靶点为CKD患者选择最佳的治疗方法有重要的研究价值。慢性炎性反应、氧化应激、缺氧和衰老在CKD进展和病理生理学中起关键作用[8]。足细胞损伤是导致蛋白尿的主要因素[9]。体内实验结果发现,ADR可引起大鼠体内炎性细胞因子爆发,导致蛋白、脂质、 脂酸等代谢紊乱,肾组织损伤,出现蛋白尿症状,与报道[10]一致。体外实验结果发现,ADR引起肾小球足细胞LDH活性、炎性细胞因子IL-1β、IL-6、TNF-α表达及细胞凋亡水平升高,细胞存活率降低,证实足细胞损伤可能与炎性反应和细胞凋亡有关。
本研究发现,ADR肾病大鼠肾组织 APMAP 低表达,经 APMAP 和Nephrin共定位后,证明肾小球足细胞上的APMAP表达在CKD中发生改变。APMAP可介导NF-κB信号通路调节炎性反应[11]。同时,APMAP具有抑制细胞增殖,诱导细胞凋亡作用[12]。本研究采用pCMV-MCS-APMAP感染MPC-5细胞,结果发现过表达 APMAP可有效抑制足细胞损伤引起的凋亡和炎性反应,提高足细胞存活率,与上述研究[10-11]结果一致。提示APMAP过表达对足细胞损伤有治疗作用。
体内外实验发现,ADR干预下肾组织及肾小球足细胞中NF-κB p65高表达。足细胞损伤可激活NF-κB 信号通路,加重炎性反应和细胞凋亡[13]。本研究发现,过表达APMAP可下调ADR处理的MPC-5细胞中NF-κB信号通路相关蛋白。本研究采用NF-κB信号通路激活剂CU-T12-9进行联合干预,结果显示CU-T12-9显著升高NF-κB p65激活水平,从而抑制APMAP过表达对肾小球足细胞损伤的改善作用,证实APMAP可能是通过抑制NF-κB 信号通路的激活而降低肾小球足细胞炎性反应和凋亡。
综上所述,过表达APMAP可抑制ADR诱导的肾小球足细胞损伤,其作用机制可能与抑制NF-κB信号通路激活有关。本研究阐明APMAP在阿霉素肾病肾小球足细胞损伤中的作用,为临床寻找新的CKD的防治提供一些理论依据。
