多肽Apelin减轻高糖诱导的肾脏足细胞损伤
2023-12-11王丽妍刁宗礼黄红东刘文虎
王丽妍,安 菲,刁宗礼,黄红东,刘文虎
首都医科大学附属北京友谊医院 肾内科,北京 100050
糖尿病肾病是导致终末期肾病的重要病因[1]。肾脏足细胞损伤是糖尿病肾病的核心病理环节,而线粒体功能异常被视为其始动因素[2]。FUN14结构域蛋白1(FUN14 domain-containing protein 1, FUNDC1)作为新发现的线粒体膜蛋白,参与线粒体自噬和动力学的调节[3]。多肽Apelin通过与其G蛋白偶联受体APJ结合,维持肾脏的正常生理功能,并能在急性肾损伤时保护肾小管上皮细胞的线粒体[4]。对于以能量代谢失调为重要病理机制的糖尿病肾病,Apelin对其主要损伤部位——足细胞线粒体,具有怎样的调控作用,目前尚存在争议。本课题采用高糖刺激体外培养的足细胞模型,围绕Apelin/APJ受体—FUNDC1相关信号通路,检测其对线粒体稳态的影响;采用链脲佐菌素(streptozotocin,STZ)诱导小鼠糖尿病模型,外源性补充Apelin,检测肾脏结构和功能的改变。该研究为探索糖尿病肾病的新治疗靶点提供理论基础和实验依据。
1 材料与方法
1.1 材料
1.1.1 试剂:Apelin-13(Bachem公司)、鼠抗人DPR1抗体(Abcam公司)、兔抗人FUNDC1抗体(CST公司)、辣根过氧化物酶标记IgG抗体(中杉金桥生物技术有限公司)、IP蛋白抽提试剂(天德悦生物科技有限公司)、TUNEL细胞凋亡检测试剂盒(碧云天生物技术有限公司)、ELISA试剂盒(南京建成生物工程公司)。
1.1.2 细胞及动物:人足细胞系(武汉普诺赛生命科技有限公司),SPF级8周龄雄性C57BL/6J小鼠,体质量(23±2)g,(中国医学科学院实验动物研究所)。
1.2 方法
1.2.1 细胞和动物的分组及处理:细胞分为对照组(control)、高糖(HG)组(葡萄糖25 mmol/L, 48 h)、Apelin干预HG组(Apelin-13 1 μmol/L, 48 h)和Apelin组(Apelin-13 1 μmol/L, 48 h);刺激结束后收集各组细胞用于检测。小鼠分为对照组(control)、糖尿病组(DM,一次性腹腔注射链脲佐菌素150 mg/kg)以及Apelin干预DM组(建模成功后,每日腹腔注射Apelin-13, 0.3 μmol/kg),每组5只小鼠,共干预6周;实验结束时留取血液和尿液标本,给予腹腔注射戊巴比妥钠(50 mg/kg)麻醉后将小鼠处死,取肾脏标本用于检测(图1)。

图1 动物实验路线图Fig 1 The schematic diagram of mice experiment
1.2.2 TUNEL染色观察细胞凋亡:用PBS洗涤各组细胞,多聚甲醛室温下固定30 min。用Triton X-100室温孵育5 min,PBS洗涤。加入50 μL TUNEL检测液,37 ℃避光孵育60 min,PBS洗涤。加入少量DAPI染色液,室温放置3-5 min,PBS洗涤。封片液封片,荧光显微镜下观察。
1.2.3 Western blot法检测细胞线粒体蛋白的表达:用冷的PBS洗涤细胞,加入组织裂解液,于4 ℃、12 000 ×g离心30 min,BCA法测定蛋白含量。取100 μg蛋白行12% SDS-PAGE电泳,随后转移至PVDF膜上,再用5% BSA-PBST封闭1 h。加入兔抗人FUNDC1抗体(1∶500),于4 ℃孵育过夜,再用辣根过氧化物酶标记的二抗(1∶3 000)于室温孵育1 h。洗膜后用ECL法显色并曝光成像,应用凝胶成像系统软件对特异性条带做吸光度定量,以电压依赖性阴离子通道蛋白(VDAC)作内参,分析目的蛋白的相对表达量。
1.2.4 免疫共沉淀测定细胞FUNDC1与DRP1的相互作用:PBS洗涤细胞,加入蛋白裂解液,4 ℃、14 000 ×g离心15 min,吸取上清至新的EP管。总蛋白稀释至2 mg/mL,将FUNDC1抗体加入到500 μL总蛋白中,并设阴性对照,4 ℃孵育过夜,使FUNDC1和其特异性抗体结合。在蛋白样品中加入50% protein G-Agarose悬液100 μL捕捉抗原抗体复合物,4 ℃孵育3 h,使FUNDC1抗体与protein G-Agarose结合。孵育完成后,4 ℃、1 500×g离心3 min,弃去上清,用预冷的PBS清洗沉淀,4 ℃、1 500×g离心3 min,收集沉淀,即为protein G-Agarose-抗体-蛋白复合物。用上样缓冲液将复合物悬起、混匀,沸水煮5 min使其分离为单个蛋白,4 ℃、500×g离心3 min,吸取上清得到目的蛋白溶液,进一步用Western blot法检测DRP1的表达量。
1.2.5 小鼠肾脏形态结构的观察:取肾脏标本于4%多聚甲醛中固定,乙醇脱水,石蜡包埋、切片,行PAS染色,光镜下观赏肾小球形态。另取部分肾脏标本于2.5%戊二醛中固定,丙酮脱水,环氧树脂包埋、切片,透射电镜下观察肾小球足细胞结构。
1.2.6 ELISA法检测小鼠血浆和尿液标志物的含量:取血液标本,置于EDTA抗凝的真空采血管内,代谢笼收集小鼠尿液标本。分别于4 000×g离心15 min,收集上清液,置于-80 ℃冰箱中保存。用ELISA试剂盒按说明书检测小鼠血糖(glucose,Glu)、血浆肌酐(creatinine,Cr)、尿素氮(urea nitrogen),以及尿液肌酐、白蛋白的含量。
1.3 统计学分析
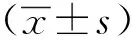
2 结果
2.1 Apelin抑制高糖诱导的足细胞凋亡
与对照组相比,高糖组每高倍视野(high power field, HPF)TUNEL染色阳性的细胞数量增多,提示足细胞凋亡水平增加;与高糖组相比,Apelin干预HG组TUNEL染色阳性的细胞数量有所减少,提示足细胞凋亡水平降低(P<0.05);而Apelin组细胞凋亡情况和对照组相比无明显差异(图2)。

HG.high glucose; HPF.high power field;*P<0.05 compared with control group; #P<0.05 compared with HG group.
2.2 Apelin改善高糖对足细胞线粒体膜蛋白的影响
高糖刺激48 h,细胞FUNDC1的表达量较对照组明显增加(P<0.05)。而Apelin可以显著抑制高糖上调FUNDC1表达的效应(图3)。FUNDC1进行IP沉淀后,DRP1能检测到阳性条带,证明FUNDC1与DRP1之间存在相互作用。与对照组相比,高糖组FUNDC1与DRP1的结合增强,而Apelin干预HG组共沉淀条带减弱(P<0.05)(图4)。

*P<0.05 compared with control group; #P<0.05 compared with HG group.

1.control group, 2.HG group, 3.HG+Apelin group, 4.Apelin group; *P<0.05 compared with control group; #P<0.05 compared with HG group.
2.3 Apelin改善糖尿病小鼠肾脏的病理形态结构
PAS染色显示,对照组肾脏结构清晰,肾小球和肾小管形态未见明显异常。糖尿病组肾小球系膜细胞增生,系膜基质增多,肾小管可见空泡变性,部分肾小管皱缩。而Apelin干预DM组肾脏病变有所改善,系膜细胞和基质增生减轻,肾小管空泡变性减少,未见明显肾小管皱缩(图5)。电镜显示,对照组肾小球囊清晰,足细胞排列整齐,足突紧贴于基底膜外,结构完整。糖尿病组肾小球囊紊乱,足细胞萎缩、数量减少,足突广泛融合、形态扭曲。而Apelin干预DM组肾小球足细胞的病变程度轻于糖尿病组,可见足细胞的数量有所减少,足突结构尚完整,部分肿胀、融合(图6)。

图5 Apelin对糖尿病小鼠肾组织形态的影响Fig 5 Effect of Apelin on renal histopathological changes in diabetes mice (×400)

图6 Apelin对糖尿病小鼠足细胞形态结构的影响Fig 6 Effect of Apelin on the morphology of podocytes in diabetes mice (×4 000)
2.4 Apelin减轻糖尿病小鼠肾损伤:
糖尿病组小鼠白蛋白/肌酐(ACR)、肌酐(Cr)和尿素氮(BUN)的含量高于对照组(P<0.05);而肌酐清除率(Ccr)低于对照组(P<0.05)。外源性补充Apelin可以使糖尿病小鼠肾损伤得到改善,ACR、Cr和BUN的数值均较糖尿病组显著降低(P<0.05);而Ccr水平显著升高(P<0.05)(表1)。
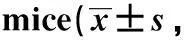
表1 各组小鼠肾损伤标志物的比较Table 1 The level of renal injury biomarkers in each group of n=5)
3 讨论
Apelin是一种生物活性肽,其前体由77个氨基酸组成,被分解后以多种形式的肽片段存在于体内,在疾病状态下Apelin/APJ系统具有双刃剑作用。利用单侧输尿管结扎的小鼠模型,证实Apelin通过抑制肾小管上皮-间充质转化可以减轻肾脏纤维化[5]。对多巴胺能神经元的研究发现,Apelin通过稳定线粒体膜,发挥抗氧化和抗细胞凋亡的作用,对治疗帕金森具有潜在价值[6]。在心血管系统中,Apelin通过诱导线粒体自噬,促进血管平滑肌细胞增殖,从而加速动脉粥样硬化[7]。对糖尿病小鼠的研究显示,Apelin活化ERK、Akt和mTOR等信号通路,抑制足细胞自噬,加重糖尿病肾病[8]。另有研究发现,糖尿病小鼠肾脏APJ和Apelin的mRNA表达下调,外源性补充Apelin通过抑制caspase-3,可以减少足细胞凋亡,缓解糖尿病肾病[9]。上述研究的差异可能与给药剂量或疾病所处的不同阶段有关。但目前的研究均未对损伤的根源——足细胞的线粒体动力学平衡,进行报道。
本研究建立了STZ诱导的糖尿病小鼠模型。通过组织学检测,观察到每日腹腔注射Apelin能够减轻肾脏形态结构的损伤。通过对血浆、尿液标志物的检测,观察到糖尿病组反应肾功能的Ccr下降,而提示肾损伤的Cr、BUN和ACR显著升高,通过外源性补充Apelin能够改善上述指标的变化。因此认为,Apelin在整体水平具有改善糖尿病肾病的生物学效应。
通过高糖刺激体外培养的肾脏足细胞模型,对Apelin保护线粒体的机制进行了初步探讨。目前认为,线粒体是高度动态的细胞器,线粒体动力学紊乱是足细胞损伤的重要机制。有研究发现,高糖刺激下小鼠足细胞碎片状线粒体增多,足突广泛融合[10]。而线粒体内质网偶联与线粒体稳态的调节密切相关,其中信号分子FUNDC1发挥着重要作用,它是一种存在于线粒体外膜与内质网联结处的受体蛋白。正常状态下FUNDC1与线粒体内膜的OPA1结合,使线粒体趋向融合;在应激状态下,FUNDC1与OPA1解离并募集胞质中的DRP1与线粒体结合,进而促进线粒体分裂[11]。本研究观察到,在体外培养的足细胞中加入Apelin,可以抑制高糖上调FUNDC1表达的作用,减少线粒体分裂蛋白DPR1的募集,从而稳定线粒体结构,可能是其减轻高糖诱导足细胞凋亡的机制。
综上所述,多肽Apelin对糖尿病小鼠具有肾脏保护作用,可能是通过调节线粒体膜蛋白FUNDC1的表达量,维持足细胞的线粒体稳态,从而减轻肾脏损伤。本研究仅采用简单的细胞和动物模型无法阐明Apelin/APJ系统在糖尿病肾病中的具体作用,今后需要进一步的分子生物学实验做深入探讨。
