乳酸菌与单增李斯特菌竞争生长机制与建模研究进展
2023-12-11鲁新新李卓思高彬茹潘清逸张晨国张莹芝李胤慷董庆利
鲁新新,李卓思,高彬茹,潘清逸,张晨国,张莹芝,李胤慷,董庆利
(上海理工大学 健康科学与工程学院,上海 200093)
食源性疾病是全球最重要的公共卫生问题之一,导致食源性疾病的有病原微生物、寄生虫及其代谢产物、天然毒素以及化学性有毒有害物质等,其中食源性致病菌引起的食源性疾病是全球食品安全面临的最重要挑战之一。在众多类食源性致病菌中,单核细胞增生性李斯特氏菌(Listeriamonocytogenes,LM),简称单增李斯特菌,能引起人、畜患李斯特菌病,感染后主要表现为败血症、脑膜炎和单核细胞增多等症状,尤其对新生儿、孕妇、老年人及免疫系统缺陷的人群危害严重[1]。2011年美国疾病预防控制中心(CDC)发布单增李斯特菌引发的10多年来最严重的一起食源性疾病暴发事件,共报告72人患病,13人死亡[2]。2014年,丹麦发生单增李斯特菌感染香肠和肉卷事件,导致38人患病,15人死亡[3]。2018年,南非发生全球范围内历史上最大的一次李斯特菌感染事件,造成200多人死亡[4]。我国虽然缺乏较为完整和系统的单增李斯特菌流行病学数据,但每年由该菌引起的食品安全问题不在少数。因此,实施有效抑菌措施去除食品中可能存在的单增李斯特菌,或控制该菌的毒性并降低其感染能力,对食品工业和消费者的安全防控实践意义重大。
随着食品工业科技的不断发展,人们更倾向于绿色、温和、天然环保的抑菌方式,而“生物保护菌”的提出满足了人们的需求。生物保护菌是指添加到食品中具有延长食品货架期和(或)抑制有害微生物生长的活的微生物[8]。乳酸菌(lactic acid bacteria,LAB)因其能够与致病菌竞争营养底物[9],分泌具有抑菌活性的代谢产物(有机酸、细菌素和H2O2等)[10],以及通过微生物群体感应抑制生物膜的形成等机制[11],抑制致病菌生长而成为生物保护菌的一类。笔者课题组前期的研究已证实在卷心菜中添加植物乳杆菌(Lactobacillusplantarum)可以控制单增李斯特菌的生长,其原因是植物乳杆菌与单增李斯特菌竞争营养物质[12]。将乳酸菌应用至食品中控制单增李斯特菌生长的现象可通过两菌交互模型Jameson-effect模型和Lotka-Volterra模型来表示[13-14]。两菌模型能预测两菌在生长过程中的生长参数变化,即定量描述2个种群在同一生长环境下所表现的数量变化规律[15],从而帮助企业确定产品货架期并帮助消费者进行危险分析和关键控制点确定(HACCP)[16]。
基于此,本文综述应用乳酸菌控制单增李斯特菌生长能力的研究成果并阐述乳酸菌抑制单增李斯特菌生长的机制,介绍应用双菌模型描述乳酸菌对单增李斯特菌生长调控中的预测研究进展,以期为今后对两菌进行风险评估以及生物抑菌的应用和研发提供参考。
1 乳酸菌与单增李斯特菌竞争生长的研究进展
1.1 乳酸菌在食品中的应用基础
乳酸菌作为生物保护菌株在食品中控制单增李斯特菌的生长已得到广泛应用。将乳酸菌应用至食品中控制单增李斯特菌的生长应满足以下条件:①选择合适的添加方式,保证其在食品中生长并具有一定的抑菌活性;②根据食品特性选择合适的菌株,添加至食品中的乳酸菌应该符合产品特性,满足消费者口味;③应用至食品中的乳酸菌不能对食品本身产生负面影响,应通过代谢产物区分乳酸菌在食品中是生物保护菌(抑菌代谢产物,如细菌素)还是发酵产物(酸及蛋白水解酶)[14]。为满足以上条件,选择不同乳酸菌菌株添加至不同的食品环境并测定其抑菌活性。因此,接下来重点综述在不同食品环境中应用乳酸菌控制单增李斯特菌的生长性能,并分析乳酸菌对单增李斯特菌的抑菌机制。
1.2 不同食品环境中乳酸菌与单增李斯特菌竞争生长概况
因为单增李斯特菌在肉制品[3-4]、水果[17]及奶制品[5-7]中均有被检出,所以围绕乳酸菌在不同食品环境中对单增李斯特菌生长的影响方面的研究成果较多[18-29](表1)。
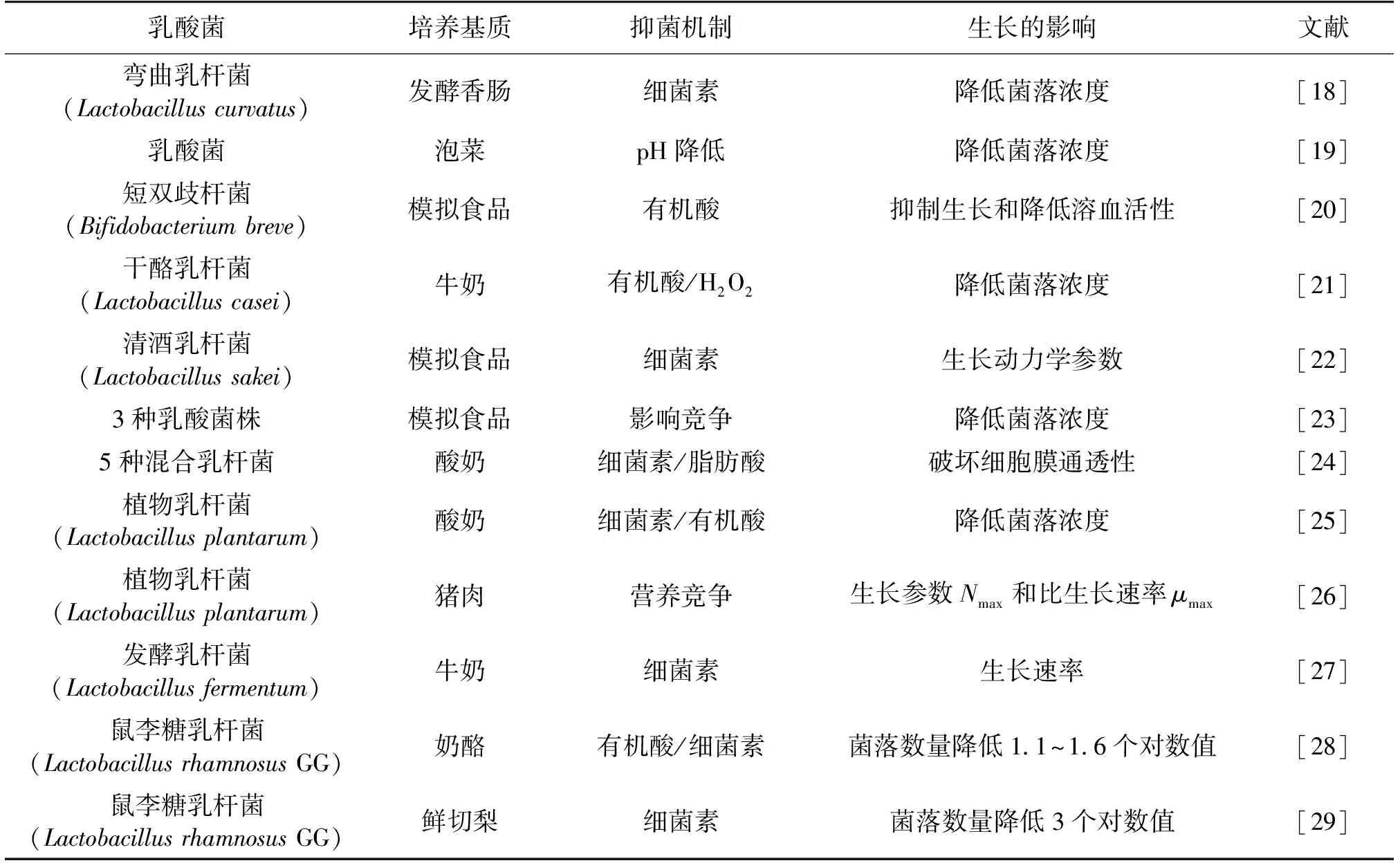
表1 乳酸菌对单增李斯特菌生长影响的研究
虽然将L.curvatus和L.plantarum分别添加至发酵香肠[18]和猪肉[26]中控制单增李斯特菌的生长,将L.rhamnosusGG添加至鲜切梨中[29]或是将L.casei[20]等乳酸菌添加至奶制品中以控制单增李斯特菌的生长,但是,食品本身的特性可能会影响乳酸菌的代谢能力,所以也有很多研究使用营养较为丰富的培养基来开展研究[20],与单增李斯特菌单独生长相比,添加乳酸菌后,单增李斯特菌达到稳定期的最大菌落总数Nmax和(或)生长过程中生长参数最大比生长速率μmax都下降以及迟滞期延长。
1.3 乳酸菌与单增李斯特菌的竞争生长机制分析
乳酸菌抑菌机制的研究也较为深入,乳酸菌对单增李斯特菌的抑菌机制如图1所示,乳酸菌对单增李斯特菌主要抑菌途径是:①通过和目标菌竞争营养底物;②产生有机酸、细菌素、H2O2等抑菌物质进入目标菌细胞后破坏细菌结构,影响其通透性和稳定性,造成细胞质外流,同时可钝化抑制酶活性,干扰细菌DNA合成、RNA转录[30-32]。

图1 乳酸菌对单增李斯特菌抑菌机制
1.3.1 竞争营养底物
乳酸菌对单增李斯特菌的竞争排斥是细菌与细菌之间通过竞争细菌黏附位点或营养来源实现的。如,当乳杆菌与其他微生物共同培养时,与它自身生长相关的碳水化合物和氨基酸代谢过程中的蛋白质会优先表达,这促进乳杆菌生长的同时抑制单增李斯特菌的生长[33]。Nilsson等[34]将栖鱼肉杆菌(Carnobacteriumpiscicola)和单增李斯特菌在模拟食品中进行混合培养、滤膜隔离培养以及二者上清液共同培养后发现,不产细菌素的栖鱼肉杆菌对单增李斯特菌的抑菌机制主要为营养物质的竞争。Yang等[35]分析B.breve和单增李斯特菌在模拟食品中共培养后发现,双歧杆菌中参与蛋白质与核酸生物合成的酶表达量增加,包括转移RNA谷氨酰转移酶和核糖体蛋白,这些酶表达量的增加促进蛋白质翻译,从而促进共培养时双歧杆菌的生长,这使其能与单增李斯特菌竞争营养底物。可见,当乳酸菌与单增李斯特菌处于同一生态系统时会通过竞争共同的营养物质来抑制该致病菌的生长。这是因为当乳酸菌与单增李斯特菌共培养时,乳酸菌中有关细胞分裂、氨基酸代谢、糖代谢和转录的多种酶(蛋白)过度表达,使其自身生长代谢速率加快,与单增李斯特菌竞争底物,从而达到抑制单增李斯特菌生长的目的。然而,由于在真实的生产或食品环境中营养成分大多较为丰富,能满足多种微生物生长的需要,因此,如何将乳酸菌应用到真实生产环境以控制致病菌生长仍需要进行大量研究。
1.3.2 分泌抑菌物质
乳酸菌在自身生长代谢过程中能产生有机酸、H2O2和细菌素等抑菌物质,其中有机酸和细菌素能显著抑制单增李斯特菌生长。如,乳杆菌在代谢过程中消耗糖类物质,产生乳酸和乙酸等有机酸,破坏单增李斯特菌的细胞膜结构,影响其生长[30]。Moradi等[36]发现,乳酸菌能够抑制食品中单增李斯特菌的活性,其抑菌机制是产生的有机酸通过细胞膜间的孔道蛋白进入内质,导致脂多糖羧基化,破坏细胞膜间的通透性。Hossain等[37]也证实,在牛奶中清酒乳杆菌(Lactobacillussakei)及植物乳杆菌无细胞上清液中的有机酸能改变细胞间的渗透压,从而抑制单增李斯特菌的生长。
另外,乳酸菌的产物细菌素具有广谱抑菌性。细菌素有多种分类方式,通常将细菌素分为Ⅰ类羊毛硫抗生素(含羊毛硫氨酸抗生素)和Ⅱ类(Ⅱa、Ⅱb、Ⅱc、和Ⅱd)两大类,其中Ⅱ类细菌素中,由乳酸菌所产生的Pediocin PA-1广谱细菌素对单增李斯特菌表现出较强的抑制活性[38-40]。如,Héchard等[41]证实,乳球菌、片球菌及乳杆菌产生的细菌素能作用于单增李斯特菌的细胞质膜,通过磷脂双分子层孔隙释放质子和细胞内蛋白质,抑制单增李斯特菌的生长。De Castilho等[42]发现,产细菌素的弯曲乳杆菌处理组中的单增李斯特菌菌落数低于不产细菌素弯曲乳杆菌的处理组。与此类似,Acua等[43]发现,乳酸菌产生的细菌素能在脱脂牛奶中抑制单增李斯特菌的生长,而Gómez等[44]研究发现,8种益生菌所产生的细菌素对不同食品基质中的单增李斯特菌均有较好的抑菌效果。
由此可见,乳酸菌通过产生抑菌作用抑制单增李斯特菌的生长,但是这种抑制并不能达到完全清除单增李斯特菌的效果。另外,乳酸菌属中很多菌株在生长过程中可能并不产生抑菌物质,因此在选择应用乳酸菌抑菌物质抑制致病菌的生长时,应该针对特定的体系先对乳酸菌菌株进行筛选,以达到更好的抑菌效果。
1.3.3 干扰群体感应系统
单增李斯特菌在生长过程中能形成生物膜抵御消毒和清洗,生物膜的形成与微生物间的群体感应(QS)有关[45]。因此,控制单增李斯特菌生物膜的形成也是控制该致病菌生长需要关注的内容之一。乳酸菌在生长过程中能通过微生物间的群体感应作用抑制单增李斯特菌产生的生物膜[46],这种抑制作用主要体现在阻断信号分子合成及降低受体蛋白活性[47]。如,Ben Slama等[48]发现,从手工干酪中分离出的植物乳杆菌通过细胞间接触抑制单增李斯特菌生物膜的形成,进而达到对单增李斯特菌生长更好的控制作用。乳酸菌酸性发酵液通过降低介导群体感应的N-酰基高丝氨酸内酯(AHL)信号分子的释放,抑制生物膜的形成[49]。Park等[50]等从泡菜中筛选出一株清酒乳杆菌,通过抑制致病菌共同利用的呋喃酮酰硼酸二酯类信号分子(AI-2)转导途径,降低致病菌的致病性。
综上可见,乳酸菌不仅可通过竞争营养来源及分泌抑菌物质抑制单增李斯特菌的生长,而且还可通过其他抑菌途径抑制单增李斯特菌生物膜的形成,阻止单增李斯特菌在生产设备及产品表面的黏附,进而清除单增李斯特菌,降低单增李斯特菌致病威胁。
2 乳酸菌与单增李斯特菌竞争性生长模型的构建与应用
乳酸菌抑制单增李斯特菌生长行为可用两菌生长竞争模型表示,这种用于表征微生物竞争性生长的预测微生物学模型称为竞争一级模型,一般由2个常微分方程组成,用以分别描述2种菌的生长状态[51]。与微生物生长一级模型相比,两菌生长竞争模型最明显的区别是含抑制系数,抑制系数可以反映不同初始接种量和不同环境条件中共同培养的乳酸菌和单增李斯特菌之间的抑制作用,乳酸菌抑制系数越高表示乳酸菌能够更好地抑制单增李斯特菌的生长[52-53]。近年来,很多学者不断开展两菌交互作用的机制研究,目前描述两菌交互作用关系的主要是Jameson-effect模型和Lotka-Volterra模型,这2个模型借助反应动力学和生态学知识,通过微生物生长参数的变化预测乳酸菌和单增李斯特菌的生长。
2.1 两菌竞争生长模型的提出
在1962年,Jameson[54]首次发现,当2种微生物在液体培养基中共同培养时,每种微生物都会迅速增殖,如同单独培养时的增长情况,当其中一种微生物到达最大种群密度时,另一微生物也会停止生长。这一现象最终被Ross等[55]引入微生物学领域,被称为Jameson-effect模型。1994年,Baranyi等[56]提出Jameson-effect模型的通用模型见式(1)。
(1)
式中:N(t)为被测微生物种群密度;μmax为最大比生长速率;α(t)为调整函数;f(t)为抑制函数;α(t)和f(t)在不同的一级模型中具有不同的表达式。
在Baranyi模型[56]中,调整函数α(t) 和抑制函数f(t)可以表示为
(2)
式中:q(t)为细胞生理状态;λ为迟滞期。
(3)
在三线段模型中,调整函数α(t)和抑制函数f(t)可以表示为
(4)

(5)
1999年,Dens等[57]提出Lotka-Volterra模型,该模型建立的理论基础是当2种微生物处于同一生长环境消耗同一种营养物质时,这2种微生物处于竞争生长的关系,这种竞争关系与它的种群密度成正比,优势菌群种群密度越高,证明其生长速率越快,以此描述两个竞争细菌种群的动态。Lotka-Volterra模型可以式(6)~(9)来表达。
(6)
(7)
(8)
(9)
式中:Nmax为最大菌落密度;qA和qB代表2种细胞的生理状态;αAB和αBA表示2种微生物的交互情况,αAB是种群B对A的作用系数,αBA是微生物A对B的作用系数;若αAB>1,证明2种微生物有交互作用,微生物B生长达到最大菌落密度后,对微生物A生长有抑制作用;若αAB=1,说明无交互作用;若αAB<1,说明微生物B对微生物A生长的有促进作用,其表达方式参照式(2)的Baranyi模型。
2.2 两菌竞争生长模型进展
虽然Jameson-effect模型和Lotka-Volterra模型都可以描述乳酸菌与单增李斯特菌两菌间的交互作用关系、定量生长过程中二者生长参数与时间的关系,以预测食品货架期及关键控制点,但是Jameson-effect和Lotka-Volterra模型在描述两菌间的关系时存在差异。Lotka-Volterra模型不仅可以描述争夺同一种营养物质的不同微生物之间的相互作用,而且可用来描述2种或多种微生物之间的竞争关系。如Vimont等[58]用Lotkae-Volterra模型构建了牛肉中E.coliO157:H7和背景菌的生长模型,当背景菌群的菌落密度达到最大时抑制大肠杆菌的生长。Chen等[59]利用Lotka-Volterra模型模拟食品中定量S.enteritidis、P.aeruginosa与植物乳杆菌这3菌生长关系,结果发现:当沙门氏菌和铜绿假单胞菌与与植物乳杆菌共培养时,其抑制函数α>1,表示铜绿假单胞菌和沙门氏菌对植物乳杆菌具有抑制效果,且这种交互效果与两菌的初始接种量有关;植物乳杆菌与这2种菌的抑制函数α<1,证明植物乳杆菌对这两种菌的生长没有抑制效果。Jameson-effect模型描述两菌生长时,当优势菌群达到最大种群密度,另一种群生长受抑制的作用,如Ye等[60]基于Jameson-effect模型成功描述在冷冻猪肉中乳酸菌对单增李斯特菌生长Nmax的抑制作用。但Jameson-effect模型在描述两菌生长时存在局限性,它只能描述优势菌群达到最大种群密度时对另一菌群的抑制作用,而实际上在微生物生长过程中优势菌群可能未达到最大种群密度时就能够抑制另一菌群的生长。因此,Marc等[61]首次改良Jameson-effect模型,改良的Jameson-effect模型提出“关键细胞密度”,关键细胞密度是指一种微生物生长达到能抑制另一种微生物生长的临界密度,这种关键细胞密度低于最大种群密度。Costa等[62]在模拟食品中清酒乳杆菌对单增李斯特菌的抑制作用时,比较了Jameson-effect模型、改良的Jameson-effect模型和Lotka-Volterra模型,结果发现:改良的Jameson-effect模型提出两菌的抑制参数,可用于量化单增李斯特菌动力学参数μmax、达到稳定期的Nmax以及共培养与单培养相比菌落总数下降的百分比;同时,当两菌共培养时,改良的Jameson-effect模型比Jameson-effect模型拟合优度更高。Costa等[63]利用3种竞争模型模拟等温和非等温条件下食品不同初始接菌密度的清酒乳杆菌对单增李斯特菌的抑制作用时发现,在非等温条件下,Lotka-Volterra模型对Nmax的拟合度略高于Jameson-effect模型对Nmax的拟合度。
综上,Jameson-effect和Lotka-Volterra模型都可用于描述乳酸菌对单增李斯特菌生长的交互作用,两种模型各有优缺点。由于食品基质营养成分复杂且往往存在其他微生物,所以目前很多研究会去除背景菌,且不考虑食品基质和背景菌群对建模结果的影响,这可能会影响模型的准确性,导致高估或低估单增李斯特菌的风险。因此,当使用双菌模型描述两菌间生长时,应该在考虑两菌生长的基质、其他微生物的影响以及真实环境变化的基础,选择合适的模型,以期对乳酸菌与单增李斯特菌的关系做出更准确的预测。
3 结论与展望
由单增李斯特菌污染造成多次食品安全事件,危害消费者健康,亟须控制食品工业生产及运输过程中单增李斯特菌的污染问题。为满足消费者对“轻加工”及“安全、营养”食品的要求,生物抑菌法引起越来越多人的关注。尽管应用乳酸菌控制单增李斯特菌的研究取得了较多进展,但要使乳酸菌发挥最大的潜力应用至食品安全控制中仍有很多工作需要完善。乳酸菌对单增李斯特菌生长的抑制,已在乳、肉及果蔬中得到验证,但是目前多数研究多关注在添加乳酸菌对单增李斯特菌生长的控制,而忽视了食品感官变化及添加乳酸菌的剂量值,且在实际食品环境中往往多菌共存,因此有必要考虑实际食品有背景菌的存在下乳酸菌对单增李斯特菌的抑菌作用机制,这也将有助于在食品工业中应用并推广乳酸菌。
此外,应用Jameson-effect模型和Lotka-Volterra模型定量表征两菌关系的研究成果较多,但现阶段仍存在一些不足。如,存在模型使用混乱、形式不一和无法准确描述食品基质中菌株生长等问题,若要进一步准确表征食品中两菌或多菌间的关系,需要统一模型系数,明确竞争模型每一项的具体含义。
总之,基于乳酸菌对单增李斯特菌研究进展的总结和讨论,已经证明乳酸菌作为抑菌手段的有效性。通过对乳酸菌的抑菌机制、对致病菌的调控机制、两菌建模的完善等方面进行深入研究,对预防与控制单增李斯特菌的传播来说尤为重要,可为食品中乳酸菌的实际应用提供切实的理论参考依据。
