用壳寡糖修饰的方法提高酵母转化酶的催化活性
2023-12-11黎春怡黄卓烈巫光宏詹福建
黎春怡,黄卓烈,巫光宏,何 平,詹福建
(1.茂名职业技术学院 化学工程系,广东 茂名 525000; 2.华南农业大学 生命科学学院,广东 广州 510642;3.华南农业大学 基础实验与实践训练中心,广东 广州 510642)
蛋白质工程的研究任务之一就是将来自生物细胞的天然蛋白分子进行改造,使其适应于工业生产和医药研究等领域。天然的酶是在生物细胞内合成的,在极大多数情况下这些酶都在细胞内起作用。如果将酶从细胞内提取出来应用在工业或医药等领域时,一般它们的催化活性都很低,且酶学性质极不稳定。但是,如果对来自生物细胞的酶进行适当改造,那就有可能在一定程度上提高这些酶的催化活性,其酶学性质也可能会得到一定程度的改善。
对天然的蛋白质(酶)分子进行改造,一个重要的方法就是对这些蛋白质分子的侧链进行化学修饰[1]。通过化学反应将某些有机分子共价结合到酶分子肽链的某些基团上。这样不仅能改变酶分子的立体结构和理化性质,而且能提高酶的应用价值。这是目前最有应用前景的蛋白质工程技术[1-4]。
用于修饰酶分子的修饰剂有两类。一类是小分子修饰剂。用某些小分子物质来修饰酶分子的侧链,可以改变酶分子的溶解性和催化活性。Distel等[5]用小分子物质辛酰氯对碱性蛋白酶进行修饰,结果发现:在氯仿中修饰酶的溶解度高达44 mg/mL,在不同有机溶剂中修饰酶的酶活提高了4~22倍;用邻苯二甲酸酐修饰后的辣根过氧化物酶(HRP)的催化活性也大大提高。另一类是大分子修饰剂。用大分子化合物对酶分子的表面进行修饰可以降低酶的免疫原性,提高酶的热稳定性。一般使用分子量为500~20 000的甲氧基聚乙二醇(mPEG)来修饰蛋白质的表面,在降低酶的免疫原性方面,大分子mPEG的修饰效果优于小分子mPEG的[6],其中mPEG-5000修饰后的效果最好[7];而在维持酶的酶活方面,小分子mPEG修饰后的酶活效果则优于大分子mPEG的[6]。
多糖类物质的优点是无毒、易溶于水和生物相容性好。因此,多糖也被用来修饰酶以提高酶的稳定性和降低其免疫原性。Wu等[8]用葡聚糖修饰纤溶酶原后发现,该酶原的半衰期增加了52%,但酶活却降低了36%。杨漩等[9]用活性葡聚糖修饰弹性蛋白酶后发现,在室温下酶活维持18个月后基本不变。伍志权等[10]用右旋糖苷修饰酵母蔗糖酶后发现,修饰酶的酶活提高了56.7%,而且当pH为3.5时,酶活的稳定性增强。
壳聚糖(COS)是一种高分子多糖,也可用于酶分子的化学修饰,但以分子量较小的壳聚糖(称为壳寡糖)修饰效果较好。在一定的化学反应条件下,壳寡糖的游离半缩醛羟基可以与酶分子侧链上的氨基或酰胺基脱水缩合而连接,来修饰酶分子。黎春怡等[11]利用壳寡糖对漆酶进行修饰,修饰酶的活性比天然酶提高了45%,虽然热稳定性和最大反应速率(Vmax)得到很大的提高,但Km值却明显降低。Li等[12]用壳寡糖修饰胃蛋白酶,修饰后酶的稳定性得到较大提高。
酵母转化酶(EC 3.2.1.26)具有广泛的应用前景。在食品工业方面,转化酶能利用从蔗糖生产糖浆和人造蜂蜜,还可用作杏子糖、核桃糖的软化剂[13]。转化酶在生产液态心糖和软性心糖中有特殊用途[14]。利用转化酶将蜂蜜中的蔗糖分解成单糖,以此可生产工业酒精[15]。在临床应用方面,转化酶-异麦糖酶复合物既可作为结肠癌的预测指标,也可用于检测心脏巴雷特腺癌[16]。虽然目前酵母转化酶在工业和医药方面应用很多,但该酶在使用中存在催化活性不高、贮存活性下降快、酶学性质不稳定等缺点,这就大大阻碍了它的广泛应用。如果将转化酶的分子进行修饰改造,以改善其酶学性质,最终提高其催化活性,这将会大大提高转化酶的应用价值。
蛋白质分子功能的发挥受其分子结构制约,而且蛋白质分子构象改变会导致其功能的改变。当今,人们研究蛋白质分子构象的变化主要利用三维荧光光谱来实现。Lin等[17]利用三维荧光光谱法研究土贝母皂苷与人血清白蛋白结合后的构象变化后发现,人血清白蛋白分子的二级结构发生了明显的改变。张孟丽等[18]和魏良淑等[19]用三维荧光光谱法研究后发现,所研究的蛋白质分子的构象都发生变化。杨胜园等[20]采用三维荧光光谱等技术研究苯甲酸与牛血清白蛋白(BSA)分子的相互作用机制后发现,苯甲酸对BSA内源性荧光的猝灭作用属于静态猝灭。
基于此,本研究试图利用壳寡糖对酵母转化酶进行侧链修饰,探讨修饰前后酶的催化活性、动力学、氨基修饰率和三维荧光光谱等的变化,以期为酵母转化酶的进一步应用提供参考。
1 材料与方法
1.1 材料和试剂
酵母转化酶(YInv,CAS 9001-57-4)、2,4,6-三硝酸苯磺酸(TNBS)、考马斯亮蓝G-250、考马斯亮蓝R-250,Sigma公司;壳寡糖(COS,平均分子量5 000),上海陶和生物科技有限公司;牛血清白蛋白(BSA),Fluka公司;葡萄糖,Amersco公司;NaBH4(96%),上海润捷化学公司。其他化学品均为市售分析纯产品。
1.2 主要仪器
TFD5503型冷冻干燥机,韩国Shin Lab公司;凝胶成像系统,广东珠海黑马有限公司;UV3010型分光光度计、F4500型荧光光谱仪,日本日立公司;DYY-5型恒压恒流电泳仪,北京六一仪器厂;PHS-25型 pH计,上海雷磁仪器厂。
1.3 YInv的纯度鉴定
采用聚丙烯酰胺凝胶电泳(PAGE)技术对YInv纯度进行鉴定。浓缩胶和分离胶的质量分数分别为4.5%和7.5%;加样量为10 μL/孔;样品在浓缩胶中时电压为150 V,样品进入分离胶时电压为200 V;电泳后用考马斯亮蓝R-250溶液对凝胶进行染色30 min,再用0.25 mol/L 的NaCl溶液对染色的凝胶进行脱色;最后用凝胶成像仪对凝胶进行拍照。
1.4 用COS对YInv进行修饰
1.4.1 基本修饰方法
用平均分子量为5 000的壳寡糖(COS)修饰YInv。具体过程为将25 mg的YInv纯酶溶解于5 mL 0.1 mol/L醋酸钠缓冲液(pH 4.0),然后在酶液中加入0.1 mol/L的NaIO4溶液5 mL和0.5 g的蔗糖(保护YInv)后搅拌30 min,加入400 μL乙二醇终止反应。将反应液在2 L 0.1 mol/L醋酸钠缓冲液(pH 4.0)中透析4 h,透析管截留分子量为1.0×104,重复透析3次;再向经透析后的溶液中加入0.5 g蔗糖和40 mg COS,搅拌4 h后,加入1 mol/L 的NaBH4溶液1 mL,再连续搅拌4 h;然后将溶液用 0.1 mol/L的醋酸钠溶液2 L透析4 h,并重复透析3次。由此得到修饰酶的粗酶,命名为粗COS-Inv。以上实验均在4 ℃暗室中进行。
1.4.2 单因素实验确定最佳修饰条件
为了获得修饰过程中使用的pH、反应温度、COS剂量、蔗糖剂量及反应时间等参数的最佳值,分别进行单因素实验,以得到修饰酶的酶活性最高为标准,再确定最佳的修饰条件。
1.4.2.1 pH对化学修饰效果的影响
按基本修饰方法进行修饰,将pH分别设置为4.0、5.0、6.0和7.0,反应温度为5 ℃,蔗糖用量为1.71 g,反应时间为4 h,COS剂量为20 mg,以此考察pH对修饰效果的影响。
1.4.2.2 反应温度对修饰效果的影响
按基本修饰方法进行修饰,将反应温度分别设为5、20、35和50 ℃,pH为4.0,蔗糖用量为1.71 g,反应时间为4 h,COS剂量为20 mg,以此考察反应温度对修饰效果的影响。
1.4.2.3 COS剂量对化学修饰效果的影响
按基本修饰方法进行修饰,而COS的添加量分别设为10、20、40和80 mg,反应温度为5 ℃,pH为4.0,反应时间为4 h,蔗糖用量为1.71 g,以此考察COS剂量对修饰效果的影响。
1.4.2.4 蔗糖剂量对化学修饰效果的影响
按基本修饰方法进行修饰,将蔗糖用量分别设为0、0.85、1.71和3.42 g,反应温度为5 ℃,pH为4.0,反应时间为4 h,COS剂量为20 mg,以此考察蔗糖剂量对修饰效果的影响。
1.4.2.5 反应时间对化学修饰效果的影响
按基本修饰方法进行修饰,将反应时间分别设为4、6、8和12 h,反应温度为5 ℃,pH为4.0,蔗糖用量为1.71 g,COS剂量为20 mg,以此考察反应时间对修饰效果的影响。
1.5 COS-Inv的纯化与鉴定
用聚乙二醇(PEG)将修饰得到的粗COS-Inv溶液在4 ℃下浓缩后,再用DEAE-52纤维素阴离子交换层析柱(尺寸为φ2.5 cm×40 cm)来纯化15 mL经浓缩的粗COS-Inv。首先,用0.05 mol/L磷酸盐缓冲液(PBS,pH 6.0)洗脱,洗脱速度为1 mL/min,每管4 mL,共收集17支管;其次,用0.05 mol/L PBS(pH 6.0)和0.1 mol/L 的NaCl洗脱,收集10支试管;再次,从第28支试管开始进行梯度洗脱,洗脱液为100 mL PBS (0.05 mol/L,pH 6.0,含0.5 mol/L NaCl) + 150 mL柠檬酸缓冲液(CBS,0.2 mol/L,pH 6.0,含3 mol/L 的NaCl),洗脱速度为1 mL/min,检测每管洗脱液的A280和酶活;最后,选择酶活最高的试管中的分馏液用PEG浓缩,将此浓缩酶液用PAGE电泳分析COS-Inv的纯度,并进行相关试验。
1.6 氨基修饰率的测定
将1 mL酶液(含0.1~1.0 mg蛋白质)与1 mL 40 g/L的NaHCO3(pH 8.5)和1 mL 100 g/L的十二烷基硫酸钠(SDS)混合,20 min后,加入1 mL 1 g/L的TNBS溶液。将混合物在40 ℃下保存2 h后,再加入0.5 mL 1 mol/L的 HCl终止反应。检测335 nm处的吸光度A335。用文献[21]的方法计算酶蛋白游离氨基含量,再根据修饰前后相同蛋白质的酶液中游离氨基的含量计算氨基残基比率。
氨基修饰率=1-氨基残基比率。
1.7 蛋白质和糖含量的测定
以牛血清白蛋白为标准蛋白,采用Braford法[22]测定蛋白质含量。以葡萄糖为标准,按照Mohammadi等[23]的方法测定糖含量。
1.8 YInv 和COS-Inv活性的测定
转化酶的最适温度为50~54 ℃[24-28]。在试管中加入1 mol/L的蔗糖1 mL和0.1 mol/L的醋酸钠缓冲液(pH 5.0) 1 mL,在50 ℃水浴保温10 min后,加入0.1 mL酶液(YInv或COS-Inv)反应10 min后,加入2 mol/L的NaOH溶液0.1 mL终止反应。采用3,5-二硝基水杨酸法[29]测定还原糖含量。酶活性定义:每分钟产生1 μmol还原糖所需酶的量。比酶活定义:1 mg蛋白质对应的酶活(U/mg)。
1.9 YInv和COS-Inv的贮存稳定性试验
分别将YInv和COS-Inv置于冰箱冷藏室(4 ℃)和室温(25 ℃)中,每天定时测定酶活,连续测定7 d,观察酶活变化趋势。以新鲜配制的YInv和COS-Inv酶液(0 d)为对照,YInv和COS-Inv的质量浓度均为2.0 mg/mL。
1.10 三维荧光光谱分析
用荧光光谱仪分析缓冲液中YInv和COS-Inv的三维荧光光谱,比较YInv和COS-Inv三维荧光光谱的差异。
1.11 YInv 和COS-Inv的动力学测定
测定系列相应底物浓度的0.05 mol/L 乙酸-乙酸钠缓冲液(pH 5.0)中YInv或COS-Inv的催化速度,以此绘制速度的倒数(1/v)对相应的底物浓度的倒数(1/cS)的Lineweaver-Burk曲线,再根据YInv和COS-Inv的Lineweaver-Burk曲线分别计算其Vmax和Km。
2 结果与讨论
2.1 试验样品酶的纯度鉴定
一般来说,化学修饰所用的酶应是纯酶,而鉴定酶纯度的最重要方法就是PAGE法[30]。YInv及纯化的COS-Inv纯度鉴定的电泳结果见图1,蛋白质分子的泳动方向是从负极向正极。由图1可知:在1和2号泳道上只出现了一条蛋白条带。由此表明,本研究用的YInv是纯酶,可进一步用于化学修饰、光谱分析、动力学测试及氨基修饰率等实验。

1—YInv;2—纯化的COS-Inv
2.2 化学修饰的单因素实验结果
2.2.1 反应pH对修饰效果的影响结果
考察反应pH对化学修饰后酶活的影响,结果如图2所示。由图2可知:当修饰体系pH为4.0时,修饰酶的比酶活最高;当pH大于4.0时,修饰酶的比酶活开始下降。可见,适宜的化学修饰pH为4.0。方差分析结果(F=3 796.628)表明,各pH试验间的差异非常显著。
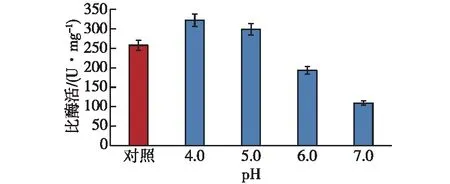
图2 反应pH对化学修饰酶活的影响
2.2.2 反应温度对修饰效果的影响结果
考察反应温度对修饰酶活的影响,结果如图3所示。由图3可知:当反应温度为20 ℃,此时修饰酶的比酶活最高,为332.76 U/mg,比对照YInv的高29.03%;随着反应温度的升高或降低,修饰酶的比酶活都降低。可见,适宜的反应温度为20 ℃。方差分析(F=775.21)结果表明,各温度试验间的差异极显著。

图3 反应温度对化学修饰酶活的影响
2.2.3 COS剂量对化学修饰效果的影响结果
考察COS剂量对化学修饰酶活的影响,结果如图4所示。由图4可知:当用20 mg COS修饰25 mg酶时,修饰酶的比酶活最高;当COS的剂量大于或小于20 mg时,修饰酶的比酶活均有所降低。可见,最适的COS剂量为20 mg。方差分析(F=516.8)结果表明,各剂量实验之间的差异极显著。
2.2.4 蔗糖剂量对化学修饰效果的影响结果
考察蔗糖剂量对化学修饰酶活性的影响,结果如图5所示。由图5可知:当蔗糖用量为0.85 g时,修饰酶的比酶活(349.64 U/mg),比天然YInv的提高35.58%;当蔗糖用量大于或小于0.85 g时,修饰酶的比酶活降低。可见,蔗糖的适宜剂量为0.85 g。方差分析(F=2 344.5)结果表明,各蔗糖用量实验间差异极显著。
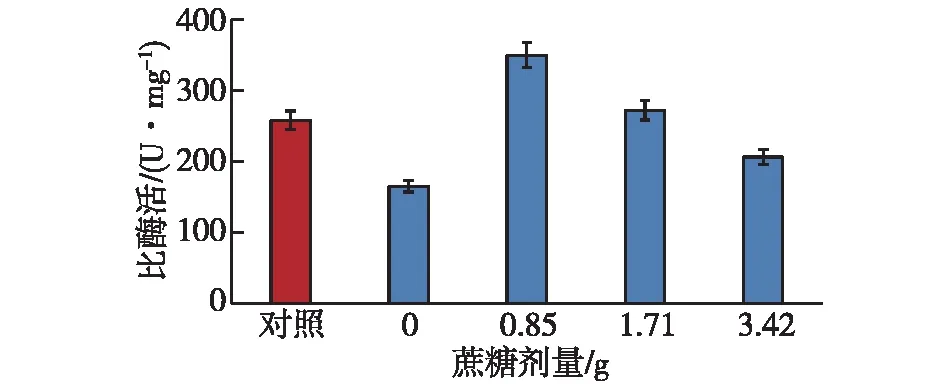
图5 蔗糖剂量对化学修饰酶活的影响
2.2.5 反应时间对化学修饰效果的影响结果
考察反应时间对化学修饰酶活性的影响,结果如图6所示。由图6可知:当反应时间为6 h时,修饰酶的比酶活为306.28 U/mg,比天然YInv的高18.76%;当反应时间大于或小于6 h时,修饰酶的活性都有所降低。可见,适宜的反应时间为6 h。方差分析结果(F=767.28)表明,各反应时间实验之间的差异极显著。
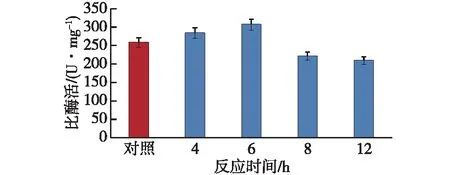
图6 反应时间对化学修饰酶活性的影响
2.2.6 化学修饰最佳条件的确定
综合以上结果可知最佳的修饰条件如下:pH为4,反应温度为20 ℃,COS剂量为20 mg,蔗糖剂量为850 mg,反应时间为6 h。因此,在此最佳条件下进行进一步实验。
2.3 粗COS-Inv的提纯与鉴定结果
DEAE-52纤维素离子交换层析法是分离蛋白质的重要方法之一[31-32]。本研究用COS对YInv进行化学修饰后,用DEAE-52纤维素阴离子柱层析纯化所得到的粗修饰酶(粗COS-Inv),洗脱曲线如图7所示。由图7可知:COS-Inv洗脱曲线上有4个蛋白峰,最大比酶活峰与第3个蛋白峰重合;在第52管的比酶活最高,为759.38 U/mg;纯化倍数为1.12(表1)。
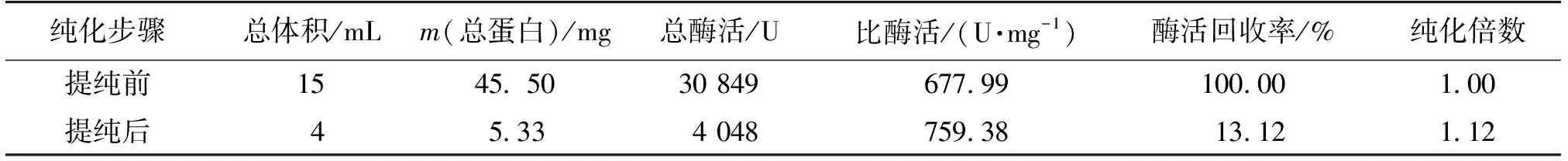
表1 COS-Inv的纯化参数

图7 用DEAE-52纤维素柱层析纯化COS-Inv的洗脱曲线
将第52管的分馏液用聚乙二醇浓缩后,再进行PAGE分析,以鉴定COS-Inv的纯度(见图1中的泳道2)。由图1可知:蛋白样品在电泳过程中从负极迁移到正极,而且COS-Inv的迁移速度比YInv慢很多。这说明COS-Inv的分子量大于YInv,即在修饰试验中,COS的糖链确实与酶分子的侧链相连接,导致COS-Inv的分子量大于YInv。可见,用COS对YInv的化学修饰是成功的。
2.4 化学修饰前后的酶活性变化
考察化学修饰前后的酶活性变化,结果见表2,方差分析结果见表3。由表2可知:修饰后COS-Inv的平均比酶活是YInv的3.003倍。由表3可知:YInv和COS-Inv比酶活之间的差异非常显著。当然,这些结果还可能受到一些因素的影响,但可以肯定的是,用COS进行化学修饰确实可以提高酵母转化酶的催化酶活。
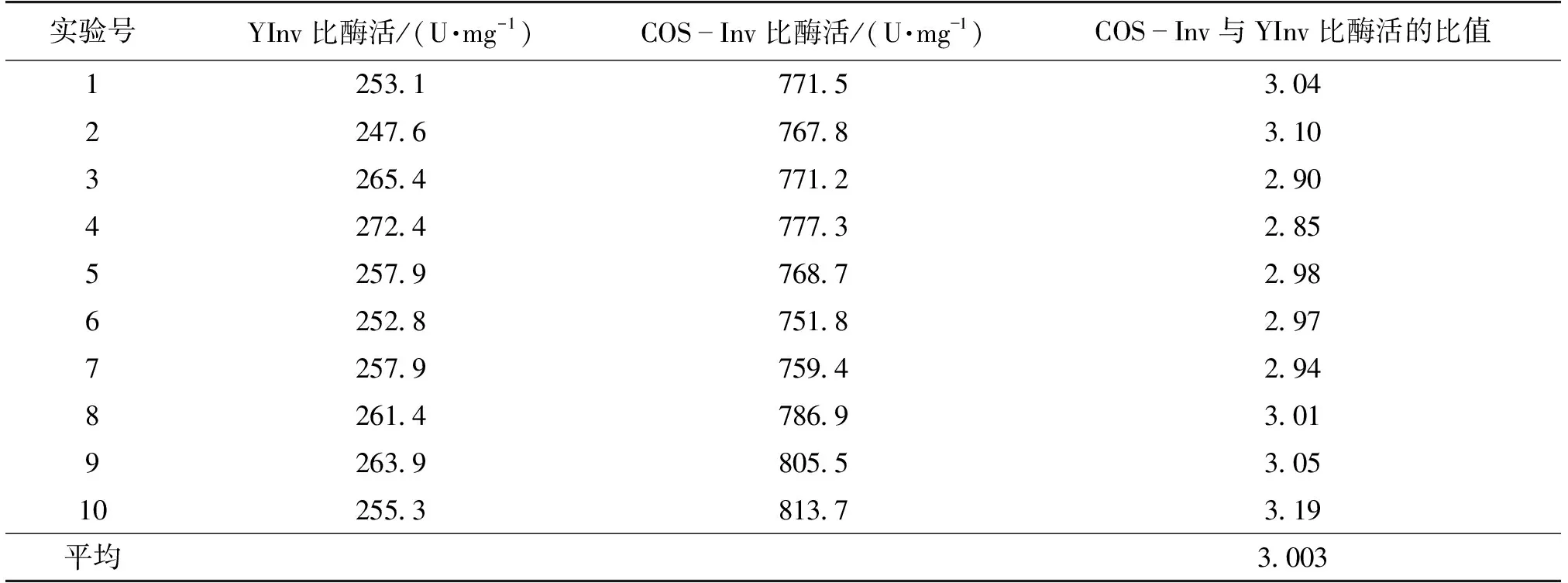
表2 用COS修饰前后比酶活的变化

表3 YInv和COS-Inv比酶活的方差分析
2.5 化学修饰前后酶分子中糖的含量和氨基修饰率的变化
天然的转化酶分子是一种糖蛋白[33-34]。因此,考察化学修饰前后酶分子糖含量和氨基修饰率的变化,结果见表4。由表4可知:YInv的糖含量为2.75 mg/mg,即2.75 mg糖与1 mg酶蛋白侧链结合;经修饰后COS-Inv的糖含量为6.34 mg/mg,即6.34 mg糖与1 mg酶蛋白结合,COS-Inv的糖含量是YInv的2.31倍,COS-Inv的氨基修饰率为49.4%。这表明在化学修饰中,COS的大量糖链连接到酶分子侧链的氨基上。这就使COS-Inv的分子量远远大于YInv。由此可见,本研究中用COS对酵母转化酶的化学修饰是非常成功的。

表4 YInv和COS-Inv的糖含量和氨基修饰率的对比
2.6 YInv 和COS-Inv的动力学参数
Km值的大小反映酶对底物的亲和力,Km值大,表示酶对底物的亲和力小,对酶促反应不利;而Km值小,就表示酶对底物的亲和力大,对酶促反应有利[35-36]。因此,以蔗糖为底物,在50 ℃、pH为5.0条件下,测定YInv和COS-Inv的催化动力学,结果见图8。根据图8的结果计算得到,YInv的Km和Vmax分别为125.45 mmol/L和1 512.4 μmol/mg;而COS-Inv的Km和Vmax分别为58.92 mmol/L和1 352.4 μmol/mg。
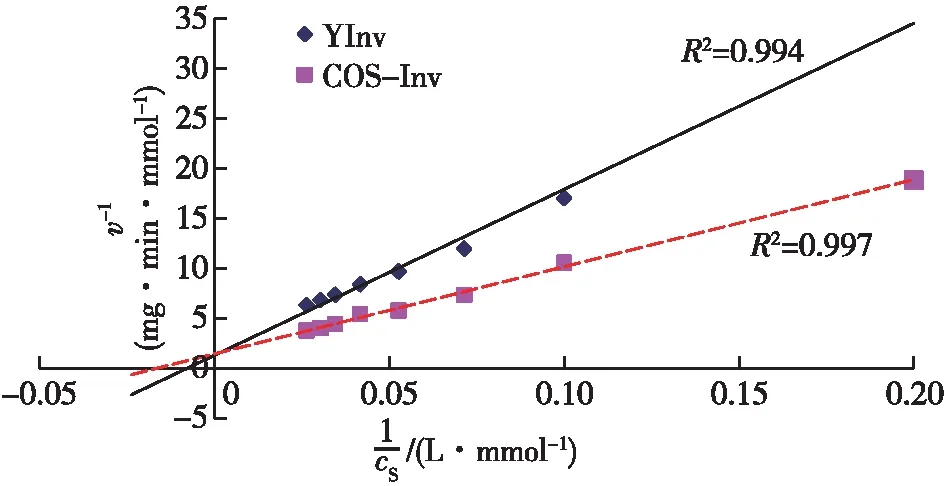
图8 YInv和COS-Inv的Lineweaver-Burk曲线
综上可见,经化学修饰后酶的Km值大大下降,这说明修饰后COS-Inv对底物的亲和力比YInv大大增强。这也可以解释为什么COS-Inv的比酶活远高于YInv。
2.7 YInv 和COS-Inv的贮存稳定性分析结果
将YInv和COS-Inv溶液(2.0 mg/mL)分别放置于室温(25 ℃)和冰箱(4 ℃)保存,每天检测酶的酶活,考察酶活的变化,结果见图9。由图9可知:在室温和冰箱的条件下,YInv的酶活都迅速下降,1 d后,YInv的残留比酶活分别为39.77%(室温)和72.74%(冰箱);第3 天时,YInv的活性基本消失;而COS-Inv在第3天的残留比酶活分别为83.95%(室温)和94.74%(冰箱),保存4 d后,COS-Inv的残留比酶活分别为30.75%(室温)和42.60%(冰箱)。由此可见,用COS进行化学修饰后,COS-Inv的贮存稳定性有了很大的提高。

图9 YInv和COS-Inv在贮存期间的比酶活性
2.8 YInv 和COS-Inv的三维荧光光谱
三维荧光光谱法是研究蛋白质分子构象的非常重要的方法[37]。这种方法能够较直观地表明Trp、Tyr和Phe这3种氨基酸残基在蛋白质分子中的微环境及其在不同条件下的构象变化[38-40],这3种氨基酸导致蛋白质在270~300 nm处有吸收。但是不同的蛋白质分子其荧光峰位置和荧光强度不同,这主要是决定于其分子中Trp、Tyr和Phe这3种氨基酸残基的数量及其在分子的立体结构中的裸露程度。正常情况下,蛋白质分子都有其特定的荧光特性,但当这种蛋白质分子受某种因素影响且构象发生较大变化时,其荧光特性就会相应改变。由此可知,若2个蛋白质分子的荧光特性差异较大,就说明这2种蛋白质分子的立体结构(构象)差异较大。
图10为YInv和COS-Inv荧光光谱的平面三维等高线图。横坐标为发射波长(Em,200~400 nm),纵坐标为激发波长(Ex,200~400 nm)。平面上的点代表由2个波长共同决定的样品的荧光强度。将相等荧光强度的点连接起来,在Em-Ex所构成的平面上绘制出由一系列等荧光强度线组成的等高线,等高线越密,荧光强度越强。由图10可知:YInv有2个激发波长,这2个波长分别为234和280 nm,形成2个荧光峰;COS-Inv也有2个激发波长,这两个波长分别是232和280 nm,也形成2个荧光峰。虽然YInv的激发波长形成的荧光峰与COS-Inv的差异不是很大,但YInv的荧光强度比COS-Inv的强得多,因为YInv的等高线比COS-Inv的密得多。由此可以确定,COS-Inv与YInv是2种具有差异相当大的三维分子结构,即用COS修饰YInv后,由于COS的糖链连接到酶分子侧链的氨基上,所得到的COS-Inv的三维结构发生了明显改变,Trp、Tyr和Phe氨基酸残基部分被糖链覆盖,导致COS-Inv分子的荧光强度明显下降。三维结构改变可能使底物更容易接近酶的活性中心,这样就导致COS-Inv对底物的亲和力升高,最终的催化活性明显提升。这可能是化学修饰后COS-Inv催化活性大大提高的主要原因。这是根据实验结果和相关现象作出的判断,但是更清晰的作用机制则有待进一步研究来证实。
3 结论
用COS修饰酵母转化酶,电泳实验结果和氨基修饰率的试验数据表明,本研究的修饰试验是成功的,且修饰酶(COS-Inv)的比酶活比原酶(YInv)的提高了200.3%。动力学研究结果表明,YInv和COS-Inv的Km分别为125.45和58.92 mmol/L。这意味着修饰后的COS-Inv与底物的亲和力大大增强,这正是修饰酶活性大大提高的原因。
三维荧光光谱实验结果表明,YInv的荧光强度比COS-Inv的强得多。这说明经过化学修饰后,COS-Inv的三维分子结构发生了较大的变化。酶分子三维结构改变就会引起催化活性的改变,这也许可以解释COS-Inv的催化活性远高于YInv的原因。
综上可知:用COS修饰酵母转化酶后,COS的糖链连接到酶分子侧链的氨基上,不仅使修饰酶(COS-Inv)的分子量明显增加,而且导致其立体结构大大改变,进而提高了酶分子对底物的亲和力,最终使修饰酶的催化活性得到大大提高。
