水浴静态顶空固相微萃取温度控制对新鲜茶青香气组分及其气味活性的影响
2023-12-11蒋宇航林小琴许艺娜江文甲林文雄
蒋宇航,林小琴,许艺娜,江文甲,林 生,林文雄
(1.福建农林大学 农学院 福建 福州 350002;2.福建农林大学 生命科学学院 福建省农业生态过程与安全监控重点实验室,福建 福州 350002;3.龙岩学院 资源工程学院,福建 龙岩 364000;4.福建农林大学 安溪茶学院,福建 福州 350002)
茶是除水之外全世界第二大重要的消费饮品。以茶青为原料,根据发酵程度的不同,可制备得到不同类型成品茶,其中,经典半发酵型茶类乌龙茶是我国的独创茶类,不仅富含多酚和维生素类等活性成分,具有抗氧化、消炎等作用[1],而且其具有独特的香气和优雅醇美的花果气味,因此备受人们青睐[2]。乌龙茶的制作过程颇为复杂,因不同地域加工方式而呈现不同的特色。总体来说,主要制作工序包括晾青、做青(包括摇青和摊青)、杀青、揉捻及烘焙等[3],其中做青是影响乌龙茶香气品质形成的重要工序之一[3-4]。茶青经日光萎凋、待叶缘因水分蒸发而呈波状时,便以滚筒方式进行摇青,在此过程中,因考虑到成品茶色泽滋味,制茶师傅们往往更多注重摇青的剧烈程度和频率,却忽视了滚筒加热温度对茶青香气形成的影响。实质上,茶青香气类型及其释放程度受相关酶促与非酶促反应协同作用的影响,其中香气型态形成主要以摇青过程中的酶促反应为主。目前已知组成酶促产香系统中重要的酶类主要为脂肪酸氧化合酶、糖苷水解酶和多酚氧化酶类[5]。在茶叶加工过程中,各类酶促系统在调控茶叶香气上具有显著影响,然而针对摇青阶段中不同温度如何影响主要酶促产香系统活力的表征研究一直鲜有报道[6]。
茶叶中香气物质的气味活性值是衡量茶叶香气感官效果优劣的重要参数,它强调的是绝对浓度与气味阈值间的比重,而不是其在茶叶中的绝对浓度[7]。目前对乌龙茶生产过程中香气的研究主要集中在力学损伤和低温胁迫协同作用对特有香气化合物的积累等方面,对于香气在茶叶不同摇青温度条件下对香气物质气味活性变化特征的研究却不多[8-9]。做青,特别是摇青阶段能够促进茶鲜叶的糖苷态香气前体水解并释放游离态香气,同时伴随着有利于萜烯醇类和其他类型香气化合物的转化和形成过程[10-11],而摇青过程中,在不同温度调控下茶鲜叶的不同类型香气活力动态变化鲜有报道。因为温度能影响茶鲜叶酶促和非酶促反应,进而调控茶叶香型状态,但一直以来并没引起足够的重视[12-13]。茶叶加工中的不同工序在香气挥发物差异方面的研究往往比较多[9],而温度变化对茶叶香型及活性强度的差异研究方面并不多。因此,本研究将着重通过控制不同水浴温度来萃取茶叶关键香气化合物来研究其分布特征及活力状况,以期对后续成茶香气制备和优化提供一定的技术支撑和参考。
1 材料与方法
1.1 材料
1.1.1 药品
亚油酸(GC纯度95%)、内标癸酸乙酯(GC纯度99%),Sigma-Aldrich公司;改良通用缓冲液(modified universal buffer,MUB),自制。
1.1.2 仪器
TissueLysr型高通量组织研磨仪,德国QIAGEN公司;57324-U型固相微萃取装置,美国Supelco公司;RE-52CS型旋转蒸发器,上海亚荣生化仪器厂;JY96-IIL型超声波细胞破损仪,上海乔跃有限公司;TQ8040型三重四级杆气相色谱质谱联用仪、气相石英毛细管柱(SH-Rxi-5Sil MS),日本岛津公司。
1.2 茶样品收集
茶鲜叶样本(乌龙茶品种金观音,茗科1号)采自中国福建省安溪县龙涓乡布岩山茶园(北纬24°57′,东经117°4′),山体平均海拔高度为750 m,年平均气温16~18 ℃,无霜期300 d左右,年降水量为1 800 mm,属于亚热带海洋性季风气候。取样时间为2019年9月30日,采摘部位为一芽三叶的嫩梢。茶鲜叶用取样袋装好,当天送往福建省农业生态过程与安全监控重点实验室,在适度晒青后,为减少鲜叶中的水分并及时恢复叶片舒张状态,将其放入25 ℃阴凉通风透气处,铺平摊开,散发鲜叶热气,降低叶温,且平衡叶内含水量至40%左右,以预防其短时间内腐烂。取其中一部分茶样,对不同水浴温度下的茶青立即进行顶空固相微萃取和酶活性测定试验,将另外的备份样品放入样品袋,冲入N2,密封样品袋,4 ℃下保存。
1.3 茶叶香气相关酶活性测定方法
1.3.1 脂氧合酶测定
反应底物的制备:将0.25 mL 吐温-20(分析纯)分散在10 mL 0.2 mol/L硼酸盐缓冲溶液(pH 9.0) 中,摇动过程中逐滴加入0.27 mL亚油酸(GC纯度≥95%),混匀加入1 mol/L NaOH至溶液澄清,同时调节pH至9.0,最后用其缓冲溶液稀释至500 mL作为反应底物。
将晾青后保持一定水分的茶叶装入旋转瓶中,通过设置RE-52CS型旋转蒸发器合理转速后,分别进行冰浴和20、30、40、50、60、70、80、90和100 ℃水浴旋转反应30 min,迅速用液氮冻干,用TissueLysr型高通量组织研磨仪依次将处理后的不同茶样研磨至细粉末状,各取粉末样品10 g,每组处理平行做3次重复,立即放入50 mL离心管,加入40 mL麦氏缓冲液(pH 为6.3,0.1 moL/L柠檬酸-Na2HPO4缓冲液)涡旋振荡2 min后,过0.45 μm滤膜(聚醚砜),再分别将1 mL滤液分装入2 mL离心管中,加入0.2 mL底物溶液,同时在各对应水浴温度下作无底物对照处理,立即取出过滤膜,在450 nm 处进行测定。酶活性以不同底物水浴所得OD减去无底物水浴OD与有底物冰浴所得OD减去无底物冰浴的OD差值ΔOD450表示[14],具体计算见式(1)。
ΔOD450=(OD底物水浴-OD无底物水浴)-(OD底物冰浴-OD无底物冰浴)
(1)
1.3.2β-D-葡萄糖苷酶活性测定
按照上述处理方式,晾青后的茶样分别在20、30、40、50、60、70、80、90和100 ℃水浴旋转30 min反应。同样取不同处理粉末各5 g,每组处理做3个平行重复,然后加入40 mL MUB缓冲溶液(pH 6.0),涡旋振荡2 min后,立即放入JY96-IIL型超声波细胞破损仪(工作频率25 kHz)冰浴破碎5 min,10 000 r/min离心5 min得上清液,一份吸取1.2 mL置于2 mL离心管中,加入0.2 mL对硝基酚-β-D-吡喃葡糖苷 (PNPG,25 mmol/L)溶液,另一份加入缓冲溶液作为无底物对照,依次加入0.2 mL 0.5 mol/L的CaCl2溶液和0.4 mL的Tris 缓冲液(0.1 mol/L三羟甲基氨基甲烷,pH 12.0),滤膜过滤后在400 nm 处进行比色,其结果为样液与无底物对照的差值ΔOD400[10]。同时配制0.1、1、10、50和100 μg/mL标准对硝基苯酚溶液并绘制标准曲线(y=0.030 8x+ 0.043 3,R2=0.999 9)。将差值代入方程便可得到相对应反应后所得对硝基苯酚的浓度值,其活性以固定时间等量样品中所含对硝基苯酚的含量表示[10],计算见式(2)。
c对硝基苯酚=(ΔOD400-0.043 3)/(0.030 8m样品t反应时间)
(2)
1.3.3 多酚氧化酶活性测定
茶样处理过程如前面所述,取样品粉末0.05 g于离心管中,立即加入0.03 mol/L H3PO4缓冲液1 mL(内含0.02 mol/L 巯基乙醇、0.001 mol/L乙二胺四乙酸(EDTA)、5%甘油、1%聚乙烯吡络烷酮;pH 5.6),涡旋振荡2 min后,4 ℃、6 000 r/min离心10 min;将上清液转移至干净离心管并加入1 mL反应混合液(1.5%的邻苯二酚、0.1%脯氨酸溶液、pH 6.0的柠檬酸-磷酸缓冲液体积比为3∶2∶10),在35 ℃ 水浴15 min后,立即加入1 mL 1 mol/L偏磷酸溶液终止反应,一份以无反应底物作对照。在460 nm 处进行测定,其结果为不同温度处理与对应温度下无底物作对照的OD值之间的差值[15],其计算见式(3)。
ΔOD460=OD有底物-OD无底物
(3)
1.4 茶鲜叶挥发物前处理
在进行样品顶空固相微萃取前,将晾青后的茶样迅速用液氮研磨成粉状,每个萃取温度下做5次生物学重复,准备好20 mL干净棕色顶空瓶,称取2 g粉末样品,加入2.5 μL内标癸酸乙酯(0.05 mg/mL)(GC纯度≥99%),摊放于瓶底部,压实并盖紧瓶盖,确保良好的气密性。通过手动静态顶空固相微萃取的方式浸提茶叶挥发物并进行气相色谱质谱分析,固相微萃取采用的萃取头材质为65 μm聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB),在每次提取前,将萃取纤维预先插入气相进样口端以260 ℃加热10 min,以便去除其他留在纤维上的挥发性成分。将萃取头位于顶空瓶内中部位置处,然后将顶空瓶放入已设定萃取温度的恒温水浴锅中,平衡5 min后,依次以60 min为萃取时长,以上述不同萃取温度对样品进行挥发物成分提取,每次萃取纤维在进样口端保持3 min的热脱附。
1.5 气相色谱质谱联用仪分析
采用TQ8040型三重四极杆气相色谱质谱联用仪进行测定,色谱柱为长30 m、内径 0.25 mm、液膜厚度 0.25 μm的气相石英毛细管柱,载气为He(纯度99.999%)。不分流进样,样品采集时间为1 min,流速控制方式采用恒线速度(62.6 cm/s),He作为载气,以1 mL/min的柱流速经过色谱柱。气相色谱柱箱以程序升温方式进行升温,其程序如下:45 ℃保持0.5 min后,以15 ℃/min升温速率上升至280 ℃,最后280 ℃保持2 min。质谱仪采用70 eV电离能进行电子轰击。进样口和离子源温度分别为250和220 ℃。质谱扫描范围为10~500m/z。挥发性化合物基于NIST 14 数据库进行检索定性,通过内标法计算挥发物各组分相对含量(μg/g)。
所有的结果以平均数(5次重复)±标准差来表示。不同样品间的显著性(P<0.05) 运用SPSS (Version 16,SPSS Inc.,USA) 进行单因素方差分析(one-way ANOVA),不同萃取温度下相同化合物含量变化作图采用GraphPad Prism 5.0软件(GraphPad Software Inc.,USA)。同时将茶青4种主要香型的不同挥发物气味活性值分别在不同萃取温度(30、40、50、60、70、80、90和100 ℃)进行主成分分析,且萃取温度与挥发物气味活性值间进行冗余分析,分析软件为Canoco 5.0(Microcomputer Power,USA)。
1.6 数据分析
气味活度值 (odor activity values,OAVs)计算:采用挥发性化合物的相对含量除以其在水中气味阈值即得气味活度值[15],其挥发性化合物在水中气味阈值的计算方法主要通过在实验室环境中使用人体嗅觉感知到的该种气味化合物在介质水中最低浓度的广泛测试数据来综合评价,其组分气味活性值的计算如式(4)所示。
Ot=AtVCi/AimTt×1 000
(4)
式中:Ot为目标组分气味活性值,L/kg;At为内标测定到的峰面积;Ci为内标化合物在顶空瓶中的含量,μg/mL;V为顶空瓶体积,mL;Ai为内标化合物在水中测定到的峰面积;m为测试样品质量,g;Tt为目标组分在水中的阈值,μg/L。
2 结果与讨论
2.1 不同萃取温度条件下香气化合物在茶鲜叶中的释放情况
茶鲜叶中的香气化合物在不同萃取温度条件下的释放情况如图1和表1所示。由图1可知:等量茶鲜叶粉末在不同温度条件下顶空固相微萃取相同时间后,茶鲜叶均能释放出19种相同的香气化合物组分。释放强度较大的主要是一些萜烯(醇)类物质,其化合物分别为(E)-香叶醇、水杨酸甲酯、芳樟醇、芳樟醇氧化物、β-香叶烯、α-罗勒烯、L-α-蒎烯、柠檬烯、香橙烯、(+)-δ-杜松烯及(Z,Z)-α-法呢烯等;但是随着萃取温度的提高,一些组分的释放强度会发生比较明显的变化。如,茶鲜叶中(E)-香叶醇释放量与温度变化具有一定的相关性,其释放强度在70 ℃前基本保持不变,而后在70~80 ℃间达到最大状态,随后强度减弱。(E)-呋喃型芳樟醇氧化物释放量在70 ℃以后也随温度提升而显著提高(表1),但其释放强度则保持基本不变。茶鲜叶中水杨酸甲酯和芳樟醇的释放量随温度变化表现出一致性,30~50 ℃具有一定的释放强度,且释放强度基本不变,50~70 ℃释放量降低,在70~100 ℃具有一定的释放强度,释放量增加。其他组分释放量与温度变化只有微小变化,其在茶鲜叶中的含量值均在2.5 μg/g以下,没有显著的释放强度。综合图1和表1可知:在不同水浴温度条件下,香气挥发物含量和气味活性度将随之改变;特别是高温水浴下(E)-香叶醇的积累量和释放强度显著高于其他香气组分(P<0.05),除(E)-香叶醇外,绝大部分香气化合物释放量的最佳萃取温度为40~60 ℃。
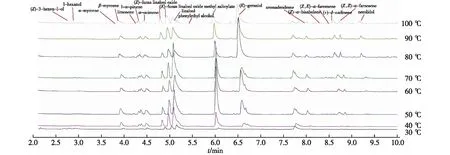
图1 在不同萃取温度下茶鲜叶中主要香气物质的总离子流
2.2 不同萃取温度下茶鲜叶的挥发物种类及香型种数
通过查找相关文献所得挥发物组分气味描述,金观音茶鲜叶萃取到的香气挥发物依据香型主要分为四大类,它们分别是花香、果香、木香和青香(表2)。花香型化合物总数为16种,果香型化合物总数为5种,木香型化合物总数为17种,青香型化合物总数为7种。不同萃取温度下,不同香型种数具有较大差异:青香型化合物种数在不同萃取温度条件下差别不大,均维持在4种左右;从50 ℃开始,花香型化合物种数均维持在10种;而果香型化合物种数在70 ℃及其较低温度时,能够保持6种,但当温度在高于70 ℃后,果香味型化合物种数降为3种;在温度高于80 ℃后,木香味型化合物种数维持在13种。香气化合物的气味阈值能够客观反映出其香气活性,其阈值越低,表现香气活力就越强。由表2可知:(E)-β-紫罗兰酮、芳樟醇和1-壬醇其香气活性强度高,且它们的气味阈值均在1.0以下,对应的香气类型均为花香,特别是(E)-β-紫罗兰酮,虽然其气味阈值为0.01,但是活性强度在所列已知化合物中是最高的,同时该物质主要在90 ℃及以上高温萃取条件下形成,而芳樟醇和1-壬醇在萃取过程中均存在。大根香叶烯-D和δ-杜松烯的气味阈值为1~2,均具有较高的活性强度,对应的香气类型均为木香。
2.3 不同萃取温度对四类香型化合物活性强度的影响
本研究材料为金观音茶鲜叶,在水浴温控过程中,它的主要香气类型分别为花香、果香、木香和青香。通过主成分相关性分析不同萃取温度对茶鲜叶4种类型香气化合物香味活性强度的影响,结果如图2所示。由图2可知:不同萃取温度条件在茶鲜叶的不同花香型化合物的气味活性值上具有一定区分度,可分为低温到高温的3个区间,即30~40 ℃、50~70 ℃和80~100 ℃(图2(a))。如,(S)-香茅烯和(Z)-α-红没药烯等花香型气味活性在低温区具有明显的富集效应,(Z)-香叶醇、(Z,Z)-α-法呢烯和α-依兰油烯等花香型气味活性在50~70 ℃具有更高程度的富集;绝大部分化合物的花香型气味活性在80 ℃以后的高温区间富集效果明显,(E)-β-紫罗兰酮、松油醇和(Z)-吡喃型芳樟醇氧化物的气味活性在水浴温度90~100 ℃富集效果显著;茶鲜叶中青香型化合物气味活性在60 ℃及以下的萃取温度条件下具有较好的富集效应,尤以水杨酸甲酯、2-己烯醛更为明显(图2(b)),青香气味活性在高温条件下其富集趋势明显减弱,其原因可能与脂肪族醛醇类化合物沸点往往比萜烯类和芳香族类物质低有关,通常脂肪族类低沸点的青香化合物在更高温度上会大量释逸[5];水浴温度为50~70 ℃时,绝大部分茶鲜叶果香型化合物活性度具有显著富集效应(图2(c)),主要呈果香味型的化合物有异松油烯、松油烯、(Z)-柠檬醛、(E)-柠檬醛、柠檬烯和苯甲醇等,同时较高温度对香橙烯活性度产生正效应,但茶鲜叶果香型化合物活性在50 ℃以下的富集效果减弱。木香型类化合物活性度超过70 ℃之后的富集程度明显增强,但当水浴温度低于60 ℃时,则富集程度逐渐减弱,在所列化合物中,绝大部分的木香型化合物的活性度富集增强主要集中在80~100 ℃,它们主要是大根香叶烯-D、δ-杜松烯、杜松醇和δ-雪松醇等。
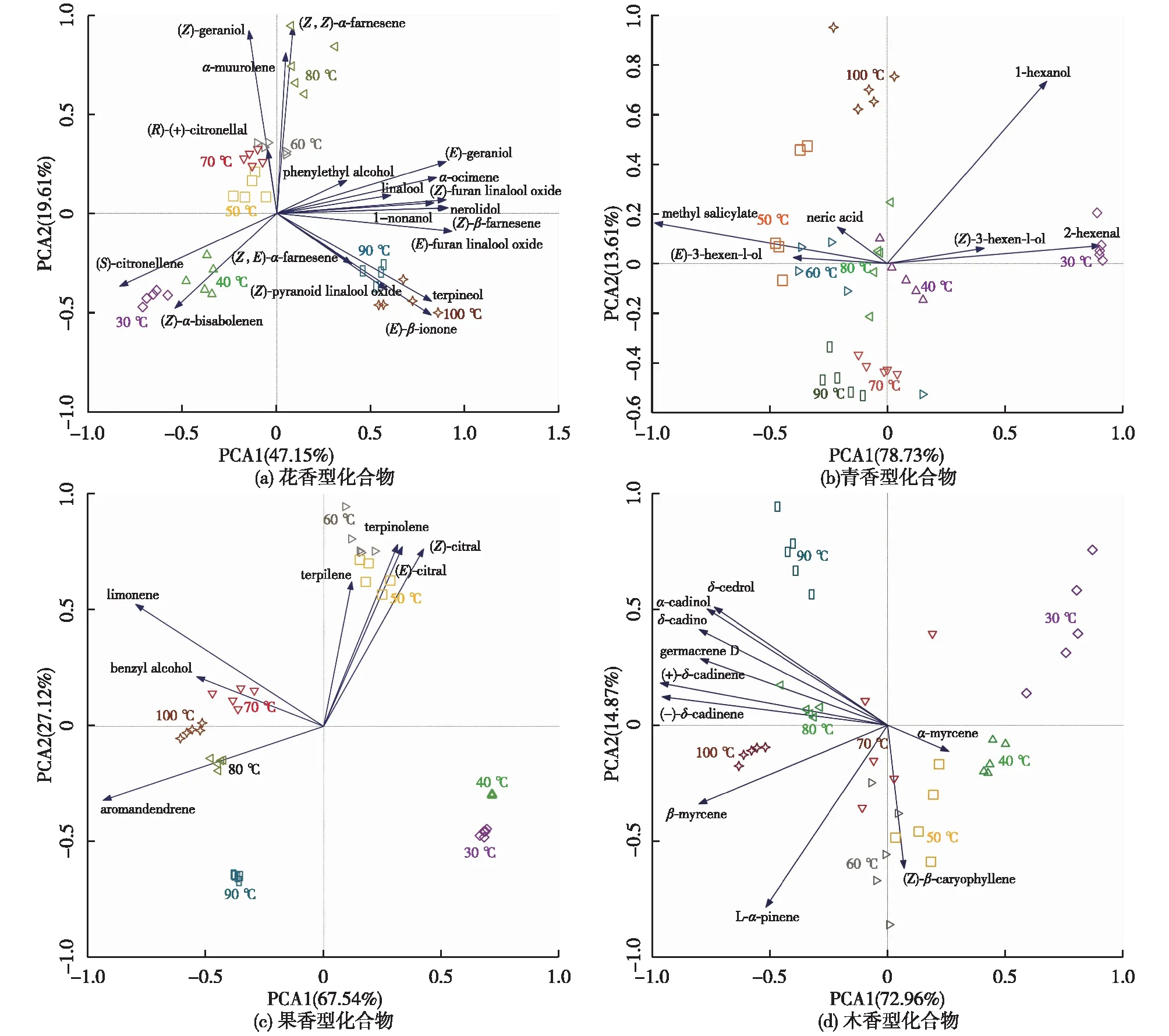
图2 不同萃取温度对茶鲜叶4种类型香气化合物香味活性强度的影响
2.4 不同萃取温度对茶鲜叶主要香型贡献的变化特征的影响
将所有同类香型化合物活性强度与不同温度条件下对应的萃取结果进行累加,结果如图3所示。由图3可知:在不同萃取温度下,4种香型其贡献特征呈现多样化。与其他香型相比,茶鲜叶花香味在整个萃取过程的贡献率均在60%以上,即花香的贡献在整个水浴温控过程中起主要作用,而其他香型气味则远远低于花香味在整个萃取过程中的贡献程度,其贡献率均在20%以下。花香味在茶鲜叶加热过程中贡献值变化特征为先增加后减小再增大,其中40 ℃和70 ℃为2个分界点温度(图3(a))。果香味在鲜叶萃取温度上升过程中主要呈先增大后减弱的规律,其中以70 ℃为其趋势分界点温度(图3(b))。木香味贡献趋势与果香型一致,其分界点温度亦为70 ℃(图3(c))。青香味随茶鲜叶萃取温度上升,其贡献值逐渐减弱(图3(d)),即低温(低于40 ℃)萃取条件对茶鲜叶的青香味具有贡献。综合图2和图3可以看出,(Z)-α-甜没药烯在40 ℃左右对茶鲜叶花香味起主要贡献,而在80 ℃以上水浴温度条件下,其花香味主要起贡献的化合物是(E)-β-紫罗兰酮。茶鲜叶的果香味和木香味等具有较大贡献的化合物分别为柠檬烯和L-α-蒎烯,青香味在茶鲜叶中贡献最佳的主要作用物质为(Z)-3-己烯醇和(E)-2-己烯醛。香气化合物的感官效果取决于其气味活性值,即浓度与气味阈值之比[7],温控对茶鲜叶中不同花香型化合物的气味活性强度的影响是不同的,如,30~40 ℃对于花香型香气化合物中(S)-香茅烯和(Z)-α-甜没药烯气味活性影响较为活跃,而绝大部分花香型化合物,诸如(E)-香叶醇、芳樟醇及其氧化物、苯乙醇、1-壬醇、橙花叔醇、金合欢烯、罗勒烯、松油醇及(E)-β-紫罗酮等气味活性度在80~100 ℃时最为活跃,且(E)-β-紫罗酮、1-壬醇和芳樟醇具有极低的气味阈值。可见,花香型化合物在茶叶摇青过程的花香味型态建成上具有较高贡献水平(90%以上)。
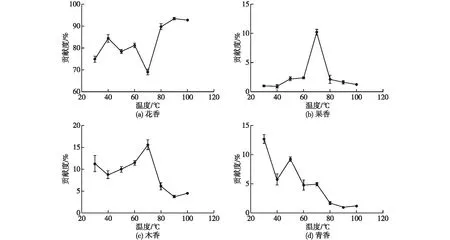
每组图片中不同字母表示在不同处理上具有显著水平(P<0.05)
2.5 不同萃取温度对茶鲜叶重要香气酶促反应活性的影响
茶鲜叶的香气相关酶系统主要包括脂氧合酶反应系统、葡萄糖苷水解酶系统和多酚氧化酶系统。茶鲜叶的酶促反应系统主要酶活性与萃取温度变化规律如图4所示。由图4可知:茶鲜叶脂氧合酶、β-葡萄糖苷酶和多酚氧化酶在增温过程中基本具有相同适宜的酶活性温度区间,该温度区间为30~60 ℃,其中脂氧合酶和多酚氧化酶活性强度在茶鲜叶中最适温度值均为40 ℃,β-葡萄糖苷水解酶的最适值为50 ℃。在60~100 ℃时,茶鲜叶中的3种酶活性均显著降低(P<0.05)。乌龙茶在做青等发酵过程中,多酚类酶促偶联邻醌的氧化作用过程对不同类型茶香的形成具有广泛而深远的影响[5],如,此酶促系统对茶鲜叶胡萝卜素的氧化降解形成β-紫罗酮的作用,这种过程在茶鲜叶中受热力作用表现更为明显,特别在高温条件下,其香气活性强度愈加明显。茶鲜叶中的脂类物质含量很高,可达干质量的7.15%,其中主要包括棕榈酸、油酸、亚油酸及亚麻油酸等不饱和脂肪酸,茶鲜叶在加工过程中,其脂肪酸以酶促反应氧化降解为主要方式,形成顺-3-己烯醇、反-2-己烯醛等香气化合物[25],很显然这类香气为30~60 ℃间释放量和香气活性度都比较高。茶鲜叶中极其丰富的芳樟醇和水杨酸甲酯等糖苷态香气前体物质,可能在50 ℃左右通过糖苷水解酶释放产生的对应挥发量相较其他阶段具有很高的水平[26]。茶鲜叶中主要酶促反应系统最佳的温度调控范围为30~60 ℃,而非酶促反应(主要为热物理化学作用)可能主要在大于60 ℃高温下开始对茶鲜叶香气构型具有重要贡献,因此应该综合分析酶促和非酶促反应过程对茶鲜叶摇青阶段中对茶叶香气的贡献[8]。综上所述,60 ℃水浴温度可能是主要几类香味型态间的平衡点温度,因此茶鲜叶可在适当时间内进行60 ℃左右的温控摇青,可利于多种型态的香型化合物更多地附着于茶青,从而对制备更优质的成茶打下坚实基础。
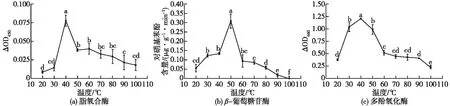
各组图中不同字母表示处理间存在显著性差异(P<0.05)
3 结论
乌龙茶独特的加工工序主要在做青阶段,而又以摇青阶段对鲜叶的理化性状有着特殊的要求,尤其在香气调控上,随加工的推进,鲜叶气味表现出规律性的变化,最后形成浓郁持久的成茶香气。茶鲜叶在摇青过程中受温度调控,低温与高温间持续的变换影响着不同香气气味活性强度及相关酶促反应系统活力状况,因此不同温度在茶青特征茶香形成的实时调控上具有重要意义。本研究表明茶鲜叶在水浴萃取过程中呈现出花香、果香、木香和青香等气味,同时花香味在不同萃取温度阶段对茶青香气的贡献度远远超过其他类型香气。主要酶促产香反应相关酶的最适温度区间为40~60 ℃,在60 ℃之后其香气释放量主要以非酶促反应(受热作用)为主,其中以(E)-香叶醇释放量在60 ℃随温度升高表现最为显著。茶鲜叶中大部分花香味型化合物气味活性度在温度高于60 ℃具有较高水平,其中β-紫罗酮的气味活性度在水浴100 ℃时达到最佳状态。木香型化合物气味活性与花香型具有相似的高温高活性的特点,而青香型化合物主要在温度低于50 ℃具有较高活性,且具有低温高活性的特点。因此,温控是影响茶青摇青阶段做香形成的重要因素,对茶叶做青阶段不同香气型态形成具有一定参考意义。
致谢:特别感谢福建省安溪举源农业综合开发有限公司刘金龙同志提供茶叶样本。
