竹黄菌漆酶对工业染料的脱色降解及其基因分析
2023-12-11郭艳华李信萍周建芹王剑文郑丽屏
郭艳华,王 玥,李信萍,周建芹,王剑文,郑丽屏
(1.苏州大学 药学院,江苏 苏州 215123;2.苏州大学 金螳螂建筑学院,江苏 苏州 215123)
染料废水占我国每年总工业废水排放量的三分之一,已成为目前危害最大且难以治理的主要水体污染源之一[1]。在厌氧环境下,多数染料可以转化为有毒或致癌物质,不仅破坏生态平衡,而且严重威胁人类健康[2-3]。处理染料废水的传统方法主要包括絮凝、吸附、超滤、渗析、氧化和电化学等方法[4],但这些传统技术不仅脱色效果差,而且所需成本高,还会产生有害副产物,造成二次污染[5]。
漆酶(laccase,EC 1.10.3.2)是一种含4个铜离子的多酚氧化酶[6],于1883年在紫胶漆树Rhusvernicifera的分泌蛋白中首次发现,后续在多种植物、昆虫、细菌及真菌中均被发现[7]。因为真菌漆酶可以催化氧分子中的4个电子还原成水,氧化多酚、甲氧基酚、芳香族胺等多种有机底物,已被成功应用于纸浆的漂白、染料脱色、污染物检测及抗生素与农药的生物降解等领域。陈中维等[8]利用黄孢原毛平革菌Phanerochaetechrysosporium的漆酶粗酶液(100 U/L)对刚果红(40 mg/L)进行脱色,降解率为24.0%,在添加介体物质藜芦醇(veratryl alcohol)后,刚果红的降解率显著提高,5 h内降解率可达87.7%[8]。侯红漫等[9]用白腐菌Pleurotusostreatus324的粗漆酶在pH 4.0、40 ℃、酶活30 U/mL的条件下,12 h内可使100 mg/L蒽醌染料SN4R的脱色率达到55%。活性蓝19、酸性蓝225经毛栓菌Trameteshirsuta漆酶处理后,脱色率和脱毒率都可达80%左右[10]。真菌漆酶在工业染料废水处理上具有巨大的应用潜力。
竹黄菌Shiraiaspp.的基座或子实体——竹黄是我国的传统中药材,具有止咳化痰、活血化瘀的功效[11],其活性物质包含竹红菌素、痂囊菌素、多糖和11,11′-二去氧沃替西林等[12]。胡艳等[13]发现,竹黄菌菌株Shiraiasp.SUPER-H168有产生漆酶的能力。目前,漆酶产生菌研究较多的是白腐真菌,培养7~21 d后,酶活约为200~6 500 U/L[14-17]。
本研究对前期分离得到的竹黄菌新菌株(Shiraiasp.S8)的产漆酶能力及漆酶活性进行研究;同时考察竹黄粗漆酶对活性蓝19、孔雀石绿和中性红的降解效率,并进一步分析添加小分子介体2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)及乙酰丁香酮(AS)对漆酶降解染料效率的影响;最后,克隆漆酶基因lcc1,并利用生物信息学方法对其氨基酸序列、高级结构及系统发育树等方面进行分析,为拓展竹黄菌的应用提供基础数据。
1 材料与方法
1.1 菌种材料
竹黄菌Shiraiasp.S8,由本课题组于2012年自南京紫金山麓短穗竹Brachystachyumdensiflorum的茎秆中分离,现保藏于中国普通微生物菌种保藏管理中心(CGMCC),编号为CGMCC 3984。
马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g,切成小块,加水煮沸30 min,纱布过滤取汁,加葡萄糖20 g,琼脂10 g,充分溶解后用蒸馏水定容至1 L,自然pH。
种子液培养基:去皮马铃薯100 g,切成小块,加水煮沸30 min,纱布过滤取汁,称取可溶性淀粉20 g、NaNO34 g、KH2PO41.5 g、CaCO30.5 g、维生素B1(VB1) 0.01 g,充分溶解后用蒸馏水定容至1 L,自然pH。
漆酶高产培养基:马铃薯200 g,去皮切小块,加水煮沸30 min,纱布过滤取汁,称取可溶性淀粉20 g、酵母粉4 g、CuSO4·5H2O 0.15 g、MgSO4·7H2O 0.1 g、KH2PO40.05 g,充分溶解后用蒸馏水定容至1 L,自然pH。
以上培养基于121 ℃高压蒸汽灭菌25 min,冷却至室温备用。
1.2 试剂
2,6-二甲氧基苯酚(2,6-DMP)、乙酰丁香酮(AS),阿拉丁试剂(上海)有限公司;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),上海源叶生物科技有限公司;愈创木酚(guaiacol),萨恩化学技术(上海)有限公司;活性蓝19,上海易恩化学技术有限公司;中性红,上海凌峰化学试剂有限公司;孔雀石绿,索莱宝生物科技有限公司。
1.3 方法
1.3.1 种子液制备
从28 ℃活化保存于PDA斜面培养基的竹黄菌中取直径10 mm的菌丝块接种于PDA平板,28 ℃培养10 d至菌丝长满整个平板。用10 mL无菌水洗下竹黄菌孢子。血球计数板计数后稀释成2×107个/mL的孢子悬液,吸取稀释后的孢子悬液200 μL接种于50 mL种子液培养基中(150 mL锥形瓶),于28 ℃、150 r/min培养2 d,以此为竹黄菌种子液,用于后续实验。
1.3.2 竹黄菌培养
固体平板培养:为了观察竹黄菌产漆酶的情况,将竹黄菌菌丝块(10 mm)接种于添加了0.5 mol/L ABTS的PDA培养基中,于28 ℃恒温培养10 d,观察平板显色情况并拍照。
液体发酵培养:取1 mL竹黄菌种子液接种于漆酶高产培养基中(150 mL锥形瓶,装液量50 mL),于28 ℃、150 r/min避光培养9 d。在竹黄菌培养的1~9 d期间每天取样,用纱布过滤收集发酵液,于4 ℃、12 000 r/min离心30 min,收集上清液作为漆酶粗酶液用于漆酶酶活的测定及染料脱色研究。
1.3.3 漆酶酶活检测
漆酶酶活采用ABTS法[18]来测定。为了研究温度及pH对漆酶活性的影响,将粗酶液在不同温度(0~100 ℃)下孵育5 min后测定其酶活,或在pH为2.0~7.0的柠檬酸缓冲液中配制成混合物后检测酶活,并将最高酶活设定为100%。然后,将粗酶液在50~80 ℃下孵育不同时间(0~60 min)或将粗酶液保存于pH为2.0~7.0的柠檬酸缓冲液中一定时间(0~108 h),测定漆酶的残余酶活以评价温度或pH对漆酶稳定性的影响,以未处理的酶液酶活为100%。
非变性聚丙烯酰胺凝胶电泳(native-PAGE):参照文献[19]的方法对粗酶液进行native-PAGE分析,使用5%浓缩胶及12%分离胶,电极缓冲液pH为8.3。用含有0.2 mmol/L ABTS、0.5 mmol/L愈创木酚或5 mmol/L 2,6-DMP的柠檬酸缓冲液(0.1 mol/L,pH 4.5)进行活性染色30 min,观察显色情况并拍照。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE):采用5%的浓缩胶与12%的分离胶对漆酶粗酶液进行SDS-PAGE分析。电泳结束后,用考马斯亮蓝R-250染色液进行染色,然后脱色观察电泳条带。
1.3.4 漆酶脱色效果
在1.5 mL的脱色反应体系中,含5.5 U酶量的粗酶液,33 mg/L活性蓝19、孔雀石绿或中性红,介体(终浓度为33.33 μmol/L的ABTS或266.66 μmol/L的AS)以及pH为4.0的柠檬酸缓冲液,在40 ℃下水浴脱色0~60 min。记录不同时间不同染料的吸光值(测试波长:活性蓝19为594 nm,孔雀石绿为617 nm,中性红为533 nm),并拍照,按式(1)计算相应的脱色率。
脱色率=(Ai-Af)/Ai×100%
(1)
式中:Ai为脱色前最大吸收波长处不同染料溶液的吸光值;Af为脱色后最大吸收波长处不同染料溶液的吸光值。
1.3.5 竹黄漆酶基因lcc1克隆
为得到漆酶基因lcc1的cDNA全长,从本课题组前期研究得到的竹黄菌转录组(PRJNA323638)中[20]筛选得到了1个漆酶基因lcc1的核酸序列,并利用在线软件Expasy(https:∥web.expasy.org/translate/)分析其开放阅读框。根据该核酸序列分别设计3′端特异性引物F1(C ̄G ̄G ̄A ̄A ̄A ̄T ̄G ̄G ̄C ̄G ̄G ̄A ̄G ̄GCAAATAC)和5′端特异性引物R1(G ̄G ̄T ̄C ̄T ̄C ̄A ̄C ̄T ̄C ̄G ̄ACGGTCATC)并由苏州金唯智生物科技有限公司合成。按照植物总RNA提取试剂盒说明书(TIANGEN)提取竹黄菌总RNA,按照SMARTerTMRACE cDNA Amplification Kit说明书构建含通用引物结合位点的竹黄菌cDNA文库,分别利用PCR获得lcc1的5′和3′端的cDNA片段。根据5′和3′端的cDNA片段设计巢式PCR引物F2/R2(F2:CTACTGGCTCCGTGTCCAAG;R2:T ̄C ̄C ̄G ̄T ̄A ̄G ̄T ̄C ̄C ̄G ̄C ̄A ̄C ̄C ̄C ̄C ̄A ̄G ̄G ̄C ̄A),进而获得lcc1的中间片段。利用Bioedit软件将lcc1的中间片段与两端的cDNA片段进行拼接,以得到完整的lcc1 cDNA序列。
1.3.6 Lcc1生物信息学分析
利用在线软件Protparam(http:∥web.expasy.org/protparam)分析lcc1基本理化性质。利用NovoPro(https:∥www.novopro.cn/tools/protein-hydrophilicity-plot.html)对Lcc1蛋白的疏水性进行分析。利用NCBI数据库的Conserved Domain search(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白结构域分析。利用SignalP-5.0(https:∥services.healthtech.dtu.dk/service.php?SignalP-5.0)对Lcc1信号肽进行预测分析。利用TMHMM2.0(https:∥services.healthtech.dtu.dk/service.php?TMHMM-2.0)分析Lcc1的跨膜结构。利用SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)及Swiss-Model(http:∥swissmodel.expasy.org/interactive)构建Lcc1二级结构及三维结构。利用MEGA-X软件对Lcc1的氨基酸序列进行同源性比较,并利用邻接法(http:∥www.phylogeny.fr)构建系统发育树。
1.3.7 统计分析
本实验中,对照组和各处理组均设置了3次独立的实验(每次重复至少设置3个平行样本)。每组数据表示为平均值±标准差,并采用学生t检验(Student′st-test)分析实验结果的统计学差异。P<0.05代表差异显著,即具有统计学意义。
2 结果与讨论
2.1 竹黄漆酶的产生
ABTS、愈创木酚或2,6-DMP可以被漆酶分别氧化成绿色、红棕色或黄色物质,是漆酶的特征反应[21-23]。通过在固体培养基中加入0.5 mmol/L ABTS来检测竹黄菌漆酶的产生,结果如图1(a)所示。由图1(a)可知:竹黄菌培养3 d后,培养基呈现绿色。由此初步推断,竹黄菌S8能产生漆酶。
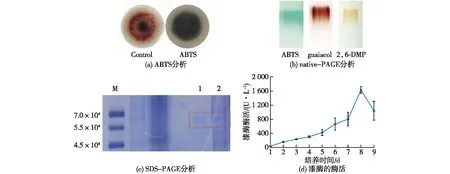
M—标准蛋白;1—商业漆酶;2—竹黄S8漆酶粗酶液
对竹黄菌液体发酵后的粗酶液进行native-PAGE分析,经0.2 mmol/L ABTS、0.5 mmol/L愈创木酚或0.5 mmol/L 2,6-DMP染色后,结果见图1(b)。由图1(b)可知:3条电泳条带分别呈绿色、红棕色及淡黄色,进一步确定了S8菌株可以合成漆酶。
对S8漆酶粗酶液进行SDS-PAGE,经考马斯亮蓝R-250染色液染色后,结果见图1(c)。由图1(c)可知:S8漆酶的分子量约为6.6×104左右。
利用ABTS法检测竹黄菌S8发酵液中漆酶的酶活,结果如图1(d)所示。由图1(d)可知:S8在液体培养条件下可合成漆酶并释放至胞外,随培养时间的延长,漆酶酶活也逐渐增加,在培养的第8天达到最大值(1 361 U/L)。与黑木耳(149 U/L,ABTS法)[24]、红平菇(458.8 U/L,ABTS法)[25]、竹黄菌S.bambusicolaGZ-13×1(487 U/L,ABTS法)[26]等漆酶生产菌相比,S8菌株产酶优势明显,具有成为漆酶生产菌的潜力。
2.2 竹黄漆酶的酶学性质
通过将粗酶液孵育在不同的温度、pH和时间条件下来研究竹黄漆酶的最适温度、pH及其稳定性,结果见图2。
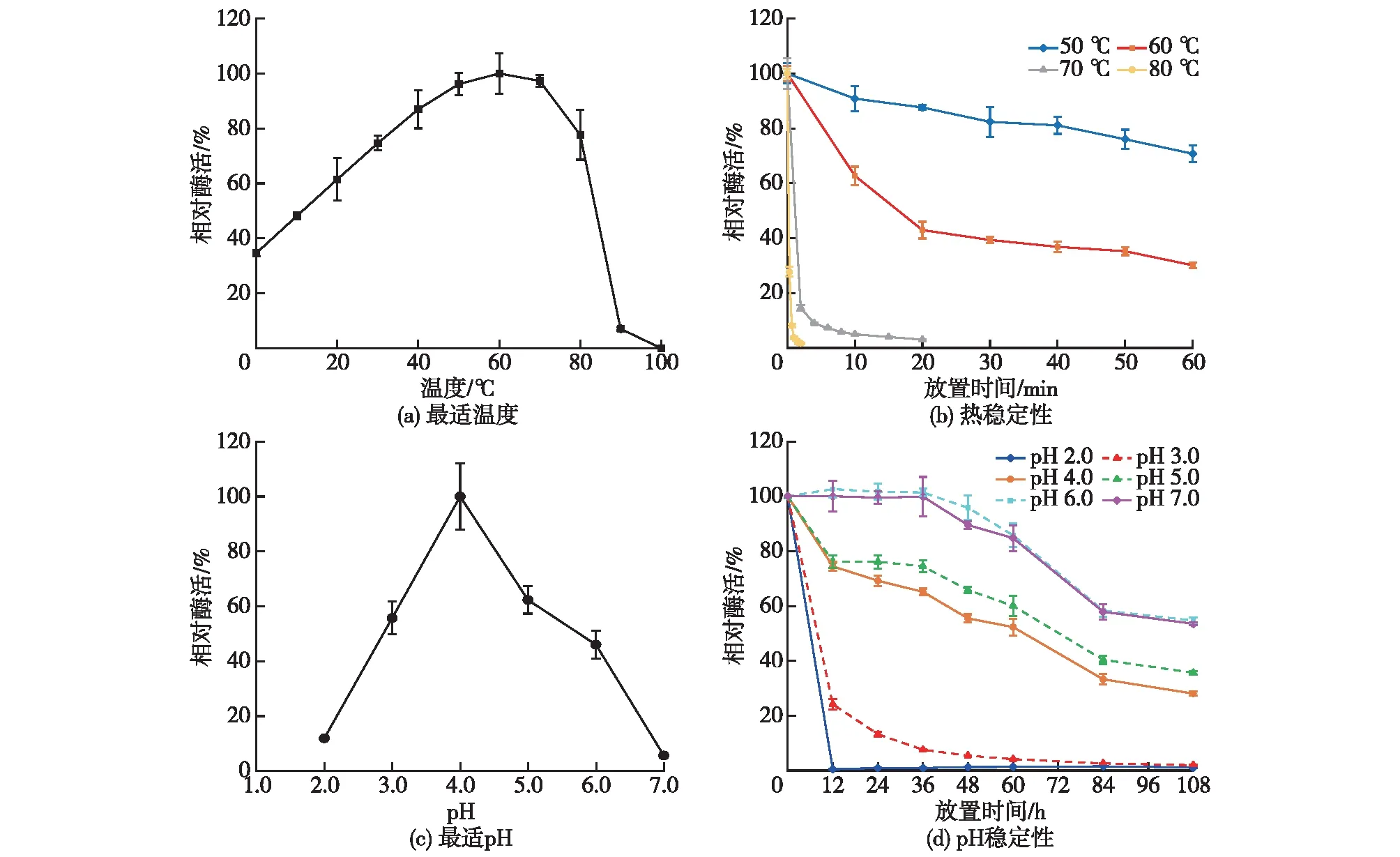
图2 温度及pH对竹黄漆菌S8酶活性及稳定性的影响
由图2(a)可知:竹黄菌S8漆酶的酶活随温度升高而上升,在60 ℃时酶活最高,再升高温度,酶活开始下降,最终在80 ℃时保留78%的酶活。
由图2(b)可知:漆酶在50 ℃保存60 min后,酶活下降约30%;随着温度升高漆酶热稳定性逐渐降低,在80 ℃下保温2 min,酶活仅为1.7%,几乎完全失活。
由图2(c)可知:当反应缓冲液pH为2.0~7.0时,漆酶的最适pH为4.0;当pH<3.0或>6.0时,酶活显著下降;当pH为3.0和6.0时,漆酶酶活维持在50%左右。
由图2(d)可知:当pH为6.0和7.0时,漆酶的稳定性极好,放置36 h后残余酶活仍处于较高水平,108 h后残余酶活为50%左右;在pH为2.0的环境中放置12 h后,漆酶已趋于完全失活。可见,竹黄漆酶的最适反应温度为60 ℃、最适反应pH为4.0,在温度50 ℃或pH为 6.0~7.0条件下,具有较好的稳定性。一般来说,在温度超过50 ℃[27]及酸性[28]条件下,漆酶不太稳定,而Shiraiasp.S8所产的漆酶在pH>4及温度≤50 ℃时相对稳定。
2.3 漆酶对染料的脱色作用
为了考察竹黄菌S8漆酶对不同染料的脱色效果,首先以活性蓝19、孔雀石绿和中性红为作用底物,比较不同介体(ABTS、AS)对漆酶脱色的促进作用,结果见图3(a)。由图3(a)可知:在不添加介体的条件下,漆酶对活性蓝19及孔雀石绿的脱色率分别为13.92%和6.73%,而对中性红没有脱色效果;在AS的参与下,漆酶对活性蓝19、孔雀石绿的脱色率分别提高了约3.5倍和12.8倍,对中性红的脱色率可达81.75%;在ABTS参与下,漆酶可使活性蓝19、孔雀石绿的脱色率分别提高约4.6倍和13.2倍,对中性红的脱色率可达28.72%。由此可见,ABTS更适用于介导漆酶对活性蓝19和孔雀石绿的脱色,AS则适用于中性红。不同染料对介体有选择性可能是由于染料氧化还原电位高于小分子介体形成的阳离子自由基,无法进行正电荷的传递,或者染料的分子结构复杂,不易与漆酶结合位点结合,从而影响了漆酶的催化活性[29]。
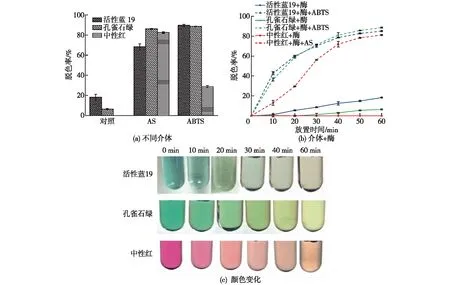
图3 竹黄漆酶对活性蓝19、孔雀石绿和中性红的脱色研究
进一步测定添加合适介体后漆酶对3种染料脱色的效果,结果如图3(b)所示。由图3(b)可知:当漆酶单独作用时,活性蓝19和孔雀石绿的脱色率缓慢增加,但总体都低于20%,中性红始终不脱色;添加介体后,漆酶对3种染料的脱色效率均在短时间内快速增加,当脱色60 min后,漆酶对活性蓝19、孔雀石绿和中性红的脱色率分别可达84.67%、88.52%和81.26%。
考察3种染料脱色过程中的颜色变化,结果见图3(c)。由图3(c)可知:添加合适的小分子介体可以大大提高漆酶对染料的脱色效率。栗君等[30]利用解淀粉芽孢杆菌BacillusamyloliquefaciensLC03的漆酶降解RB亮蓝、靛红、结晶紫,在ABTS存在的情况下,2 h后使其脱色率达到39.35%;酸性红1则在Shiraiasp.SUPER-H168漆酶与介体1-羟基-苯并三氮唑(HOBT)的作用下脱色,140 min内的脱色率为60%左右[31];在Shiraiasp.S8漆酶和介体的作用下,活性蓝19、孔雀石绿及中性红在60 min内的脱色率在80%以上,可见竹黄漆酶/ABTS介体系统在工业染料废水的处理上有较高的效率。
2.4 漆酶基因lcc1的克隆与序列分析
为得到竹黄菌漆酶基因,利用RACE技术以竹黄菌cDNA为模板分别克隆出长度为781 bp的3′端和952 bp的5′端cDNA片段。利用两端序列设计巢式PCR引物F2与R2,扩增出1 555 bp的中间片段,结果见表1。将3段基因序列测序并拼接后,即可得到lcc1的cDNA全长。通过SignalP-5.0和NCBI的Conserved Domain search对Lcc1进行信号肽和蛋白结构域的预测分析。通过在线软件Protparam对lcc1的基本理化性质进行分析,结果如图4所示。由图4可知:该基因开放阅读框全长共1 785 bp,编码一个由594个氨基酸组成的蛋白质,等电点(pI)为6.05,分子量约为6.53×104,此结果与S8漆酶粗酶液SDS-PAGE分析显示的漆酶分子量结果相近。Protparam结果显示Lcc1蛋白的不稳定指数为31.54(小于40故蛋白较为稳定),脂溶指数为74.48,在主要氨基酸组成中,甘氨酸与苏氨酸为优势氨基酸。

表1 lcc1 cDNA序列

双下划线表示铜离子结合位点;▲代表保守的结构域;阴影部分为典型信号肽序列
Lcc1蛋白信号肽共有18个氨基酸,该蛋白包含3个保守的铜离子结构域T1(第75~199位)、T2(第210~370位)、T3(第414~549位)和4个可能参与Cu2+结合的组氨酸保守位点(HWH、HSH、HLHGH和HCH),与源自偏肿革裥菌Lenzitesgibbosa漆酶[32]和齿毛菌Cerrenasp.HYB07[33]等真菌的漆酶结构特征相类似。
通过NovoPro和TMHMM2.0对Lcc1蛋白的疏水性和跨膜结构进行预测,结果见图5。由图5可知:Lcc1为亲水性蛋白,平均总亲水性为-0.354;Lcc1为胞外蛋白,且不含跨膜区。
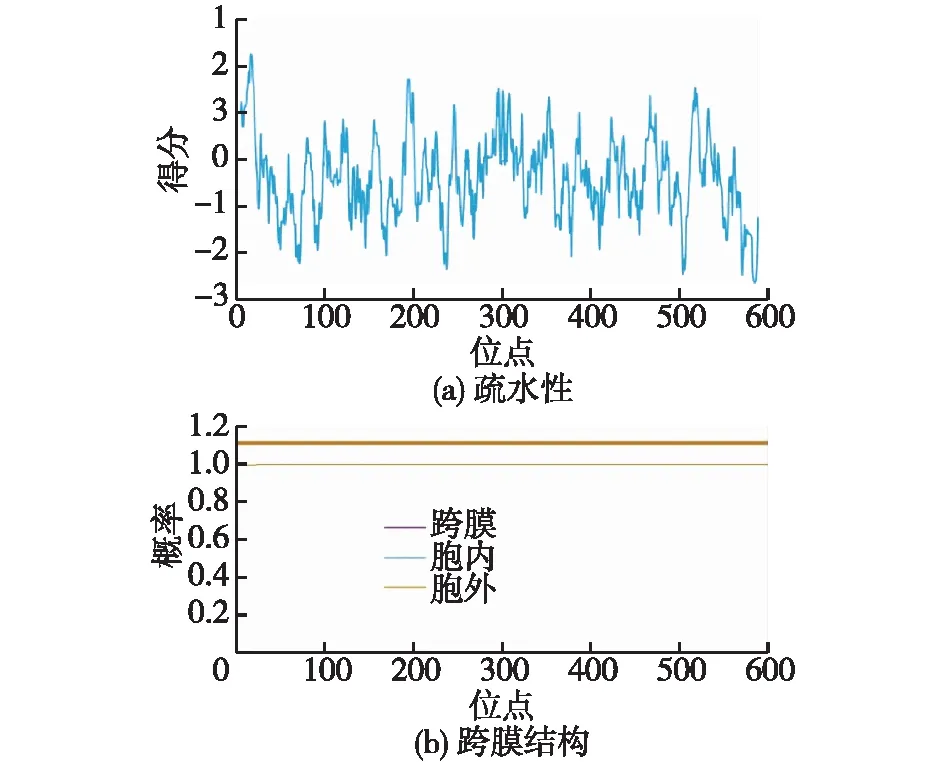
图5 Lcc1蛋白的疏水性和跨膜结构的预测
利用SOPMA、Swiss-Model构建了Lcc1的二级结构及三维结构,如图6所示。由图6可知:在漆酶基因lcc1编码的蛋白Lcc1的二级结构中无规则卷曲占比最高(56.90%),β-转角占比最低(5.72%),与毛头鬼伞Coprinuscomatus漆酶的二级结构为主较为相似[34]。另外,Lcc1的二级结构还包含了10.10%的α-螺旋与27.27%的伸展链。竹黄菌粗漆酶的酶学性质研究结果显示,在超过50 ℃及酸性条件下漆酶均不太稳定,这些酶学性质可能与α-螺旋含量较低而无规则卷曲占比较高有关。刘琨[35]和胡婉峰[36]的结果均表明,α-螺旋结构对维持酶活性至关重要。另外,漆酶的底物非特异性强,具有降解多种底物的能力,这也与无规则卷曲所占比例较高相关,因为无规则卷曲结构提高了酶蛋白的柔韧性或可塑性,并且与底物有效结合过程的能量消耗更低[37]。如果进行进一步研究,则需要对竹黄漆酶进行纯化和结构分析。总的来说,Lcc1呈球状结构,并具有含Cu2+的催化活性中心及氧结合位点,与杏鲍菇Pleurotuseryngtu的漆酶[38]结构相似,符合典型的真菌漆酶结构特点。

图6 Lcc1蛋白的二级及三维结构预测
借助MEGA-X软件,用邻接法构建系统发育树,结果见图7。由图7可知:竹黄菌S8的漆酶基因lcc1编码的氨基酸序列与其他真菌漆酶序列有一定的同源性,其中与壳多孢属真菌Stagonosporasp.的同源性最高(99%),与已报道的竹黄菌Shiraiasp.SUPER-H168的漆酶序列同源性较低(65%),而与来源于白腐真菌的漆酶同源性仅为43%。可见,本研究获得的竹黄漆酶基因是一种全新的基因。本研究为深入挖掘功能性漆酶基因资源提供了参考。
3 结论
竹黄菌Shiraiasp.S8能够通过无性菌丝培养高效合成胞外漆酶,可作为新的漆酶生产候选菌。竹黄菌的粗漆酶在介体作用下可使活性蓝19、孔雀石绿及中性红在60 min内的脱色率在80%以上,在染料废水处理方面具有很大的应用潜力。在后续工作中,可以通过优化竹黄菌发酵条件、添加诱导子等方式进一步增加胞外漆酶的产量;通过漆酶纯化,进一步解析漆酶结构和功能的关系;通过构建重组子实现竹黄漆酶基因的异源表达。同时,进一步研究其对工业染料的脱色工艺,为染料或印染废水的高效治理提供新方案。
