木犀草素介导PERK/eIF2α/CHOP信号通路改善新生大鼠坏死性小肠结肠炎的作用研究
2023-12-10章捷田由吴臻斐黄玲莉
章捷 田由 吴臻斐 黄玲莉
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种以肠道炎症为主要特征的严重胃肠道疾病,多发于新生儿,尤其在早产儿、低体重儿中的发病率更高,是导致新生儿死亡的重要原因之一[1-2]。NEC 发病机制复杂。大量研究表明,内质网应激(endoplasmic reticulum stress,ERS)介导的细胞凋亡与NEC 病程发展密切相关,其中蛋白激酶RNA 样内质网激酶(protein kinase RNA- like endoplasmic reticulum kinase,PERK)/真核翻译启动因子2α(eukayotic translation initiation factor 2α,eIF2α)/CCAAT 增强子结合蛋白同源蛋白(CCAAT enhancer-binding protein homologous protein,CHOP)信号通路是ERS 诱导肠道上皮细胞凋亡的重要途径,而抑制该通路可以改善肠道损伤,延缓NEC 的发病进程[3-4]。因此,有效调控PERK/eIF2α/CHOP 信号通路或许能为治疗NEC 的新药研发提供思路。木犀草素是一种具有抗炎和免疫调节作用的黄酮类化合物,能有效减轻NEC 模型大鼠肠道黏膜损伤,对肠黏膜有保护作用[5-6]。木犀草素还能通过激活PERK、eIF2α、活化转录因子4(activating transcription factor 4,ATF4)、CHOP 等ERS 相关蛋白,进而诱导人胶质母细胞瘤细胞凋亡[7]。但木犀草素能否通过调控PERK/eIF2α/CHOP 信号通路改善NEC,目前尚不明确。因此,本研究通过建立NEC 大鼠模型和NEC 细胞模型,从大鼠体内外水平观察木犀草素对NEC 的影响以及对PERK/eIF2α/CHOP 信号通路的调控作用,进而探讨木犀草素改善NEC 的可能机制,为临床应用提供参考。
1 材料和方法
1.1 实验动物和细胞 无特定病原体的清洁级新生SD 大鼠30 只,雌雄不限,购自上海斯莱克实验动物有限责任公司。大鼠小肠上皮细胞系IEC-6(批号:iCell-r016)购自赛百慷(上海)生物技术股份有限公司。本研究经浙江鹰旸医药研发有限公司实验动物伦理委员会审查通过(批准文号:ZJEY-20221128-06)。
1.2 主要试剂与仪器 木犀草素(粉剂;规格:100 mg/瓶;批号:B20888)、PERK 抑制剂GSK2606414(粉剂;规格:25 mg/瓶;批号:S80279)、4',6-二脒基-2 苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(批号:S19119)均购自上海源叶生物科技有限公司;苏木素(批号:20220425)、伊红(批号:20220417)均购自美国Sigma公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)试剂盒(批号:117831320226)、原位末端转移酶标记(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling,TUNEL)试剂盒(批号:11222220513)、BCA 定量试剂盒(批号:120219200721)均购自上海碧云天生物技术有限公司;大鼠TNF-α ELISA 试剂盒(批号:202211)购自泉州市睿信生物科技有限公司;大鼠IL-6 ELISA 试剂盒(批号:864895-008)购自美国Thermo公司;PERK抗体(批号:23M5315)、磷酸化PERK(p-PERK)抗体(批号:87p8121)、eIF2α抗体(批号:55h2355)、磷酸化eIF2α(p-eIF2α)抗体(批号:83H9328)、CHOP 抗体(批号:55Y1643)均购自美国Affinity 公司。Micro17R 低温高速离心机、BB150细胞培养箱均购自美国Thermo 公司;TP1020 脱水机、RM2235 病理切片机均购自上海徕卡仪器有限公司;BMJ-IB 包埋机购自天津天利航空机电有限公司;Nikon Eclipse Ci-L 正置光学显微镜购自日本Nikon 公司;AE2000 光学显微镜购自中国Motic 公司;610020-9Q 化学发光仪购自上海勤翔科学仪器有限公司;BX63 电动荧光显微镜购自日本奥林巴斯公司。
1.3 动物实验
1.3.1 动物建模、分组与处理 (1)NEC 新生大鼠模型建立:取24 只新生大鼠置于含100%氮气的缺氧箱中90 s 后立即取出,置于4 ℃冰箱中10 min,每12 h 进行1 次上述缺氧冷刺激,连续3 d,建立NEC 新生大鼠模型[8]。(2)动物分组:将建模后的新生大鼠按随机数字表法分为木犀草素17.5 mg/kg 组、木犀草素35 mg/kg组、木犀草素70 mg/kg 组、模型组,每组6 只;剩余6 只新生大鼠设为正常组。(3)动物处理:用药的3 组新生大鼠分别予相应剂量的木犀草素(均溶于0.1 mL 0.9%氯化钠溶液中),其余两组新生大鼠仅予0.1 mL 0.9%氯化钠溶液,均灌胃1 次/d,连续4 d。5 组新生大鼠均在笼中鼠乳喂养,于第5 天予二氧化碳安乐死处理,采集大鼠眼眶血备用,剖腹取结肠组织备用。
1.3.2 大鼠肠道组织病理学变化观察 采用HE 染色。取大鼠肠道组织,4%多聚甲醛溶液固定,石蜡包埋,5 μm 切片,脱蜡水合,HE 染色。在正置光学显微镜观察采集大鼠肠道组织病理学变化并采集图片。
1.3.3 大鼠肠道组织细胞凋亡检测 采用TUNEL法。取大鼠肠道组织,切成5 μm 薄片,烤片30 min,脱蜡水化。滴加20 μg/mL不含DNase的蛋白酶K,在37 ℃下处理30 min。甩干后使用PBS配置的0.1%Triton在室温下孵育组织样本20 min。随后滴加TdT酶、dUTP、buffer,置于37 ℃恒温箱孵育2 h。使用PBS洗涤3次,5 min/次。移除PBS后滴加DAPI染液,置于避光室温下孵育10 min。使用抗荧光淬灭剂封片,在荧光显微镜下观察结果,利用Image-Pro Plus 6.0软件计算细胞凋亡率。细胞凋亡率=(TUNEL阳性细胞数/观察细胞总数)×100%。
1.3.4 大鼠肠道组织及血清中TNF-α、IL-6 水平检测 采用ELISA 法。(1)取大鼠肠道组织,PBS 冲洗,剪碎,制备组织匀浆,6 711 r/min 离心5 min,取上清液检测大鼠肠道组织中TNF-α、IL-6 水平。(2)取大鼠眼眶血,3 500 r/min 离心15 min,取上清液检测大鼠血清中TNF-α、IL-6 水平。
1.3.5 大鼠肠道组织PERK/eIF2α/CHOP 信号通路相关因子表达水平检测 采用Western blot 法。根据试剂盒提示步骤提取大鼠肠道组织蛋白,采用BCA 法测定样品浓度,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转移至聚偏二氟乙烯膜上,封闭,孵育1.5 h,洗膜,加入一抗(PERK、p-PERK、eIF2α、p-eIF2α、CHOP),4 ℃孵育过夜,加入二抗,室温孵育1 h,洗膜。在暗室中曝光显影,使用Quantity One 凝胶分析软件测定蛋白条带灰度值,计算p-PERK 与PERK、p-eIF2α 与eIF2α、CHOP 与甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)条带灰度值的比值。
1.4 细胞实验
1.4.1 细胞建模与分组 (1)NEC 细胞模型建立:将大鼠肠上皮细胞系IEC-6 置于100 μg/mL 脂多糖溶液中刺激3 h[9]。(2)细胞分组:①将建模后的IEC-6 细胞接种于6 孔板,细胞浓度设为1×106个/孔,按随机数字表法分为木犀草素5 μmol/L 组、木犀草素10 μmol/L组、木犀草素20 μmol/L 组、模型组,另取未行脂多糖处理的IEC-6 细胞设为正常组(仅予0.9%氯化钠溶液),使用移液枪分别加入相应药物后,均在37 ℃、95%O2+5%CO2的细胞培养箱中培养24 h。②另取建模后的IEC-6 细胞接种于6 孔板,细胞浓度设为1×106个/孔,分为GSK2606414 0.5 μmol/L 组、GSK2606414 1.0 μmol/L 组、GSK2606414 2.0 μmol/L 组、GSK2606414 4.0 μmol/L 组、模型组(仅予0.9%氯化钠溶液),使用移液枪分别加入相应药物后,于细胞培养箱中培养24 h。以上实验每组设3 个复孔,结果取平均值。
1.4.2 IEC-6 细胞存活率检测 采用MTT法。取各组IEC-6 细胞制备成细胞悬液,经不同浓度木犀草素或GSK2606414干预处理后,加入10 μL MTT溶液培养2 h;使用酶标仪测定波长450 nm 处的吸光度值,计算细胞存活率。后续细胞实验选择细胞存活率最高的药物浓度(木犀草素20 μmol/L,GSK2606414 4.0 μmol/L)作为干预浓度,增设木犀草素20 μmol/L+GSK2606414 4.0 μmol/L 组。
1.4.3 IEC-6 细胞中TNF-α、IL-6 水平检测 采用ELISA法。取IEC-6细胞培养液,2 000~3 000 r/min离心20 min,取上清液检测IEC-6细胞中TNF-α、IL-6水平。
1.4.4 EC-6 细胞中PERK/eIF2α/CHOP 信号通路相关因子表达水平检测 采用Western blot 法。根据试剂盒提示步骤提取EC-6 细胞总蛋白,后续步骤与1.3.5所描述的基本相同。
1.5 统计学处理 采用SPSS 16.0 统计软件和Graph-Pad Prism 9.0 软件。计量资料以表示,若方差齐时多组间比较采用单因素方差分析的Tukey 检验,若方差不齐多组间比较采用Dunnett'sT3检验。P<0.05 为差异有统计学意义。
2 结果
2.1 木犀草素对NEC 大鼠肠道组织病理学变化的影响 正常组大鼠肠道组织结构基本正常完整,无明显损伤;模型组、木犀草素17.5 mg/kg 组大鼠肠道组织绒毛脱落严重,黏膜下层和(或)固有层严重分离,组织损伤严重;木犀草素35 mg/kg组大鼠肠道组织绒毛脱落分离,组织轻微损伤;木犀草素70 mg/kg 组大鼠肠道组织结构较为完整,绒毛轻微分离,组织损伤较小,见图1。

图1 木犀草素对坏死性小肠结肠炎大鼠肠道组织病理学变化的影响
2.2 木犀草素对NEC 大鼠肠道组织细胞凋亡率的影响 与正常组比较,模型组大鼠肠道组织细胞凋亡率明显较高(P<0.05);与模型组比较,木犀草素17.5 mg/kg 组、木犀草素35 mg/kg 组、木犀草素70 mg/kg组大鼠肠道组织细胞凋亡率均明显较低(均P<0.05),见图2(封三)。
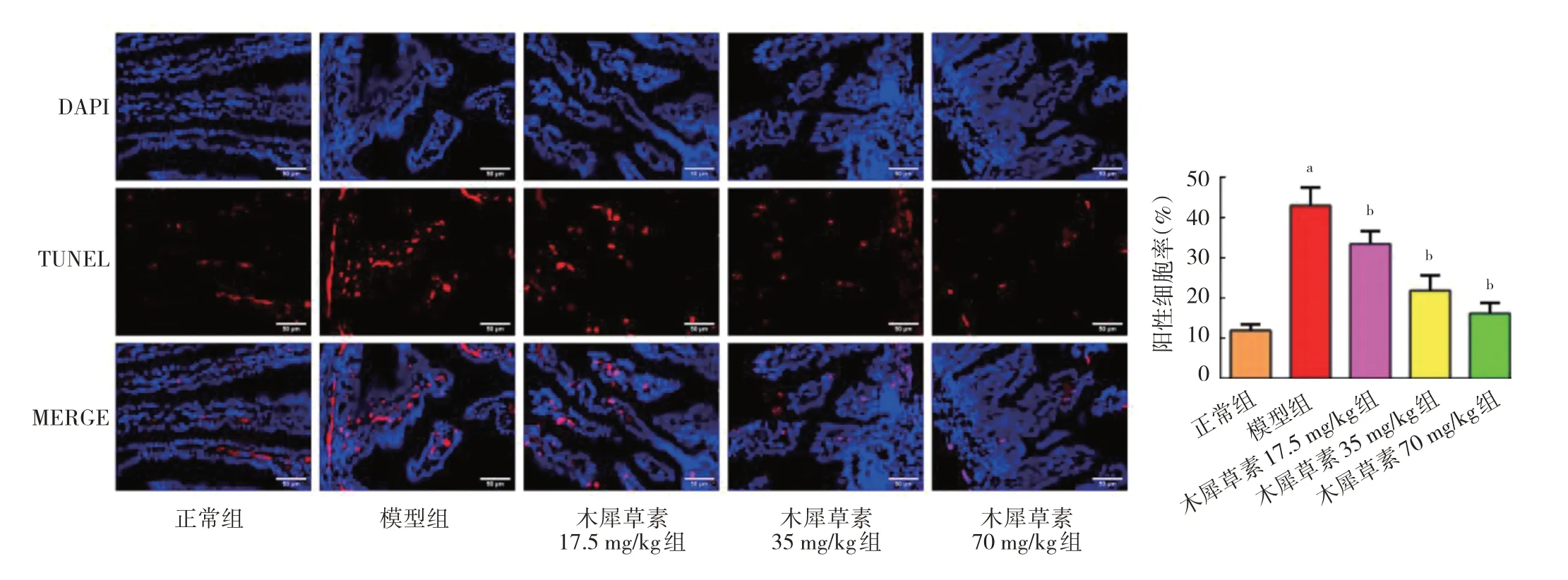
图2 木犀草素对坏死性小肠结肠炎大鼠肠道组织细胞凋亡率的影响
2.3 木犀草素、GSK2606414 对IEC-6 细胞存活率的影响 木犀草素5 μmol/L 组、木犀草素10 μmol/L 组、木犀草素20 μmol/L 组、模型组、正常组细胞存活率分别为(53.29±3.59)%、(68.70±4.55)%、(83.42±6.39)%、(43.39±2.80)%、(100.00±6.35)%,差异有统计学意义(P<0.05);其中模型组细胞存活率较正常组明显下降(P<0.05),木犀草素5 μmol/L 组、木犀草素10 μmol/L 组、木犀草素20 μmol/L 组细胞存活率均较模型组明显升高(均P<0.05),且以木犀草素20 μmol/L组最高(均P<0.05)。GSK2606414 0.5 μmol/L组、GSK2606414 1.0 μmol/L 组、GSK2606414 2.0 μmol/L组、GSK2606414 4.0 μmol/L 组、模型组细胞存活率分别为(66.72± 6.44)% 、(74.61± 7.39)% 、(80.15±7.42)%、(85.57±7.51)%、(52.52±5.17)%,差异有统计学意义(P<0.05);其中GSK2606414 0.5 μmol/L 组、GSK2606414 1.0 μmol/L 组、GSK2606414 2.0 μmol/L 组、GSK2606414 4.0 μmol/L 组细胞存活率较模型组均明显升高(均P<0.05),且以GSK2606414 4.0 μmol/L 组最高(均P<0.05)。故后续细胞实验选择细胞存活率最高的药物浓度(木犀草素20 μmol/L,GSK2606414 4.0 μmol/L)作为干预浓度。
2.4 木犀草素对NEC 大鼠肠道组织、血清及IEC-6 细胞中TNF-α、IL-6 水平的影响 与正常组比较,模型组大鼠肠道组织及血清中TNF-α、IL-6 水平均明显较高(均P<0.05);与模型组比较,木犀草素35 mg/kg 组、木犀草素70 mg/kg 组大鼠肠道组织中TNF-α、IL-6 水平明显较低(均P<0.05),木犀草素17.5 mg/kg 组、木犀草素35 mg/kg 组、木犀草素70 mg/kg 组大鼠血清中TNF-α、IL-6 水平均明显较低(均P<0.05),见表1。与正常组比较,模型组IEC 细胞中TNF-α、IL-6 水平均明显较高(均P<0.05);与模型组比较,木犀草素20 μmol/L 组IEC 细胞中TNF-α、IL-6 水平均明显较低(均P<0.05),见表2。

表1 木犀草素对坏死性小肠结肠炎大鼠肠道组织及血清中TNF-α、IL-6 水平的影响(ng/L)

表2 木犀草素对IEC-6细胞中TNF-α、IL-6水平的影响(ng/L)
2.5 木犀草素对NEC 大鼠肠道组织及IEC-6 细胞中PERK/eIF2α/CHOP 信号通路相关因子表达水平的影响 与正常组比较,模型组大鼠肠道组织中p-PERK/PERK、p-eIF2α/eIF2α、CHOP 表达水平均明显较高(均P<0.05);与模型组比较,木犀草素17.5mg/kg组、木犀草素35mg/kg组、木犀草素70mg/kg组大鼠肠道组织中p-PERK/PERK、p-eIF2α/eIF2α、CHOP表达水平均明显较低(均P<0.05),见图3A。与正常组比较,模型组IEC-6细胞中p-PERK/PERK、p-eIF2α/eIF2α、CHOP表达水平均明显较高(均P<0.05);与模型组比较,木犀草素20μmol/L组IEC-6细胞中p-PERK/PERK、p-eIF2α/eIF2α、CHOP表达水平均较低(均P<0.05);与木犀草素20μmol/L组比较,木犀草素20μmol/L+GSK26064144.0μmol/L组IEC-6细胞中p-PERK/PERK、p-eIF2α/eIF2α、CHOP表达水平均明显较低(均P<0.05),见图3B。
3 讨论
NEC 发病机制较为复杂,早期以肠道炎症为主要特征,随疾病发展,可导致小肠上皮细胞凋亡、坏死,严重时可引发多器官衰竭和全身脓毒血症,最终造成死亡[10-11]。因此,抑制肠道炎症、减少小肠上皮细胞凋亡对于有效治疗NEC 尤为重要。但目前对于NEC 的治疗方法以外科手术治疗和内科保守治疗为主,前者易导致多种并发症,后者往往疗效不佳且不良反应较多,目前尚无统一有效的临床治疗措施[12-13]。本研究使用的木犀草素源于多种药用植物的活性成分,具有抗炎和调节免疫的生物活性,可有效改善NEC 模型大鼠肠道损伤,缓解其发病进程[5-6]。相关研究表明,木犀草素具有减轻组织损伤、减少细胞凋亡和增强细胞活性的作用[14]。本研究以缺氧冷刺激法建立NEC 大鼠模型,HE 染色结果显示,与模型组比较,木犀草素35 mg/kg 组、木犀草素70 mg/kg 组大鼠肠道组织绒毛分离减少,组织损伤明显改善,这说明木犀草素对肠道组织结构和功能具有显著改善作用。TUNEL 染色结果显示,与模型组比较,不同浓度木犀草素干预后的NEC 大鼠肠道组织细胞凋亡率均明显下降,说明木犀草素可抑制肠道组织细胞凋亡。同时,本研究采用脂多糖刺激法建立NEC 细胞模型,MTT 结果显示,与模型组比较,木犀草素5 μmol/L 组、木犀草素10 μmol/L 组、木犀草素20 μmol/L 组IEC 细胞存活率均明显升高,其中木犀草素20 μmol/L 组作用最显著,说明木犀草素能够提高小肠上皮细胞存活率。以上研究结果与Vukelic 等[14]研究结果相符。
炎症反应在NEC 的发生、发展中起着关键作用。多项研究表明,TNF-α、IL-6 水平与NEC 早期诊断和预后评估有关[15]。TNF-α 是体内重要的核转录调节因子,在感染、腹泻等多种应激源的诱导下转导到细胞核中,可介导多种信号转导通路,参与炎症反应和免疫反应[16]。Schreurs 等[17]研究表明,胎儿CD4 效应记忆T 细胞可通过分泌TNF-α 细胞因子在生命早期介导严重的细胞炎症,进而引发NEC。IL-6 是人体重要的促炎介质,能诱导许多炎症细胞和炎症介质的释放,是导致炎症级联反应和平衡障碍的关键因素之一。Guo等[18]研究表明,IL-6 水平与肠道生理和病理状态密切相关。本研究结果显示,与模型组比较,经不同浓度木犀草素干预处理后的NEC 大鼠肠道组织、血清以及IEC 细胞中TNF-α、IL-6 水平均明显下降,说明木犀草素可通过抑制炎症介质TNF-α、IL-6 的释放来减轻组织炎症,进而延缓疾病进程,这可能与木犀草素能够通过调控促炎介质、调节促炎基因表达以及调节炎症小体发挥抗炎作用等有关[19]。
ERS 是机体面对多种刺激因素和损伤因子进行适应环境的自我调整,在NEC 的发病过程中发挥关键作用,其增加会引起小肠上皮细胞凋亡或坏死,最终导致NEC 的发生[20]。当发生ERS 时,内质网通过未折叠蛋白反应(unfolded protein response,UPR)维持其正常功能并促进细胞存活,但是如果刺激过强或持续过久,UPR 不能恢复内质网的稳态,则会启动凋亡途径,损害组织器官[20]。PERK/eIF2α/CHOP 信号通路是ERS诱导细胞凋亡的重要通路之一。研究发现,当内质网中存在较多未折叠蛋白时,葡萄糖调节蛋白会与PERK 分离,从而激活PERK,随后eIF2α 通过磷酸化阻断蛋白质合成,但持续的应激会增加ATF4 的翻译,促进CHOP 的表达,进而激活PERK/eIF2α/CHOP 信号通路,介导细胞凋亡[3-4,21]。本研究MTT 结果显示,与模型组比较,给予GSK2606414 干预后的IEC 细胞存活率明显升高,其中GSK2606414 4.0 μmol/L 组作用最显著,提示抑制PERK 蛋白可提高小肠上皮细胞活性,木犀草素可能通过调控PERK 蛋白来减少细胞凋亡,并增加细胞活性。Western blot 检测结果显示,与模型组比较,经木犀草素干预处理后的NEC 大鼠肠道组织、血清以及IEC 细胞中p-PERK/PERK、p-eIF2α/eIF2α、CHOP 表达水平均明显降低,而加入GSK2606414 后木犀草素对PERK/eIF2α/CHOP 信号通路的抑制作用进一步加强,进一步说明木犀草素可通过抑制PERK/eIF2α/CHOP 信号通路来减少NEC 肠道组织细胞的凋亡、坏死。
综上所述,木犀草素可有效改善新生大鼠NEC,其作用机制可能与下调TNF-α、IL-6 以及p-PERK/PERK、p-eIF2α/eIF2α、CHOP 表达水平进而抑制炎症反应有关,这为临床NEC 的治疗提供理论参考。
