钙化型腰椎间盘突出与腰椎经皮内镜手术术中腰痛的关系
2023-12-08黄良诚刘亦恒
黄良诚,刘亦恒,黄 鹏
腰椎间盘突出症是引起腰腿疼痛、脊柱功能受限的一种常见疾病,尤其好发于中青年,常导致活动量及工作能力的降低。治疗上以减压受压迫的神经为目的,需要对退变的腰椎间盘进行手术切除。腰椎经皮内镜髓核切除术(percutaneous endoscopic lumbar discectomy,PELD)是目前经皮小切口电视内窥镜监视下切除退变椎间盘的成熟术式之一,多项研究报道其治疗各种类型的腰椎间盘突出症效果明显[1-4]。笔者在临床工作中发现,局麻下进行钙化型腰椎间盘突出症PELD术中,患者时常主诉腰痛剧烈,甚至难以继续耐受手术。贺明等[5]曾提出腰椎间盘突出类型与术前疼痛程度的相关性,那么钙化型腰椎间盘突出这一特殊类型是否与PELD术中腰痛程度存在关系,目前尚无文献报道。笔者于解放军总医院骨科2019-01至2021-12采取PELD治疗腰椎间盘突出症的患者88例,探讨钙化型腰椎间盘突出与PELD术中腰痛程度的关系,为临床工作提供参考。
1 对象与方法
1.1 对象 行腰椎经皮内镜髓核切除术治疗腰椎间盘突出症患者88例,麻醉方式采用1%利多卡因逐层浸润麻醉。纳入标准:临床诊断为单节段的腰椎间盘突出症,手术节段为侧入路,经严格非手术治疗至少3个月效果不满意。排除标准:诊断为双节段及以上腰椎间盘突出症,合并腰椎不稳,影像学资料有椎体后缘骨化、离断[6],存在马尾神经综合征、严重运动神经功能受损,预计术中交流困难或难以配合者。
1.2 分组方法 参考高磊等[7]的影像学分类方法,根据术前腰椎间盘CT将患者分为间盘钙化组和非钙化组(图1)。

图1 腰椎间盘CT
1.3 治疗方法 两组均采取单侧椎间孔入路进行手术。按照张琳等[8]的改良YESS技术进行穿刺和手术,直至硬膜囊及神经根充分减压,并检查椎管内有无遗漏间盘组织。非钙化组使用各型髓核钳及双极射频在内镜直视下切除突出退变的腰椎间盘组织,并松解粘连的神经根。钙化组参考高琨等[9]的方法,采用旋转工作套管将神经根及硬膜囊保护在斜面外,使用镜下可变角度的动力刨削系统配合各型髓核钳及双极射频在内镜直视下切除突出退变的腰椎间盘组织,包括部分或全部切除间盘组织钙化物,并松解粘连的神经根。术后予以甘露醇神经脱水3 d、甲钴胺营养神经治疗1个月,必要时应用非甾体类药物止痛治疗;腰围保护下活动3个月,术后行下肢直腿抬高及腰背肌功能锻炼[10]。
1.4 评估方法 术中常规采用钳夹和电凝两种处理方式接触到突出的退变间盘组织时,即时记录两组患者局部腰痛的平均视觉模拟评分(visual analog score,VAS);术后记录患者对手术过程满意度,分为优、良、中、差。优良率(%)=(优+良)/总数×100%。
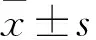
2 结 果
2.1 一般资料比较 88例患者中,7例因精神紧张配合不佳无法获得完整即时随访,失访率为7.95%。其余81例获得完整即时随访,其中钙化组21例,男18例,女3例;非钙化组60例,男40例,女20例。两组一般资料(性别、年龄、手术节段)比较无统计学差异(表1)。

表1 钙化组与非钙化组腰椎间盘突出患者一般资料
2.2 术后情况 6例(钙化组5例、非钙化组1例)术后感术侧下肢皮肤麻木,予甘露醇脱水、甲钴胺营养神经治疗后症状好转,术后3~5 d出院;2例(均为钙化组)术中出现硬膜囊破裂、脑脊液漏,术后予以平卧位绝对卧床7~10 d,并适当补液、床上积极行直腿抬高锻炼,症状好转无遗留后出院;余患者均于术后3 d内出院。所有患者在院期间均未出现椎间隙感染、腹腔血管和脏器损伤等并发症。
2.3 VAS疼痛、术中满意度Macnab评级优良率分析 非钙化组钳夹及电凝退变间盘组织时VAS评分低于钙化组,术中满意度优良率高于钙化组,差异均有统计学意义(P<0.05,表2)。
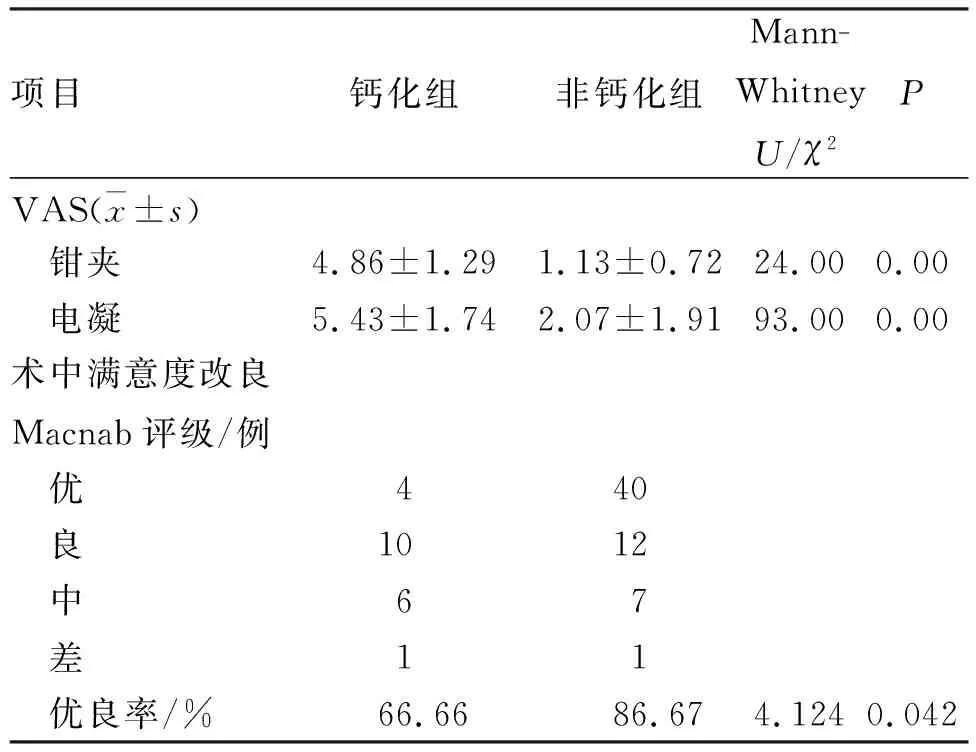
表2 钙化组与非钙化组腰椎间盘突出患者术中刺激退变间盘VAS评分
3 讨 论
3.1 钙化型腰椎间盘突出的病理特点及与术中疼痛的关系 间盘组织包括中央的髓核和外周的纤维环,其营养来源主要是两个途径,纤维环渗透途径(营养外层纤维环)和终板-间盘渗透途径(营养髓核及内层纤维环)[11]。Velnar等[12]实验证实营养来源以终板-间盘渗透途径为主,与作为主要营养来源的椎体微血管分布集中于终板中央部分而外周部分分布较少有关。Yu等[13]认为钙化型腰椎间盘突出的发病特点是纤维环破裂后的间盘突出,突出部分的终板-间盘渗透途径血供中断,而突出间盘局部压迫组织引起炎症且反复炎症反应使周围血管组织包绕侵入,局部突出的间盘组织水分进一步减少、钙盐沉积而来。笔者在术中观察到,钙化的腰椎间盘突出组织中,因钙化的髓核位置比较固定,使得突出物形成硬卡压、容易和腰神经根形成粘连,这与夏俊男等[14]的结论一致。粘连处可能被局部的神经末梢及血管组织包绕,当术中采取钳夹和电凝,即有物理和化学刺激钙化间盘组织时,容易激惹周遭的末梢神经并引起局部炎症,导致剧烈疼痛;钙化髓核的部位与后纵韧带粘连较紧,有时候钙化会延伸至后纵韧带[15],而后纵韧带与硬膜囊位置相近,刺激钙化髓核可能会表现为腰部的疼痛。本研究两组患者在局麻下处于清醒状态,能在术者处理退变突出的椎间盘时,明确地反映出疼痛的部位及程度,结果表明,钙化组的钳夹及电凝的腰痛VAS均较非钙化组高且存在统计学差异,且钙化组的患者术中满意度较非钙化组低。
3.2 腰痛原因的思考及延伸 腰痛是腰椎退变疾病的主要临床症状,其中腰椎间盘突出症是主要的病因。而腰椎间盘突出仅是腰椎整体功能结构退变的表现之一,除了纤维环破裂导致部分退变的间盘突出,还有终板的退变,腰椎生物力学改变带来的生理曲度改变,骨性结构形态变化(椎体边缘骨赘增生、关节突关节骨质增生肥大)和椎管内黄韧带的肥厚改变。本研究中钙化型腰椎间盘突出引起的术中腰痛剧烈,尤其是引发了与患者长期慢性腰痛相似的局部腰痛症状,且在程度上更加剧烈。因此,笔者提出思考,是否可以认为部分患者腰痛的原因之一是钙化间盘所致?同时,腰椎间盘钙化位置的神经纤维支配,有可能跟后纵韧带相仿,都是双侧支配,是否可以从双侧进行麻醉,是值得考虑的问题。另外,利多卡因对于钙化表面和深层的作用,是否可以在术中,吸除镜野内液体后,再次进行利多卡因局部浸润麻醉。
本研究的不足:结果建立于患者的主观描述量化,如需明确间盘钙化与PELD术中腰痛的关系,可能需要对切除的间盘组织(尤其是钙化组织)进行病理分析,同时采取术中神经电监测来明确患者疼痛时的神经电生理变化。可细化不同手术步骤时的术中腰痛,以进一步验证钙化型腰椎间盘突出与PELD术中腰痛程度的关系。
