仙草提取物对大肠杆菌的抑制作用
2023-12-08胡国庆梁永恒张誉文李萍马朝阳谭冠晖
胡国庆,梁永恒,张誉文,李萍,马朝阳,谭冠晖*
(1.广西工业职业技术学院,广西 南宁530001;2.江南大学食品学院,江苏 无锡 214122)
沙门氏菌、金黄色葡萄球菌、大肠杆菌等食源性致病菌是导致食品腐败的主要因素,误食后会导致多种健康问题,如口腔溃疡和肠胃炎[1]。尽管大多数存在于肠道中的大肠杆菌菌株没有害处,但依然存在诱发肠内和肠外感染的风险[2],传统的抗生素处理易导致耐药菌株的增加并造成肠道菌群失调[3]。因此,开发天然生物防腐剂避免食品中大肠杆菌污染,对食品生产和食品安全具有重要意义。
仙草(Hsian-tsao,HST)又名仙人草、仙人冻、薪草、凉粉草(MesonachinesisBenth)等,为唇形科仙草属一年生草本植物,是一种重要的药食两用植物资源[4],分布于我国的广东、福建、广西、江西、海南、浙江、台湾和云南等地。研究表明,仙草提取液可抑制禽大肠杆菌、金黄色葡萄球菌等多种食源性致病菌(如枯草芽孢杆菌、铜绿假单胞、黑曲霉)的体外增殖[5-7]。仙草中迷迭香酸可以改变细菌细胞膜的渗透性[8-9],使糖和蛋白质漏出胞外,同时还影响蛋白质代谢。当迷迭香酸作用于金黄色葡萄球菌时,它可以影响细菌糖的代谢并抑制生物膜的生长和形成[10],它也可以作为Taq DNA聚合酶抑制剂来抑制细菌DNA 复制[11]。总结文献发现,仙草中萜类成分(以齐墩果酸和熊果酸为代表)[12]具有抑菌作用,其含有的酚酸类成分(以迷迭香酸为代表)、黄酮类成分(以芦丁为代表)等在其他提取物中被证明也具有抑菌作用[13-14],同时测定三类代表成分在仙草提取物中的含量及其对应最小抑菌浓度(minimal inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC) 的研究鲜见报道。基于此,本研究旨在探究仙草提取物对大肠杆菌的体外抑制效果,挖掘并验证发挥关键抑制作用的功能成分,测定仙草提取物在MBC 和MIC 浓度下对细胞活力的影响,以期为开发与仙草相关产品提供参考。
1 材料与方法
1.1 材料与试剂
仙草:广西玉林;大肠杆菌CMCC 44102:北京生物制品研究所;穆勒·亨顿(Mueller Hinton,MH)肉汤培养基、营养琼脂培养基:青岛高科技工业园海博生物技术有限公司;碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒:南京建成生物工程研究所;芦丁标准品(≥98%):中国广州分析测试中心;迷迭香酸标准品、咖啡酸标准品、异槲皮苷标准品、紫云英苷标准品、齐墩果酸标准品、熊果酸标准品(纯度均≥98%):北京北方伟业计量技术研究院有限公司。
1.2 仪器与设备
1260 液相色谱仪:安捷伦科技有限公司;Laboratory-4011 旋转蒸发仪:海道尔夫仪器设备(上海)有限公司;Multiskan FC 酶标仪:赛默飞世尔科技公司;ZY-300IV 多功能微生物自动测量分析仪:北京先驱威锋技术开发公司;TU-1901 分光光度计:北京普析通用仪器有限责任公司;MEDIFRIGER BL-S 离心机:西班牙J.P.Selecta 公司;DDSJ-308A 电导率仪:上海仪电科学仪器股份有限公司。
1.3 试验方法
1.3.1 提取物的制备
参考文献[12,15]的方法,分别称取干燥的仙草全草、叶和茎粉末各30 g,溶解于500 mL 70%乙醇,60 ℃水浴3 h 后4 500 r/min 离心5 min,然后60 ℃、≤0.08 MPa于旋转蒸发仪中浓缩至3.0 mL。
1.3.2 抑菌圈直径的测定
参考文献[16]的方法,取0.1 mL 浓度1.0×106CFU/mL的大肠杆菌CMCC 44102 涂布于平板,采用多功能微生物自动测量分析仪在营养琼脂平皿中等距离放入4 个已消毒的8 mm 不锈钢牛津杯。每个牛津杯中加入200 μL 提取液或无菌水作对照,37 ℃过夜培养后观察抑菌圈大小。
1.3.3 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定
参考文献[17]的方法,取96 孔微量板,采用微量肉汤稀释法测定菌株对仙草提取物的MIC 和MBC。在96 孔板中,以肉眼观察无絮状物或沉淀生成的提取物最低浓度孔中的浓度为MIC。从上述MIC 测定中未见生长的各孔肉汤中取0.1 mL 接种于营养琼脂平板,37 ℃培养16~18 h,仍无菌生长的孔内最低浓度即为MBC。
1.3.4 抑菌物质的测定
1.3.4.1 提取物中芦丁含量的测定
参考文献[18]的方法测定芦丁含量。色谱条件:采用安捷伦Eclipse XDB-C1(84.6 mm×250 mm,5 μm)色谱柱;流动相为A:甲醇-乙腈(1∶10,体积比),B:0.1%磷酸溶液;流速1.0 mL/min;检测波长360 nm;柱温25 ℃,进样量20 μL。
1.3.4.2 提取物中迷迭香酸、咖啡酸、异槲皮苷和紫云英苷含量的测定
参考文献[19]的方法,流动相采用乙腈∶0.1%甲酸不同梯度洗脱,梯度洗脱程序见表1。检测波长:254 nm;柱温:室温;流速:1.0 mL/min;进样量:10 μL。分别进样混合标准样品溶液及仙草样品溶液得高效液相色谱(high performance liquid chromatography,HPLC)图。
1.3.4.3 提取物中齐墩果酸和熊果酸含量的测定
参考文献[20]的方法,流动相为甲醇∶0.5%磷酸水溶液(95∶5,体积比);流速:1.0 mL/min;柱温:室温;检测波长:210 nm;进样量:10 μL。
1.3.4.4 抑菌化合物的MIC 和MBC 测定
称取一定量的迷迭香酸、异槲皮苷、咖啡酸、紫云英苷、熊果酸、齐墩果酸、芦丁标准品溶解于甲醇,然后以1.3.3 方法测定各化合物的MIC 和MBC。
1.3.5 仙草提取物对细胞生长影响
1.3.5.1 仙草提取物对大肠杆菌细胞生长的影响
参考文献[21]的方法,用仙草提取物配制成20 倍MIC 和MBC 浓度的提取物溶液,分别吸取1 mL 加入装有9 mL MH 肉汤培养基的试管中,以等量MH 肉汤培养作为对照组。分别向锥形瓶中加入100 μL 大肠杆菌菌悬液(1×106CFU/mL),充分混匀后,在37 ℃条件下振荡培养24 h。在培养时间为0、3、6、9、12、24 h 时分别取样200 μL 加入到96 孔酶标板中,试验设置3 组重复,测定620 nm 处的吸光度。以吸光度的平均值为纵坐标,培养时间为横坐标,绘制大肠杆菌的生长曲线。
1.3.5.2 仙草提取物对大肠杆菌细胞壁通透性的影响
参考文献[22]的方法,取20 倍MIC 和MBC 浓度的250 μL 提取物,加入5 mL MH 肉汤培养基,混匀后,每管加入50 μL 大肠杆菌菌悬液(1×106CFU/mL),充分混匀后,在37 ℃条件下,分别培养0、1、2、3、4 h 后,取4.0 mL 培养液于10 mL 离心管中,5 000 r/min 离心10 min。取0.1 mL 上清液,按照碱性磷酸酶(ALP)测定试剂盒说明书依次加入缓冲溶液、基质溶液,37 ℃水浴加热15 min,加入显色剂,混匀。取样100 μL 加入至96 孔微量滴定板,在520 nm 处测定吸光度。设置3 组平行试验,以平均吸光度为纵坐标,培养时间为横坐标,绘制仙草提取物对细胞壁通透性的影响曲线。
1.3.5.3 仙草提取物对大肠杆菌细胞膜完整性和通透性的影响
参考文献[22]的方法,分别取20 倍MIC 和MBC浓度的250 μL 提取物,加入5 mL MH 肉汤培养基,混匀,每管加入50 μL 大肠杆菌菌悬液(1×106CFU/mL),充分混匀后,在37 ℃条件下,分别培养0、1、2、3、4 h后,取4.0 mL 菌液,5 000 r/min 离心10 min。取上清液,测定260 nm 处的吸光度。试验设置3 次重复,以平均吸光度为纵坐标,培养时间为横坐标,绘制曲线,以评价仙草提取物对大肠杆菌细胞膜完整性的影响。取上述1 mL 上清液加4 mL 蒸馏水于20 mL 烧杯中,然后使用电导率仪分别测定培养0、1、2、3、4 h 后的培养液电导率参数。
1.4 数据处理
采用GraphPad Prism 9.0 和Origin 2019 进行数据和图形处理,数据表示为平均值±标准差。
2 结果与分析
2.1 仙草提取物抑菌圈的测定结果
图1 为仙草不同部位提取物抑菌圈大小。
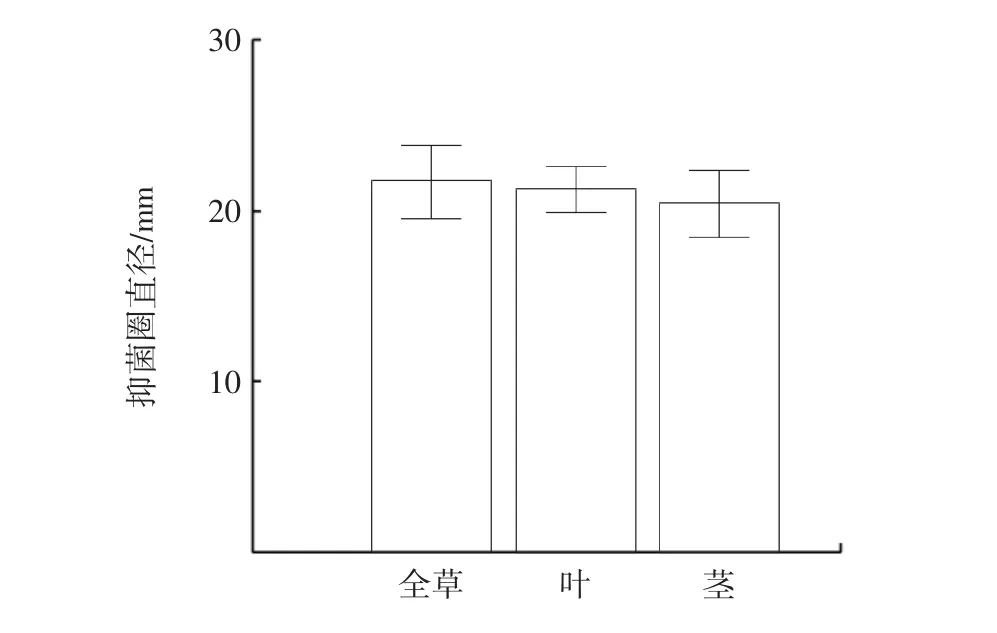
图1 仙草不同部位提取物抑菌圈直径Fig.1 Diameter of inhibition zone extracted from different parts of HST
由图1 可知,利用牛津杯法测得仙草全草、叶、茎提取物对应的抑菌圈直径分别为(21.69±2.15)、(21.23±1.32)、(20.35±1.88)mm,且三者差异不明显。根据抑菌圈大小判断,其抑菌效果极度敏感[12]。刘富来等[5]、曹媛媛等[6]研究表明,大肠杆菌对仙草叶提取液的敏感性较高,仙草不同部位的提取液对不同血清型的禽大肠杆菌敏感性差异较大。本试验发现,大肠杆菌CMCC 44102 并不符合此描述,原因待研究。后续研究使用全草提取物作为试验材料。
2.2 仙草MIC 和MBC 的测定结果
采用微量二倍稀释法测定仙草提取物的MIC 和MBC,结果见图2。
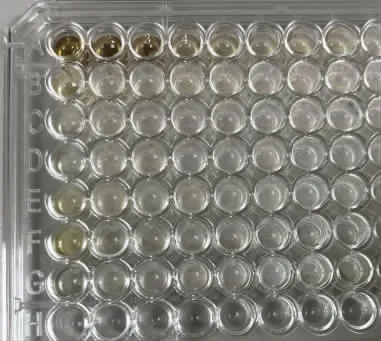
图2 仙草提取物MIC 和MBCFig.2 MIC and MBC of the extract from HST
由图2 可知,在96 孔板中,第3、4 孔里无明显沉淀和浑浊出现。用移液枪移取0.1 mL 培养液涂布于营养琼脂培养基,培养24 h 后发现,第3 孔无菌落生长,第4 孔有少量菌落生长,将其换算成生药浓度,得出仙草提取物对大肠杆菌CMCC 44102 的MIC 为0.17 g/mL(生药浓度),MBC 为0.33 g/mL。
2.3 仙草提取物主要抑菌成分的测定结果
根据文献中记录的有关化合物[11-12],选取了7 种代表化合物,利用标准样品外标法定量,通过液相色谱测定了提取物中其对应的含量,结果如图3所示。
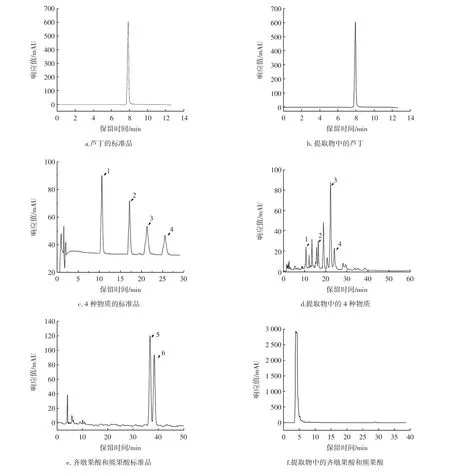
图3 仙草提取物主要抑菌成分色谱图Fig.3 Chromatograms of main antibacterial components of the extract from HST
由图3 可知,在提取液中,芦丁、异槲皮苷、紫云英苷、迷迭香酸和咖啡酸的含量分别为6.63、0.47、0.34、0.32、0.01 mg/g。无论使用70%乙醇、100%甲醇或使用超声提取法[20]对仙草进行提取,得到的提取液中,齐墩果酸和熊果酸均未检出。究其原因可能是仙草提取物中固有的一些自身基质成分复杂,而且齐墩果酸、熊果酸一般在其中的含量不高。据报道,采用固相萃取柱富集[23],可以提高检测灵敏度和准确度,此次研究未进一步实施。
2.4 仙草提取物抑菌成分的抑菌效果
根据液相色谱检测的结果,用甲醇配制对应浓度(熊果酸9.75 mg/mL,齐墩果酸10.15 mg/mL,其余浓度按2.3 检测的结果配制)的化合物,以提取物和甲醇为对照,做牛津杯试验,结果见图4。
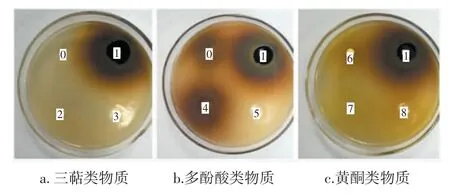
图4 化合物抑菌圈Fig.4 Inhibition zone of compounds
由图4 可知,甲醇对照组没有抑菌圈,提取物对照组抑菌圈明显。化合物中,除了图4b 咖啡酸有抑菌圈,其他化合物均没有明显的抑菌圈,可能与抑菌物质的溶解性及其在培养基的扩散受阻有关。基于此,再利用96 孔板测得迷迭香酸、咖啡酸、芦丁、异槲皮苷、紫云英苷、齐墩果酸、熊果酸的MBC 分别为9.55、10.20、12.10、3.21、1.68、0.68、0.65 mg/mL,对应的MIC分别为4.78、5.10、6.05、1.61、0.84、0.34、0.33 mg/mL。
2.5 仙草提取物对大肠杆菌生长的影响结果
按1%接种量将大肠杆菌接种于MH 肉汤培养基,并将未添加仙草提取物的一组作为对照组,观察终浓度为MBC 和MIC 的仙草提取物对大肠杆菌生长的影响,结果如图5所示。
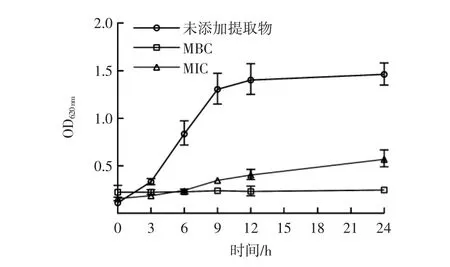
图5 仙草提取物对大肠杆菌生长的影响Fig.5 Effect of the extract from HST on the growth of E.coli
由图5 可知,对照组菌株在3 h 左右,OD620nm明显升高,并进入对数生长期,随后24 h 内按照大肠杆菌正常生长周期开始生长。MIC 组的菌株培养液,约在6 h 后,OD620nm开始升高,但升高趋势整体缓慢,在9 h,开始明显生长,提取物的抑制作用在下降。MBC 组的菌株培养液,24 h 内OD620nm均无明显变化,菌株处于完全抑制状态。
2.6 仙草提取物对大肠杆菌细胞壁通透性的影响结果
利用碱性磷酸酶(ALP)测定试剂盒,测得仙草提取物对大肠杆菌细胞壁通透性的影响,结果如图6所示。
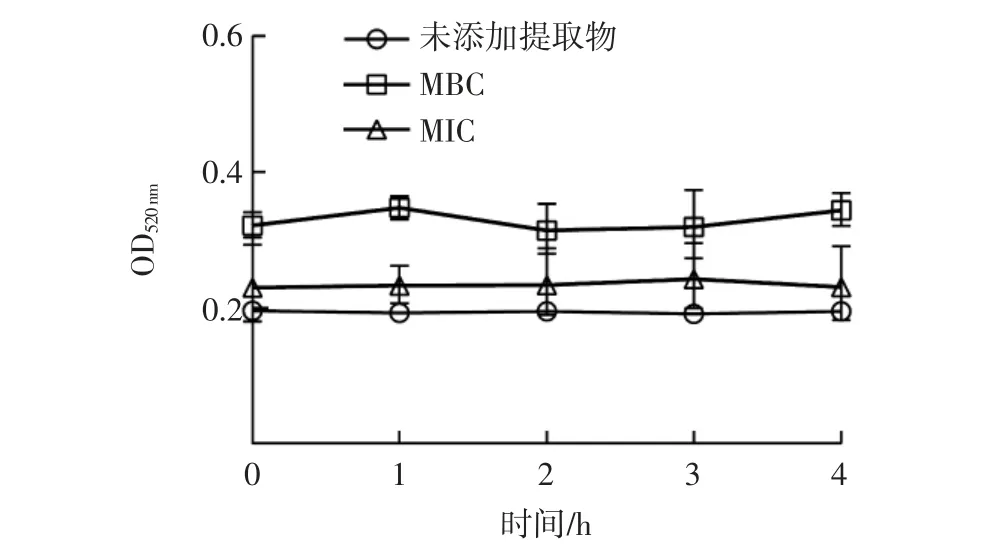
图6 仙草提取物对大肠杆菌细胞壁通透性的影响Fig.6 Effect of the extract from HST on cell wall permeability of E.coli
由图6 可知,MBC 组和MIC 组520 nm 处的吸光度在0~4 h 均高于未添加提取物组,且两者差异明显。据此可推测仙草提取物会破坏大肠杆菌的细胞壁,细胞壁的通透性增加,最终碱性磷酸酶(位于细胞壁与细胞膜之间)渗透出来。MBC 组520 nm 处的吸光度明显高于MIC 组,这说明仙草提取物浓度增加会增强其对大肠杆菌细胞壁的破坏作用,提高了细胞壁的通透性。
2.7 仙草提取物对大肠杆菌细胞膜完整性和通透性的影响结果
仙草提取物对大肠杆菌细胞膜完整性和通透性的影响结果如图7所示。

图7 仙草提取物对大肠杆菌细胞膜完整性和通透性的影响Fig.7 The effect of extract from HST on the integrity and permeability of E.coli
由图7a 可知,0~4 h 内,未添加提取物组的OD260nm没有明显的变化,MBC 组和MIC 组的OD260nm明显升高,且MBC 组增加明显。这表明大肠杆菌细胞膜损失明显,细胞内容大分子物质泄露进入培养液。随着培养时间的延长,MBC 和MIC 组OD260nm逐渐增加,但前者在每个观测时间点均高于后者,由此提示仙草提取物对大肠杆菌细胞膜完整性的影响效应与浓度相关。由图7b 可知,0~4 h,MBC 组和MIC 组的电导率均高于未添加提取物组,这表明仙草提取物的添加能够提高大肠杆菌细胞膜的通透性。随着时间的延长,电导率值不断上升,这说明仙草提取物对细胞膜通透性的破坏作用也增强,细胞内电解质渗透量随之增加。
3 结论
本研究旨在探究仙草提取物对大肠杆菌的抑制作用。通过测定抑菌圈的大小,明确了仙草提取物对大肠杆菌具有显著的抑制效果,并测定了其最小杀菌浓度和最小抑菌浓度。此外,还对仙草提取物中可能具有抑菌作用的7 种化合物进行了检测,结果发现齐墩果酸和熊果酸未被检测到。同时,对这7 种化合物进行了抑菌圈、MBC 和MIC 的验证,结果显示这7 种化合物单独对大肠杆菌的抑制作用不一致。另外研究了仙草提取物对大肠杆菌细胞的影响,发现仙草提取物能够破坏细胞膜的完整性和通透性,导致细胞内的生物大分子泄露和细胞壁破裂,表现出抗大肠杆菌的活性。本研究为仙草提取物在食品生产中的开发应用提供了基础依据。
