狭鳕鱼蛋白肽对腺嘌呤诱导的慢性肾衰竭小鼠的影响
2023-12-08董晶宁侯虎
董晶宁,侯虎
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
慢性肾脏疾病(chronic kidney disease,CKD)已经成为全球性的公共健康问题,每年患病人数不断增长[1-2]。每年患病人数不断增长,高达2.8 亿,发病率和死亡率高,每年死亡人数高达120 万[3-5]。CKD 的致病机制主要途径有渐进性肾脏间质纤维化、肾小管毛细血管缺氧和肾小管萎缩导致的肾脏功能破坏[6],最终导致慢性肾功能衰竭(chronic renal failure,CRF)[7]。CRF的特征是持续性肾小球硬化和肾间质纤维化,造成肾小球滤过率降低,肾脏排泄物质滞留[7]。目前临床上尚未有效针对CRF 的治疗技术,仍有大量早期肾病患者进入终末期透析治疗阶段。
研究表明蛋白质水解物对肾损伤具有一定的保护作用。Nasri 等[8]发现从虾虎鱼中制备得到的肌肉蛋白及其水解物可以抑制高糖饮食诱导小鼠的尿酸及血清肌酐水平的升高,防止肾脏结构变化,改善高热量饮食大鼠的肾损伤。Hidayat 等[9]从营养支持角度出发,探究豌豆蛋白水解物保护肾脏功能的作用,研究结果表明蛋白水解物促进系膜细胞增殖,降低了糖尿病肾小球硬化系膜细胞模型的纤连蛋白和转化生长因子β1(transforming growth factor-β1,TGF-β1)的水平。多肽具有多种生物活性,如抗炎活性[10]、抗氧化活性[11]、促进细胞增殖[12]等,而且营养价值高,吸收性好,作为营养功能组分,在预防疾病恶化方面具有极大的研究潜力。目前关于海洋源多肽对肾脏影响作用的研究较少,而狭鳕鱼的营养价值极高,并且狭鳕鱼蛋白肽具有多种潜在活性[13]。
高浓度的腺嘌呤通过黄嘌呤氧化酶的作用在体内生成极难溶于水的2,8-二羟基嘌呤,沉积于肾小管后发生阻塞,抑制了机体氮质化合物的排泄,造成机体出现氮质血症、毒素蓄积和电解质、氨基酸代谢紊乱,引起的病理特征类似于CRF[14]。腺嘌呤造模具有周期短、死亡率低、技术难度小等优点,已经成为常用的肾病模型[15]。
本研究使用腺嘌呤诱导的慢性肾衰竭小鼠模型,探究狭鳕鱼蛋白肽对肾脏功能、结构以及炎症、纤维化因子的影响,旨在揭示狭鳕鱼蛋白肽对慢性肾衰竭小鼠的影响,以期为狭鳕鱼蛋白肽在肾病预防以及治疗领域的研究提供一定的参考。
1 材料与方法
1.1 材料与试剂
狭鳕鱼:青岛昱顺杰商贸有限公司;胰蛋白酶:南宁庞博生物工程有限公司;蛋白质标准品:美国Sigma公司;尿素氮(blood urea nitrogen,BUN)试剂盒、肌酐(serum creatinine,Scr)试剂盒:南京建成生物工程研究所;反转录试剂盒、荧光定量转录试剂盒:南京诺唯赞生物科技股份有限公司;生理盐水、4%甲醛固定液:国药集团化学试剂有限公司。
1.2 仪器与设备
高效液相色谱仪(Agilent 1260):安捷伦科技(中国)有限公司;质谱仪(QTOF 5600):美国SCIEX 公司;电动显微镜(NIKON/Ni-E):上海通灏光电科技有限公司;超微量分光光度计(Nano-100):美国Thermo Scientific 公司;实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)扩增仪(FQD-96C):杭州博日科技有限公司。
1.3 方法
1.3.1 狭鳕鱼蛋白肽(protein peptides of pollock,THP)的制备
以狭鳕鱼肉为原料,用1.5%胰蛋白酶水解,经灭酶、冷却、100 Da 透析袋除盐,收集透析液,冷冻干燥,得到狭鳕鱼蛋白肽。
1.3.2 THP 理化性质的测定
1.3.2.1 THP 分子量的测定
THP 的分子量分布使用高效液相色谱仪测定[16]。分析柱为TSK GEL G2000 SWXL 300 mm×7.8 mm,流动相为乙腈∶三氟乙酸∶超纯水=30∶0.1∶70(体积比)。所选用的标准品为不同分子量的谷胱甘肽(307 Da)、杆菌肽(1 422 Da)、牛胰岛素(5 733 Da)、细胞色素C(13 500 Da)和牛血清白蛋白(68 000 Da),以标准品分子量的对数(lgM)和保留时间作图,得到标准方程(y=-0.200 1x+7.258 1,R2=0.991),根据标准曲线计算THP 的分子量。
1.3.2.2 THP 氨基酸组成的测定
根据GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》[17],采用氨基酸自动分析仪测定THP 的氨基酸组成。
1.3.2.3 THP 氨基酸评分的计算
根据Hammad 等[18]的方法进行必需氨基酸评分(amino acid score,AAS)计算,计算公式(1)如下。
式中:A为必需氨基酸评分;S为样品蛋白质中氨基酸含量,mg/g;F为联合国粮农组织/世界卫生组织评分标准模式中相应必需氨基酸含量(RPa),mg/g。
1.3.3 慢性肾衰竭小鼠模型的建立和给药方式
慢性肾衰竭小鼠模型的建立参考Wang 等[19]的方法并作一定的修改。6 周龄无特定病原体(specific pathogen free,SPF)级C57BL/6J 雄性小鼠适应性喂养7 d 后随机分组,每组10 只,分别为正常组、模型组、阳性药物组(吡非尼酮药物治疗)、TL 组[THP 400 mg/(kg·d)]、TH 组[THP 800 mg/(kg·d)]。本研究中所有方案和程序经中国海洋大学食品科学与工程学院实验动物护理伦理委员会的审批通过。具体实验分组及给药方式如下。
1)正常组(CON):喂养普通饲料,自由饮水。
2)模型组(CRF):造模期间喂养0.2%腺嘌呤饲料,自由饮水,21 d;造模成功后,换为普通饲料,自由饮水。
3)阳性药物组(PFD):造模期间喂养0.2%腺嘌呤饲料,自由饮水,21 d;造模成功后,换为普通饲料,同时灌胃吡非尼酮混悬液[102 mg/(kg·d)],自由饮水。
4)TL 组、TH 组:造模期间喂养0.2%腺嘌呤饲料,自由饮水,21 d;造模成功后,换为普通饲料,灌胃THP溶液[TL 组400 mg/(kg·d),TH 组800 mg/(kg·d)],自由饮水。
整个实验过程中,每日观察小鼠的生长状态,每周记录小鼠的体质量。药物作用28 d 后,进行眼部取血,然后解剖采取肾脏组织,记录肾脏组织质量,计算肾脏指数(R,mg/g),计算公式(2)如下。
式中:W为肾脏质量,mg;M为体质量,g。
1.3.4 小鼠肾脏组织病理学观察
取小鼠肾脏组织于4%甲醛固定液中48 h,石蜡包埋,使用冷冻切片机得到厚度为4 μm 的切片,对切片进行苏木精-伊红(H&E)染色和马松(Masson)染色,使用电动光学显微镜拍摄染色照片。
1.3.5 小鼠血清生化指标的测定
小鼠禁食12 h 后取材,采集小鼠血液后,于常温下静置1~2 h,使血清分层,6 000 r/min、4 ℃离心40 min,取上层血清,使用试剂盒测定尿素氮、肌酐含量。
1.3.6 小鼠肾脏组织中因子mRNA 水平的测定
称取50~100 mg 肾脏组织,使用Trizol 法提取总mRNA,使用超微量分光光度计测定吸光度(OD 值),OD260/280范围在1.8~2.0 之间表明RNA 纯度较好。根据试剂盒说明进行逆转录得到cDNA,反应体系:总RNA 1 μg;4×g DNA wiper Mix 4 μL;Rnase-free ddH2O 补足至16 μL;42 ℃反应5 min;5×HiScript ⅡqRT SuperMixⅡ4 μL;50 ℃反应15 min;85 ℃反应5 s。cDNA 溶液于-80 ℃冷冻保存。
以cDNA 为模板,以β-肌动蛋白为内参,实时荧光定量PCR 进行定量分析,引物序列见表1。
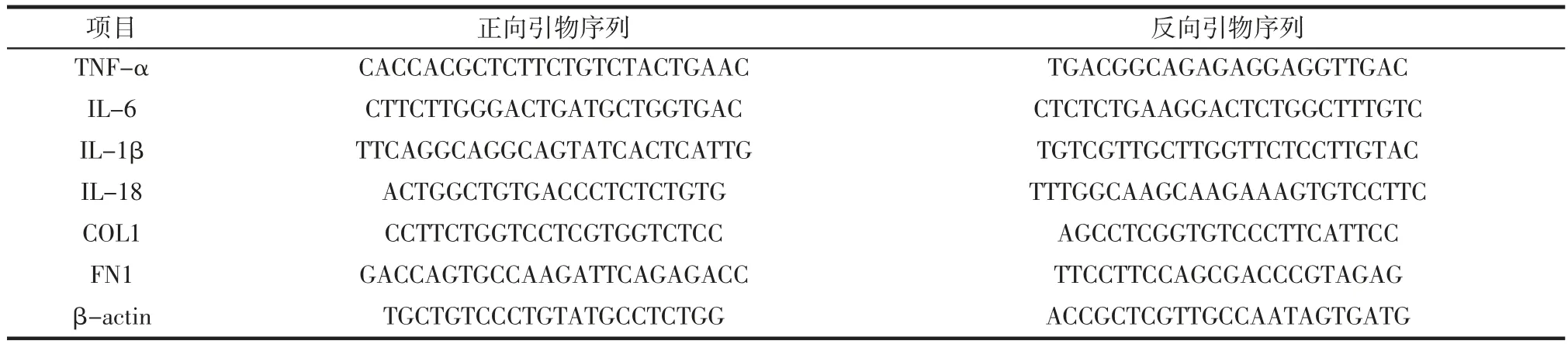
表1 实时荧光定量-PCR 反应的引物序列Table 1 Primer sequences of real time quantitative-PCR
反应体系:cDNA 2 μL;Primer 1(10 μmol/L)0.4 μL;Primer 2(10 μmol/L)0.4 μL;2×ChamQ Universal SYBR qPCR Master Mix 10.0 μL;ddH2O 7.2 μL。扩增程序:预变性95 ℃、30 s;变性95 ℃、10 s,退火60 ℃、30 s,延伸95 ℃、15 s,40 个循环;溶解曲线95 ℃、15 s,60 ℃、60 s,95 ℃、15 s。每个样品设置两个复孔,采用2-△△Ct法进行相对定量分析[20]。
1.4 统计分析
所有实验结果以平均数±标准差表示,单因素方差分析采用SPSS 25.0 以及Graghpad 软件进行分析处理,P<0.05 表示差异显著。
2 结果与分析
2.1 THP 的理化性质测定结果
THP 的高效液相色谱图如图1所示。
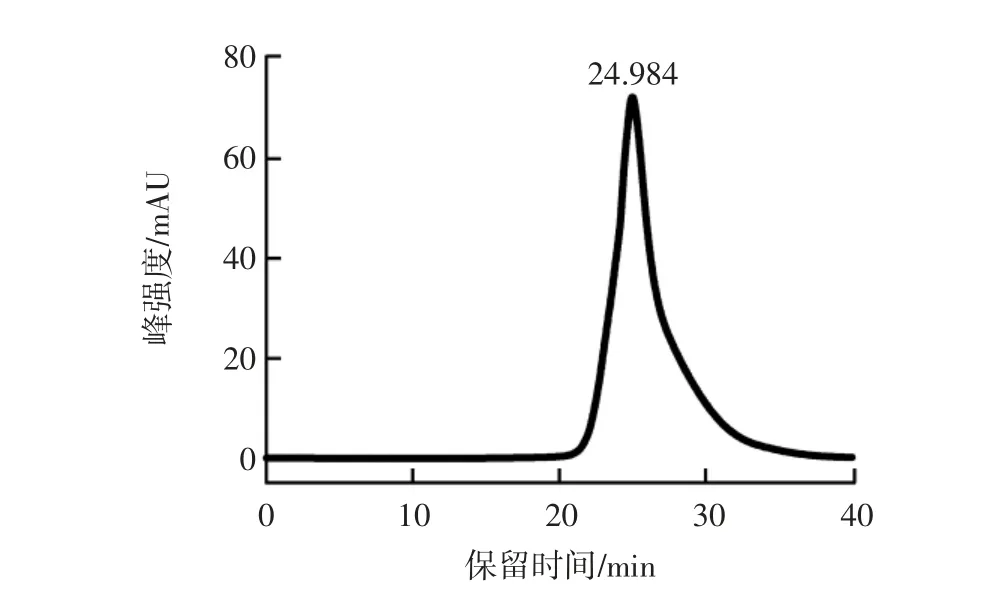
图1 THP 的高效液相色谱图Fig.1 High performance liquid chromatogram of THP
由图1 可知,THP 的出峰时间为24.984 min,计算得分子量为181.47 Da。分子量小于1 000 Da,属于小分子肽,具有结构简单、易于吸收等优点。
THP 的氨基酸组成见表2。
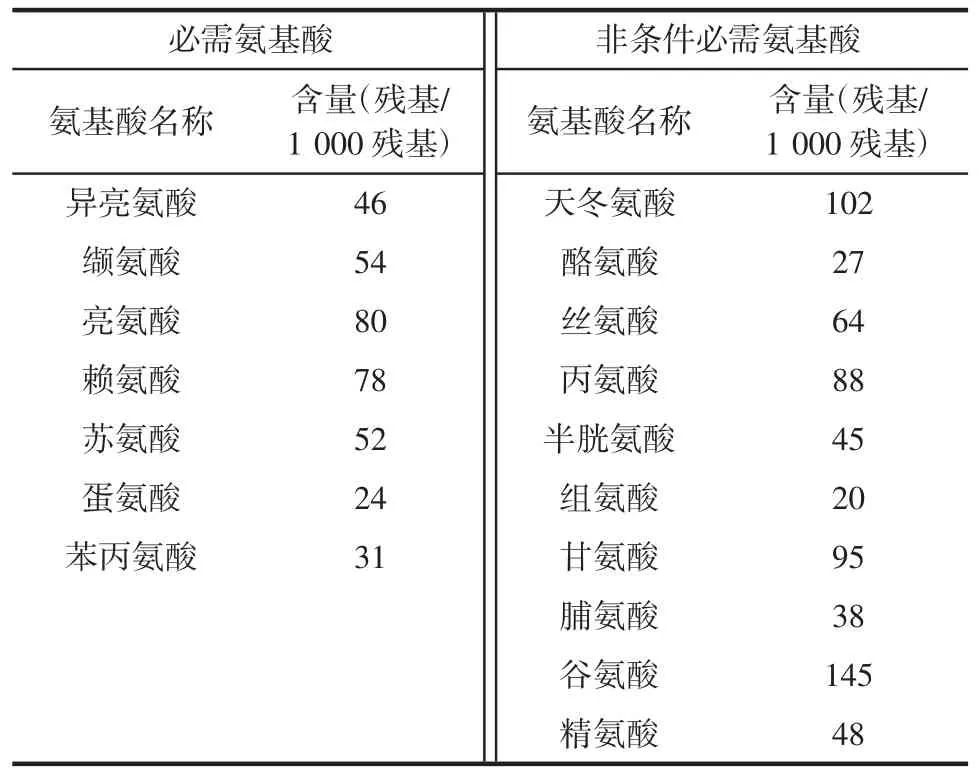
表2 THP 的氨基酸组成Table 2 Amino acid composition of THP
由表2 可知,谷氨酸含量最高,其次是天冬氨酸,甘氨酸、丙氨酸和亮氨酸含量都较高。由表中数据可以看出,氨基酸种类齐全,THP 可以作为一种潜在优质蛋白来源。
THP 的氨基酸评分见表3。
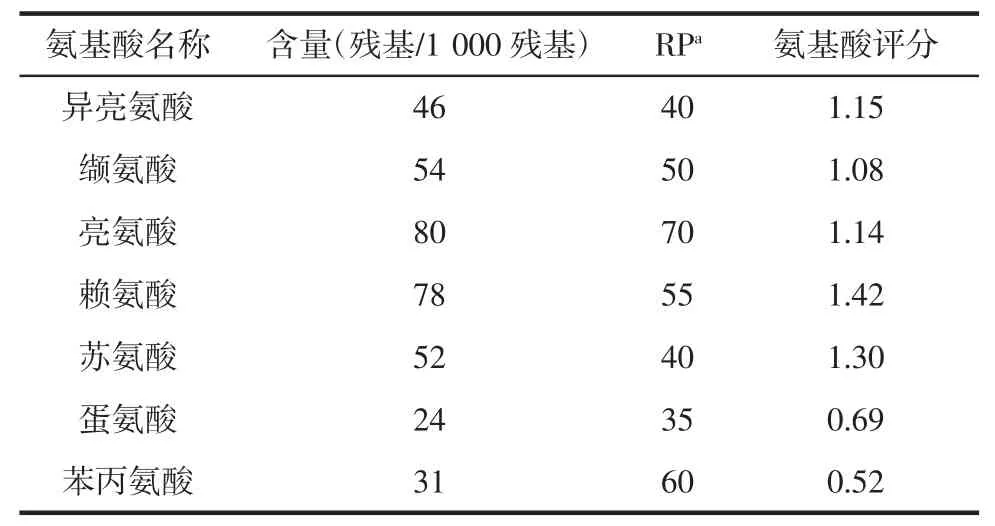
表3 THP 的必需氨基酸评分Table 3 Essential amino acid score of THP
由表3 可知,THP 的必需氨基酸种类齐全且大部分必需氨基酸(异亮氨酸、缬氨酸、亮氨酸、赖氨酸、苏氨酸)的氨基酸评分大于1.0,其氨基酸组成符合人体对氨基酸的需求,说明THP 可以作为一种优质蛋白质来源,为人体提供能量。
2.2 THP 对慢性肾衰竭小鼠的生理状态和脏器指数的影响
THP 对慢性肾衰竭小鼠的体质量和肾脏指数的影响见图2。

图2 THP 对慢性肾衰竭小鼠的体质量和肾脏指数的影响Fig.2 Effects of THP on the body mass and kidney index in the mouse model of chronic renal failure
实验期间,对小鼠的生长状态进行观察。CON 组小鼠反应灵敏,活动力强;皮毛呈现亮黑色且具有光泽度。CRF 组小鼠的精神状态明显下降,反应迟钝,活动力减弱;皮毛光泽度下降且变稀疏;垫料易潮湿,表现出多饮多尿症状,粪便干燥,出现一定程度的血尿。28 d 干预期间,TL、TH 组小鼠活动力明显增强,精神状态好转,皮毛光泽度增加。因此,THP 可以很好地改善慢性肾衰竭小鼠的生长状态。
由图2A 可知,28 d 时,与CRF 组相比,PFD、TH组[800 mg/(kg·d)]的小鼠体质量逐渐增加,而[400 mg/(kg·d)]THP 对慢性肾衰竭小鼠体质量没有明显影响。
组织器官损伤程度可以通过组织器官的质量变化来间接反映,肾脏指数是反映肾功能的半定量指标[21]。干预28 d 后,取各组小鼠的肾脏组织称重、计算肾脏指数。由图2B 可知,CON 组的肾脏指数为12.82 mg/g,CRF 组的肾脏指数为14.69 mg/g。与CON 组相比,CRF肾脏指数极显著上升(P<0.01),表明模型组小鼠出现肾脏损伤和水肿。PFD、TL 组和TH 组的肾脏指数分别为10.27、11.01、10.07 mg/g,与CRF 组相比,PFD 组小鼠的肾脏指数下降(P<0.01),TL组和TH 组小鼠的肾脏指数分别下降了25.05%和31.45%,表明THP 对改善慢性肾衰竭小鼠的肾脏损伤有促进作用。
2.3 THP 对慢性肾衰竭小鼠血清生化指标的影响
上述结果表明,THP 对慢性肾衰竭的肾脏损伤有改善作用。测定慢性肾衰竭小鼠的血清尿素氮和肌酐含量的变化,分析THP 对肾脏功能的影响,结果见图3。
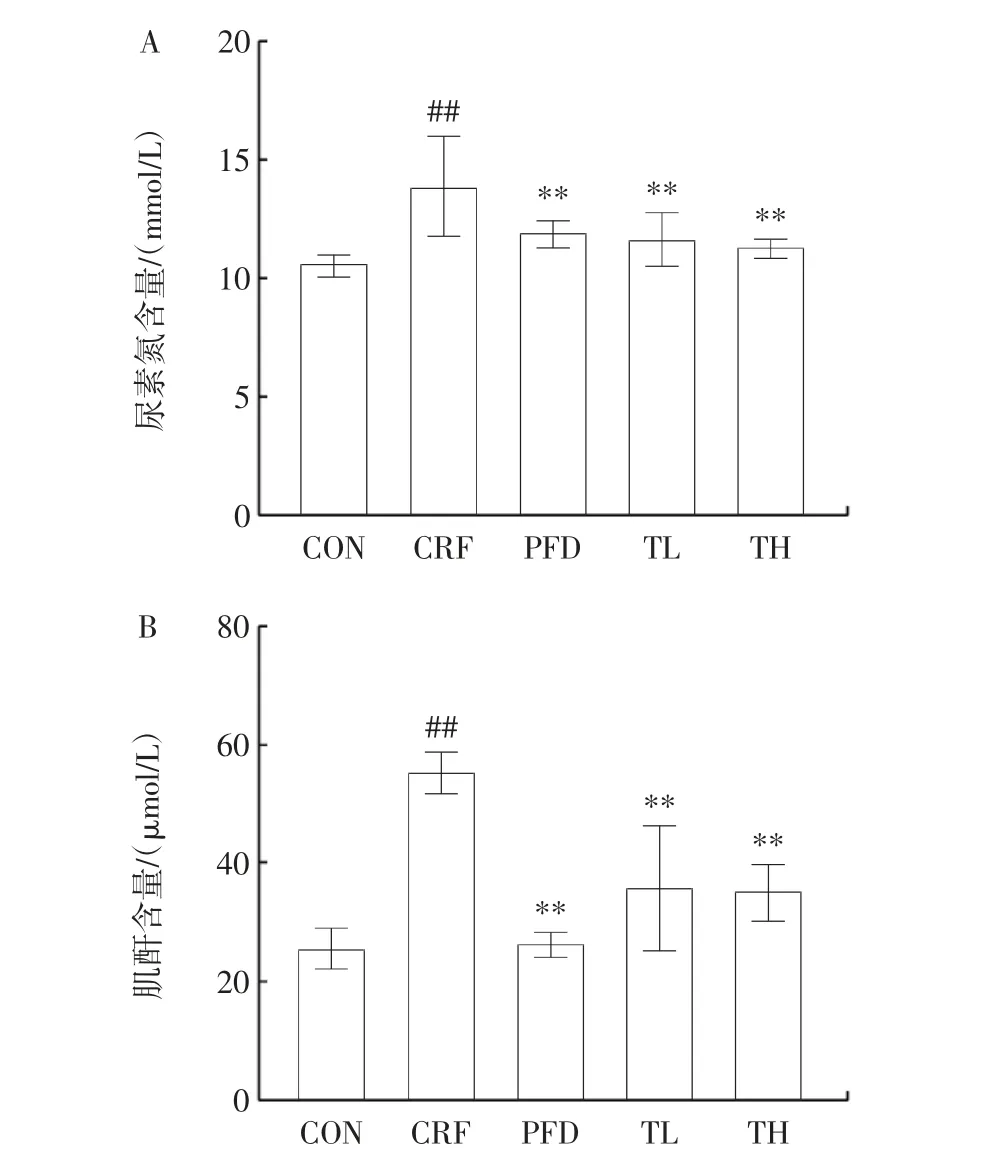
图3 THP 对慢性肾衰竭小鼠的尿素氮和肌酐含量的影响Fig.3 Effects of THP on urea nitrogen and creatinine content in mice with chronic renal failure
机体内的蛋白质代谢产物尿素氮,主要通过肾小球的滤过作用排出体外[22]。临床上,尿毒氮是判断肾小球滤过率功能的重要指标之一。由图3A 可知,与CON 组相比,CRF 组血清尿素氮含量升高了3.31 mmol/L(P<0.01),表明腺嘌呤饮食对小鼠的肾脏功能具有损害作用,表现出肾损伤。经过28 d 干预后,PFD、TL、TH组尿素氮含量分别为12.04、11.70、11.39 mmol/L,与CRF 组相比,TL 组和TH 组小鼠的尿素氮含量下降了16.55%和18.76%。并且,随着THP 作用剂量的增加,尿素氮含量下降程度增大。
机体内产生的血肌酐在肾小球过滤作用下,经过尿液排出体外,是评价肾脏功能的一项指标[23]。由图3B可知,CON 和CRF 组血肌酐含量分别为25.84 μmol/L和55.49 μmol/L,CRF 组小鼠的血肌酐含量是CON组的2 倍,表现出肾功能不全。28 d 干预后,TL、TH 组血肌酐含量分别为36.19 μmol/L 和35.31 μmol/L。与CRF 组相比,THP 极显著降低了慢性肾衰竭小鼠的血肌酐含量(P<0.01),并且具有剂量依赖性,TL 组和TH组小鼠的血肌酐含量分别降低了34.78%和36.37%。
综合以上实验结果,THP 对改善肾脏功能具有显著作用。
2.4 THP 对慢性肾衰竭小鼠肾脏组织状态的影响
观察小鼠的肾脏形态,如图4A所示。为了研究THP 对肾脏结构的影响,取小鼠的肾脏进行染色处理,H&E 染色结果如图4B所示,Masson 染色结果如图4C所示。
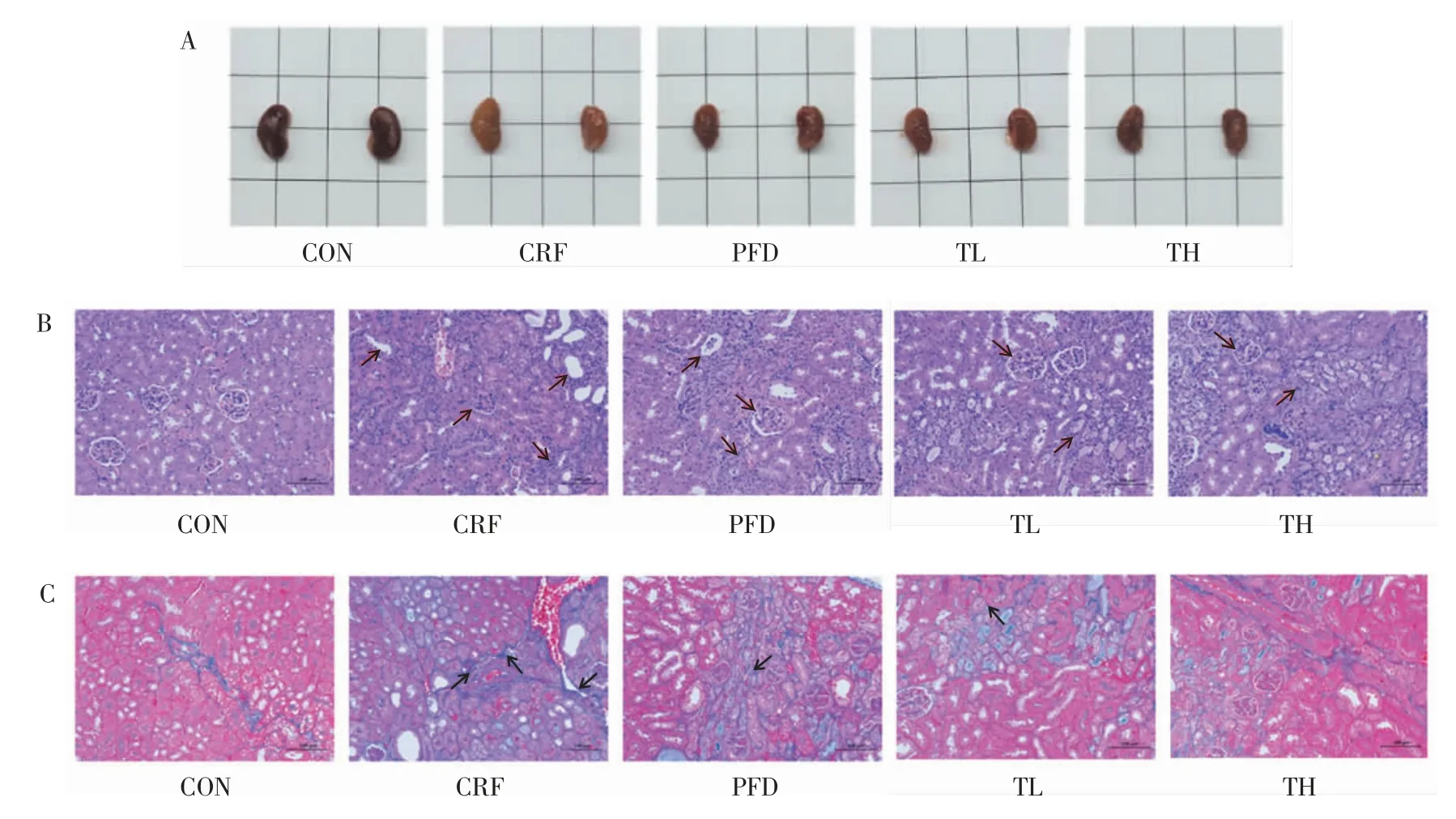
图4 THP 对慢性肾衰竭小鼠的肾脏结构的影响Fig.4 Effects of THP on kidney histopathology in the mouse model of chronic renal failure
由图4A 可知,CON 组小鼠双肾大小、色泽均正常,呈现红褐色,表面光滑且有光泽;CRF 组小鼠肾脏萎缩,质地变软,呈现出灰白色,表面无光泽且凹凸不平,表现出明显的肾损伤。与CRF 组相比,TL、TH 组小鼠肾脏逐渐恢复,色泽和形态有所改善,凹凸不平症状有所减轻,表明THP 可以改善慢性肾衰竭小鼠的肾脏损伤并具有剂量依赖性。
由图4B 可知,CON 组肾小球和肾小管结构完整且清晰,肾小球皮质和髓质轮廓清晰,肾小管大小、形状、间质面积正常,肾小管腔无扩张,肾小管上皮细胞有序排列,肾间质无胶原纤维组织增生,无炎症浸润。CRF 组肾小球数量减少,肾小管上皮细胞脱落,肾小管间质不规则,管腔扩张,炎性细胞浸润。TL、TH 组小鼠肾脏的管腔扩张明显减轻,肾间质炎性浸润减轻。
肾小管间质纤维化与CKD 向ESRD 进展密切相关[24]。由图4C 可知,肌原纤维被染成红色,胶原纤维呈现蓝色。CON 组小鼠的肾小球、肾小管及间质状态均正常,未见间质纤维化;CRF 组呈蓝色的纤维性肾组织广泛分布,肾小球、肾小管及肾间质沉积大量胶原纤维,表明慢性肾衰竭小鼠的肾脏间质损伤严重。与CRF 组相比,THP 干预28 d 后,肾损伤面积明显减少。
以上染色结果说明,THP 对慢性肾衰竭小鼠的肾损伤具有一定的保护作用。
2.5 THP 对慢性肾衰竭小鼠肾脏组织中炎症因子mRNA 相对水平的影响
THP 对慢性肾衰竭小鼠肾脏中促炎因子在mRNA水平的影响见图5。
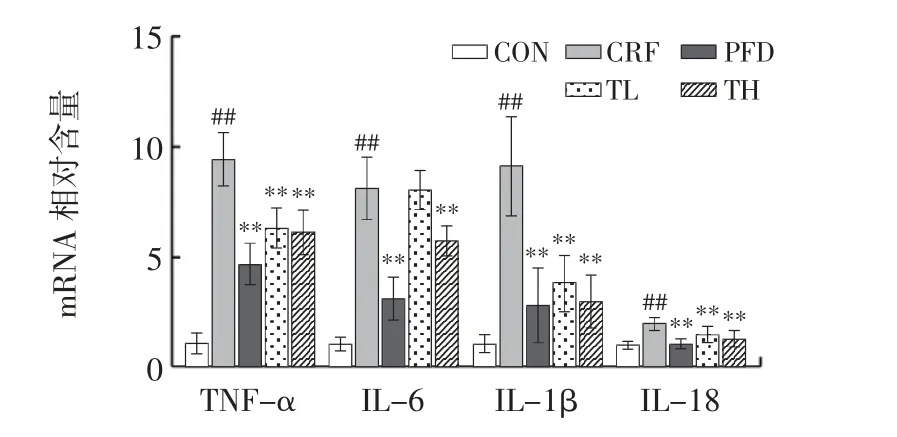
图5 THP 对慢性肾衰竭小鼠肾脏组织中炎症因子mRNA 水平的影响Fig.5 Effects of THP on the mRNA levels of inflammatory cytokines in the kidney tissue of the mouse model of chronic renal failure
有大量研究表明,炎症细胞因子(白细胞介素-1α、白细胞介素-1β、肿瘤坏死因子、白细胞介素-6[25]等)诱导炎症的产生,炎症的持续发展会导致白细胞募集、小管细胞凋亡、肾小管萎缩以及间质纤维化[26]。由图5 可知,与CON 组相比,CRF 组炎症因子TNF-α、IL-6、IL-1β、IL-18 水平极显著升高(P<0.01)。与CRF 组相比,THP 极显著下调慢性肾衰竭小鼠肾脏炎症因子水平(P<0.01),并且具有剂量依赖性。这说明THP 对慢性肾衰竭小鼠的肾脏炎症具有一定的抑制作用,与肾脏组织的H&E 染色结果一致。
2.6 THP 对慢性肾衰竭小鼠肾脏组织中纤维化因子mRNA 相对水平的影响
THP 对慢性肾衰竭小鼠肾脏中促纤维化因子在mRNA 水平的影响见图6。
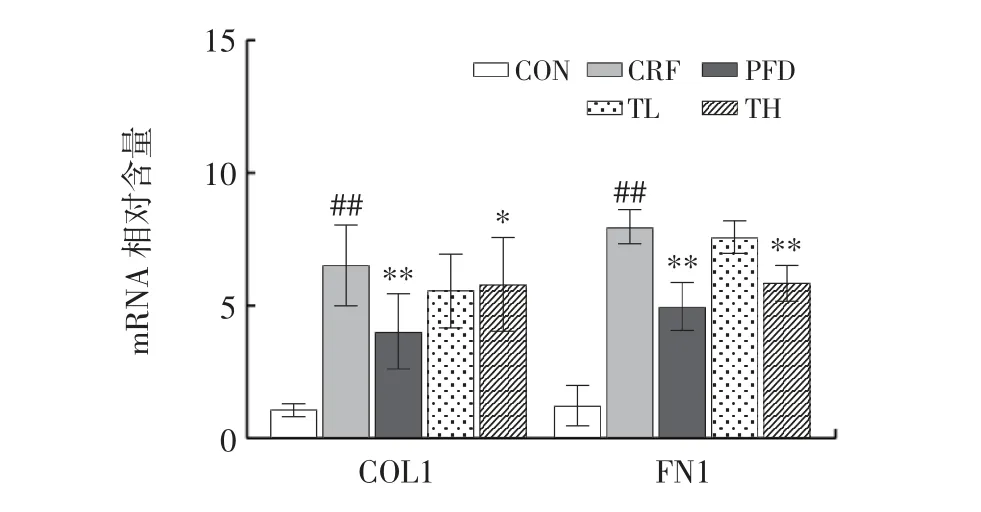
图6 THP 对慢性肾衰竭小鼠肾脏组织中纤维化因子mRNA 水平的影响Fig.6 Effects of THP on the mRNA levels of fibrotic factors in the kidney tissue of the mouse model of chronic renal failure
TGF-β1 通过与膜上TGFβ II 型受体(TβRII)、TGFβ Ⅰ型受体(TβRⅠ)结合使Smad2/3 磷酸化[27],转位到细胞核中,在细胞核中调节靶基因如COL1、a-SMA 和FN1 的转录,促使肾脏间质纤维化[28-30]。由图6可知,与CON 组相比,CRF 组中纤维化因子COL1、FN1 的mRNA 水平极显著上升(P<0.01)。干预28 d 后,与CRF 组相比,TH 组慢性肾衰竭小鼠肾脏组织中的COL1 因子的mRNA 水平显著下降(P<0.05);FN1 因子的mRNA水平极显著下降(P<0.01)。这说明THP 可以减轻慢性肾衰竭小鼠的肾脏纤维化,并且具有剂量依赖性,与肾脏组织的Masson 染色结果一致。
3 结论
本研究探究了狭鳕鱼蛋白肽THP 对腺嘌呤诱导慢性肾衰竭小鼠的影响作用。结果表明,THP 干预了小鼠体质量下降,显著降低了肾脏指数,降低了血清尿素氮和肌酐含量,有助于改善肾脏组织结构损伤,同时下调炎症和纤维化因子mRNA 水平,可以有效缓解慢性肾衰竭小鼠的肾脏损伤程度。因此,THP 在预防肾脏疾病领域具有很好的潜质。
