肿瘤标志物SCC、CA125 和CEA 水平与宫颈癌患者同步放化疗预后的关系研究
2023-12-06史志鹏
史志鹏
(郑州市金水区总医院医学检验科,河南 郑州 450000)
宫颈癌是多见的妇科恶性肿瘤,2020 年全球新发宫颈癌病例数约60.4 万,死亡约34.2 万,在我国每年新增宫颈癌病例约14 万,死亡约3.7 万[2]。研究表明,宫颈癌患者的年龄段症朝着年轻化态势发展[1]。临床实践发现宫颈癌发生与细菌、病毒以及衣原体等生殖道感染呈高度相关性[2]。如若不采取有效的方法对宫颈癌予以治疗,则会引发癌细胞广泛性转移,严重威胁患者生存质量及生命健康。
同步放化疗是治疗宫颈癌的首选方式,其有助于提高癌症的局部控制率,延长患者的生存时间[3],但由于同步放化疗抵抗,治疗后局部复发依旧较为常见,影响着患者的预后[2]。研究指出,鳞状细胞癌相关抗原(SCC)在宫颈癌患者中呈高表达,其对宫颈癌具有较高的敏感性及特异性[5];CA125 是具有抗原性的一类高分子类糖蛋白,其水平变化与宫颈癌的严重程度具有明显相关性[6];CEA 一般在胚胎时期形成,在妇科恶性肿瘤明显递增[7]。
因此,本研究旨在探究SCC、CA125、CEA与宫颈癌同步放化疗患者预后的关系,为提高宫颈癌的诊疗与改善患者预后提供参考。
1 资料与方法
1.1 一般资料
经本院医学伦理委员会审核批准后,选取2021 年5 月至2022 年5 月在本院接受同步放化疗的宫颈癌患者80 例作为研究对象。纳入标准:经病检证实为宫颈癌;具备同步放化疗;无盆腔放疗史;患者均签署知情同意书。排除标准:一般状态较差;预计生存期<3 m;合并恶液质。
1.2 方法
1.2.1 同步放化疗方法
对患者行血常规、肝肾功以及盆腔CT 检查。依据CT 图像勾画大体肿瘤区域。外照射大体肿瘤体积(GTV)50.4~56 Gy,对于距离宫颈较远的受浸宫旁组织,临床靶体积56~60 Gy;全盆腔淋巴引流区剂量50.4 Gy。外照射每周5 次,每次1.8~2.0 Gy。同步放化疗:顺铂30 mg·m-2,1 w 1 次。
1.2.2 预后不良判定及分组
将治疗期间病情进展或结束治疗后12 m 内复发作为预后不良的判定标准,包括局部复发和远处转移。根据预后情况将患者分为预后不良组和预后良好组。
1.2.3 基线资料收集
分析对比两组的年龄、体质量指数、肿瘤家族史、化疗周期数、放疗剂量、FIGO 分期等。
1.2.4 SCC、CA125 以及CEA 水平检测
采用电化学发光法检测SCC、CA125 以及CEA 水平,仪器为罗氏E170 电化学发光分析仪。
1.3 观察指标
(1)患者的预后状况;(2)两组的一般资料比较;(3)两组的SCC、CA125、CEA 水平比较;(4)SCC、CA125、CEA 在宫颈癌同步放化疗患者预后中的诊断效能;(5)不同SCC、CA125 以及CEA 水平患者的生存情况。
1.4 统计学分析
2 结果
2.1 患者的预后状况
接受同步放化疗的80 例宫颈癌患者中,预后不良有35 例,预后良好的患者有45 例。预后不良发生率为43.75%。
2.2 两组的一般资料比较
预后不良组肿瘤家族史占比较预后良好组更高(P<0.05),两组其余资料比较无统计学差异(P>0.05)。见表1。
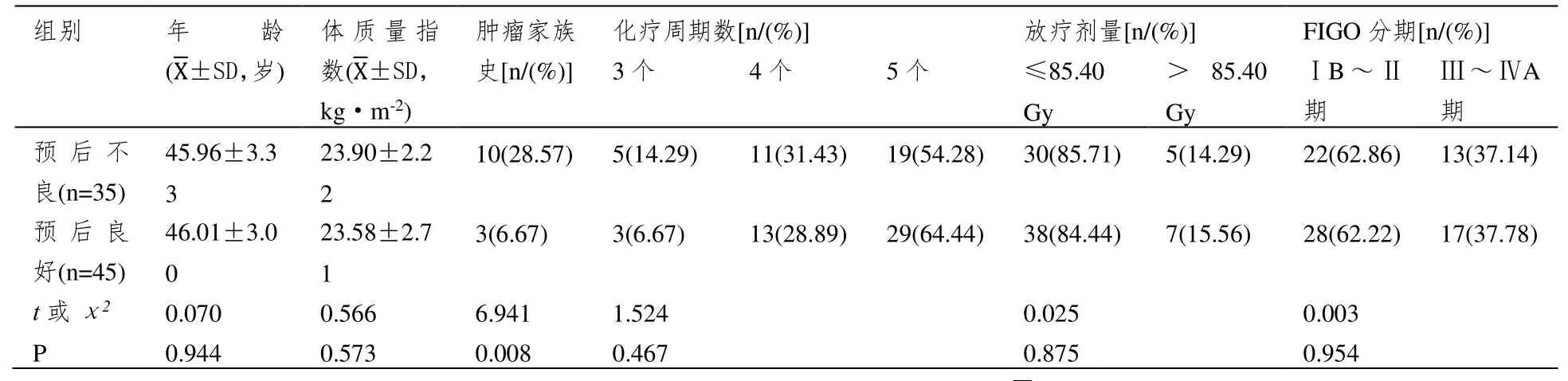
表1 两组一般资料情况比较
2.3 两组的SCC、CA125、CEA 水平比较
本研究中,预后良好患者35 例,预后不良患者45 例。与预后良好组比较,预后不良组患者的SCC、CA125 以及CEA 水平均更高,差异具有统计学意义(P<0.05)。见表2。
表2 两组SCC、CA125 以及CEA 水平对比(±SD)
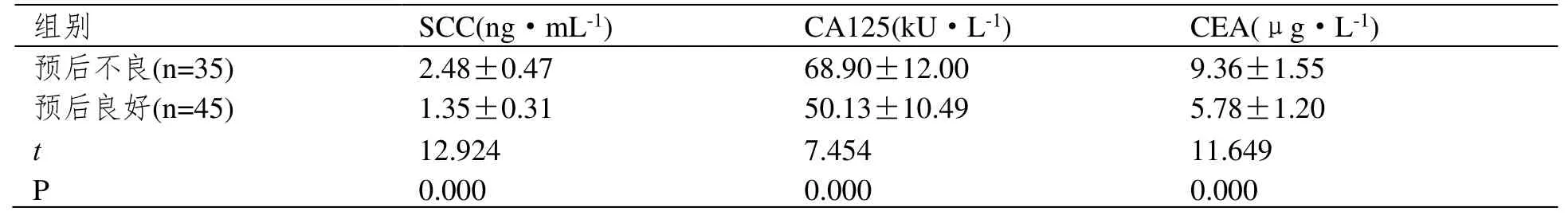
表2 两组SCC、CA125 以及CEA 水平对比(±SD)
?
2.4 SCC、CA125、CEA 在宫颈癌同步放化疗患者预后中的诊断效能
SCC、CA125、CEA 诊断宫颈癌同步放化疗患者预后不良的AUC 分别为0.774、0.833、0.810(P<0.05)。见表3 及图1。

图1 SCC、CA125、CEA 诊断宫颈癌同步放化疗患者预后不良的ROC 曲线
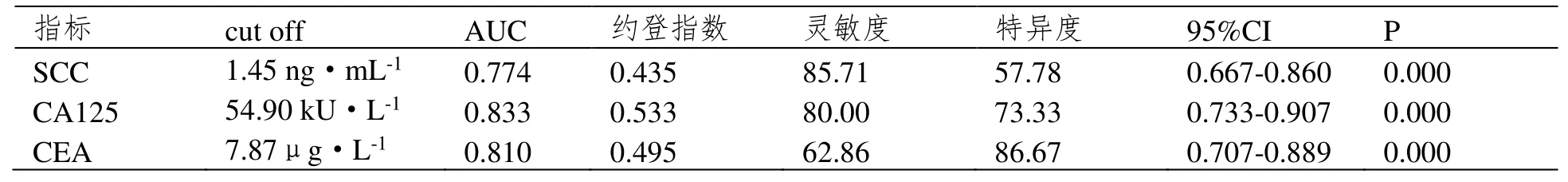
表3 SCC、CA125、CEA 在宫颈癌同步放化疗患者预后中的诊断效能分析
2.5 不同SCC、CA125 以及CEA 水平患者的生存情况
以ROC 曲线分析获得的cut off 值为分界,将患者分为SCC 高危(>1.45 ng·mL-1)与低危、CA125 高危(>54.90 kU·L-1)与低危、CEA 高危(>7.87 μg·L-1)与低危等3 类亚组。采用Kaplan-Meier 曲线分析发现,SCC 高危生存时间为(16.91±1.33) m,低危生存时间为(32.28±1.29)m,SCC 高危生存时间短于SCC 低危生存时间(经Log-Rank 检验,χ2=28.541,P=0.000<0.05)。CA125 高危生存时间为(20.35±2.27) m,低危生存时间为(27.77±1.69) m,CA125 高危生存时间短于CA125 低危生存时间(经Log-Rank 检验,χ2=7.456,P=0.006<0.05)。CEA 高危生存时间为(19.39±1.62) m,低危生存时间为(29.12±1.73) m,CEA 高危生存时间低于CEA低危生存时间(经Log-Rank 检验,χ2=6.666,P=0.010<0.05)。见图2。

图2 不同SCC、CA125、CEA 水平宫颈癌同步放化疗患者生存曲线(1A 为SCC,1B 为CA125,1C 为CEA)
3 讨论
大量研究表明,现阶段宫颈癌患者的年龄段症朝着年轻化态势发展[1]。临床实践发现宫颈癌发生与细菌、病毒以及衣原体等生殖道感染呈高度相关性,尤其乳头瘤病毒在其发生、发展中作用突出[7]。如若不采取有效的方法对宫颈癌予以治疗,则会引发癌细胞广泛性转移,严重威胁患者生命。放化疗能够缩小瘤体,提高肿瘤局部控制率,降低远处转移及淋巴结转移率。但由于宫颈癌与细胞凋亡机制密切相关[3],致使目前临床对宫颈癌的预后评判存在偏差。随着临床对肿瘤标志物研究的不断推进,血清因子水平现阶段已成为临床诊疗肿瘤疾患、评估病情以及判读预后的重要手段。本研究结果显示,预后不良组患者的SCC、CA125 以及CEA 水平均高于预后良好组(P<0.05),说明预后不良患者SCC、CA125以及CEA 出现了过度上调的情况。究其原因,SCC 水平升高促使宫颈癌患者肿瘤细胞经抑制细胞凋亡途径对机体细胞自杀机制出现抵抗,继而促使肿瘤的浸润与转移;人体“自然屏障”受损时血清中CA125 水平会升高,脱落的肿瘤细胞与机体循环直接接触,进而加速了恶性肿瘤的生长与转移;CEA 异常升高后会破坏胚胎细胞有关恶性肿瘤基因的调控,诱导癌细胞恶性程度转化,继而造成肿瘤的局部复发及转移,患者的预后欠佳。
本研究还发现,SCC、CA125、CEA 诊断宫颈癌同步放化疗患者预后不良的AUC 分别为0.774、0.833、0.810,说明SCC、CA125、CEA 在宫颈癌同步放化疗患者的预后诊断中具有良好的效能。为进一步分析SCC、CA125、CEA 与宫颈癌同步放化疗患者预后的关系,本研究以ROC 曲线分析获得的cut off 值为分界,将患者分为SCC高危(>1.45 ng·mL-1)与低危、CA125 高危(>54.90 kU·L-1)与低危、CEA 高危(>7.87μg·L-1)与低危,绘制Kaplan-Meier 曲线分析发现SCC、CA125、CEA 高危患者的生存时间均较低危者更短,进一步验证了SCC、CA125、CEA 与宫颈癌同步放化疗患者预后存在一定的关系。
综上所述,SCC、CA125 以及CEA 水平变化与宫颈癌同步放化疗患者预后具有一定的相关性,即SCC、CA125 以及CEA 水平越高,患者的预后越差,生存时间越短,临床可将SCC、CA125、CEA 指标用以宫颈癌同步放化疗患者的疾病诊疗与预后评估中。
