甘草酸单铵半胱氨酸联合谷胱甘肽治疗抗结核药性肝损伤的疗效观察
2023-12-06徐昌
徐昌
(都昌县第二人民医院结核科,江西 九江 332600)
抗结核药物性肝损伤(Anti-tuberculosis drug-induced liver injury,ATB-DILI)是指使用抗结核药物治疗肺结核等疾病时,由于药物对肝脏的毒性作用,导致肝脏功能异常或受损情况[1]。
对于轻度的抗结核药性肝损伤,一般建议停用可能引起肝损害的药物,并观察患者的病情变化。在停药后,肝功能常常可以自行恢复,但任需要密切监测患者的感功能指标,确保肝脏逐渐恢复正常[2]。因此如何快速减轻ATBDILI 使结核患者治疗顺利进行是临床急需解决的问题。谷胱甘肽(Glutathione,GSH)是细胞中重要的抗氧化剂,参与多种氧化还原反应,还能帮助保持正常的免疫系统功能,并具有解毒作用[3]。
甘草单酯可抑制炎症介质的释放,减轻炎症反应,抑制病毒的复制和传播,对一些病毒感染有一定治疗作用[4];盐酸半胱氨酸可在体内转化为蛋氨酸,促进胆碱的合成,所以甘草酸单铵半胱氨酸可以抑制炎症介质的释放和炎症反应的发生,减少组织炎症损伤,还能够清除自由基并保护细胞免受氧化应激的损伤,增强免疫细胞的活性,促进免疫应答的产生,提高机体的免疫力[5,6]。为此本研究将二者联合治疗观察ATBDILI 的疗效。
1 资料与方法
1.1 一般资料
选取2020 年3 月至2022 年3 月间本院接收的80 例ATB-DILI 患者作为研究对象,以信封随机法分为对照组和联合组,各40 例。本研究经医院伦理委员会批准,且患者自愿参加研究并签署知情同意书。
纳入标准:符合《中华结核和呼吸杂志》肺结核诊断和治疗的指南标准[7];年龄22~75 岁之间,男女不限;患者能够进行有效的沟通。
排除标准:合并其他已知的肝病者,如肝硬化、肝癌等;患者有其他潜在的肝损伤风险,如长期酗酒、肝毒性药物滥用等;严重其他系统性疾病者(系统性红斑狼疮);合并肾功能不全者。
对照组男19 例,女21 例;年龄22~75 岁,平均年龄35.13±6.14岁;体质指数20.32~25.12 kg·m-2,平均体质指数23.15±1.80 kg·m-2。联合组男20 例,女20 例;年龄24~75 岁,平均年龄36.42±6.3 岁;体质指数20.10~24.78 kg·m-2,平均体质指数22.94±1.82 kg·m-2。两组一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组患者静脉滴注溶于250 mL 葡萄糖中的注射用GSH(规格:0.6 g,绿叶制药有限公司,国药准字号:H20030002)1.2 g,Qd。
联合组在对照组的基础上增加静脉滴注甘草酸单铵半胱氨酸氯化钠注射液(规格:每1 mL含甘草酸单铵0.6 mg 及盐酸半胱氨酸0.3 mg,弘和制药有限公司,国药准字号:H20058905)150 mL,Bid。两者患者均连续治疗1 w。
1.3 观察指标
1.3.1 临床疗效
显效,治疗后患者临床症状与体征完全消失,实验室检查肝功能指标恢复正常水平。
有效,治疗后患者临床症状与体征明显改善,实验室检查肝功能指标与治疗前相比降低50%以上;无效,治疗后患者临床症状与体征无明显改善。
1.3.2 肝功能指标
分别于治疗前、治疗后留取患者外周静脉血5 mL,以3000 rpm 离心10 min,分离血清置于低温待检。采用酶欧联法检测血清谷丙转氨酶(Glutamic pyruvic transaminase,ALT)和谷草转氨酶(Glutamic oxaloacetic transaminase,AST),比色法检测碱性磷酸酶(Alkaline phosphatase,ALP)和谷氨酰转移酶(Glutamyl transpeptidase,GGT),重氮盐法检测总胆红素(Total bilirubin,TBIL)。
1.3.3 血清炎性指标
分别于治疗前、治疗后采用酶联免疫吸附法测定血清白细胞介素-6(Interleukin-6,IL-6)和肿瘤坏死因子-α(Tumor necrosis factor,TNFα)水平。
1.3.4 不良反应
观察并统计治疗过程中出现的不良反应,包括:恶心呕吐、腹胀腹泻、皮肤瘙痒、头晕,并计算不良反应发生率。
1.4 统计学方法
数据采用SPSS 23.00 软件进行统计学分析。计数资料以例数(%)表示,采用χ2检验;计量资料以均数±标准差(±SD)表示,采用t 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 临床疗效
治疗后,联合组总有效率为明显高于对照组(P<0.05),见表1。

表1 临床疗效(例(%),n=40)
2.2 肝功能指标
治疗前,两组患者肝功能指标无明显差异(P>0.05);治疗后,两组患者ALT、AST、ALP、TBIL、GGT 指标均明显下降,且联合组水平明显低于对照组(P<0.05),见表2。
表2 肝功能指标比较(±SD,n=40)
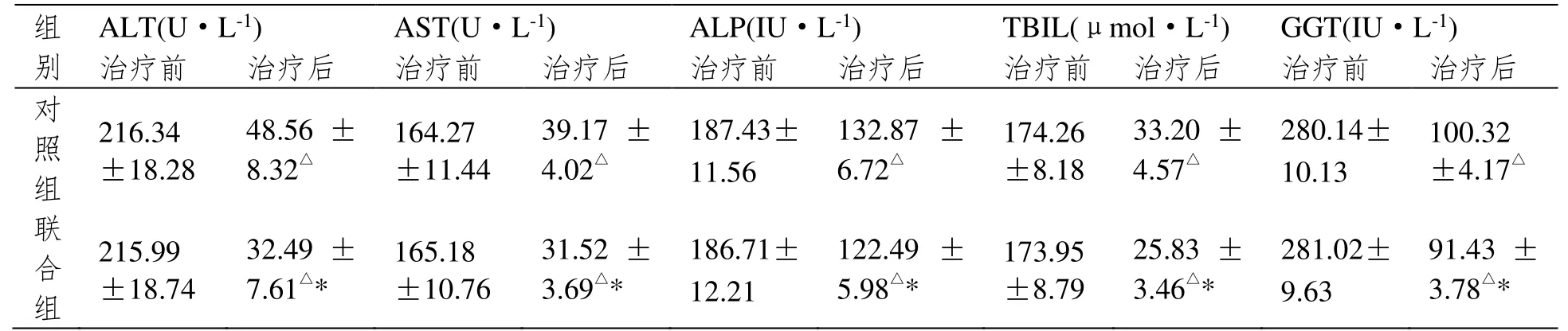
表2 肝功能指标比较(±SD,n=40)
注:与治疗前相比,△P<0.05;与对照组相比,*P<0.05。
?
2.3 血清炎性指标
治疗前,两组炎性指标无明显差异(P>0.05);治疗后,两组患者的TNF-α 和IL-6 均明显下降,且联合组水平明显低于对照组(P<0.05),见表3。
表3 两组患者血清炎性指标比较(±SD,n=40)
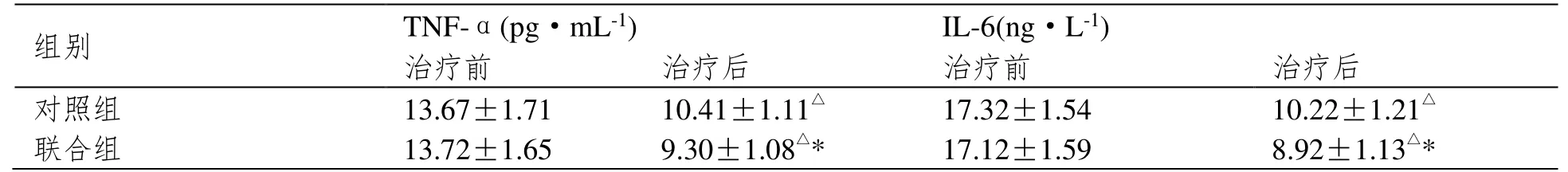
表3 两组患者血清炎性指标比较(±SD,n=40)
注:与治疗前相比,△P<0.05;与对照组相比,*P<0.05。
?
表3 不良反应发生率(例(%))

表3 两组患者血清炎性指标比较(±SD,n=40)
注:与对照组比较,*P<0.05。
?
2.4 不良反应发生率
治疗期间,统计联合组与对照组的不良反应总发生率无明显差异(P>0.05),见表3。
3 讨论
结核病是一种慢性传染性疾病,通过呼吸道传播,对人类健康造成严重危险,目前仍是我国乃至全球的一个重大卫生问题[8]。TB 的治疗通常需要长期的抗结核药物治疗,因此防治抗结核药物所致肝脏的损害,具有十分重要的意义[9]。本研究发现治疗后联合组总有效率为明显高于对照组,表明甘草酸单铵半胱氨酸联合GSH 治疗ATB-DILI 临床疗效显著,分析原因可能有:首先,甘草酸对于癌细胞的生长有一定的抑制功效,可以用来治疗肝癌;具有抗肝中毒的功效,可以用来治疗中毒性肝病;有效的降低谷丙转氨酶的含量,恢复细胞的功能,对于治疗酒精肝或者是脂肪肝有着显著的功效[10],半胱氨酸和GSH 也具有一定的抗炎作用,能够减少炎症反应引起的肝损伤[12];其次,甘草酸单铵半胱氨酸和GSH 都具有抗氧化作用,减少氧化应激对肝脏的损伤;最后,半胱氨酸是肝脏解毒过程中重要的物质,可以帮助肝脏代谢和排除有害物质,GSH 也具有类似的作用,能够帮助肝脏清除毒素。
ALT 是反应急性肝细胞损害的敏感标准,在肝炎等相关疾病中均可呈升高趋势[12]。AST是一种存在于细胞内的酶,主要存在肝脏、心肌、肾脏和肌肉等组织中,在机体内起着重要的生物学功能,参与氨基酸代谢过程中的转氨反应,当肝细胞收到破坏时,血液中的AST 水平将升高。ALP 是一种存在于细胞膜上的酶,主要存在肝脏、骨骼、胆管系统、肠道和肾小管等组织中,在体内参与多种生物化学反应,但其升高并不具有特异性,因为它也存在于其他组织中[13]。GGT 在体内的主要功能是参与氨基酸代谢,特别是谷氨酸和丙酮酸之间的转化[14]。TBIL 是指血液中的胆红素总量,在正常情况下,红细胞寿命结束后会被脾脏和肝脏分解,释放出的胆红素会进入肝脏进行进一步代谢和排泄,如果身体内的胆红素无法正常代谢或排泄,就会导致胆红素在血液中积累,引起血液中TBIL 水平升高[15,16]。本研究还发现治疗后联合组患者ALT、AST、ALP、TBIL、GGT 指标远低于对照组,表明ATB-DILI 患者使用甘草酸单铵半胱氨酸联合GSH 治疗可有效改善肝功能指标,原因可能为甘草酸单铵半胱氨酸联合GSH 治疗可通过抗氧化、抗炎、修复和再生的作用,减轻ATBDILI 引起的肝功能异常,改善肝功能指标[17]。TNF-α 参与全身炎症,通过细胞膜上的特异性受体,向细胞核传递信息[18]。IL-6 是一种具有多效活性的细胞因子,可以促进多种细胞的增殖和分化,也可以加速肝细胞急性期蛋白的合成[19]。通过对病人体液中IL-6 水平的检测,可反映患者的病情变化和治疗效果。本研究发现治疗后两组患者的TNF-α 和IL-6 下降,且联合组水平低于对照组,表明ATB-DILI 患者联合治疗有利于降低炎性因子水平,改善血清炎性指标。分析原因为甘草酸单铵半胱氨酸和GSH 的抗氧化和抗炎作用,可以减轻抗结核药物对肝脏的损伤和炎症反应。治疗期间联合组与对照组的不良反应总发生率比较无明显差异,表明甘草酸单铵半胱氨酸联合GSH 治疗ATB-DILI无不良反应增加,安全性良好。
综上所述,甘草酸单铵半胱氨酸联合GSH治疗ATB-DILI 患者的临床疗效显著,肝功能恢复快,且在单一GSH 治疗的基础上无不良反应增加,安全性良好。
