陆地棉GhPS2基因的克隆和表达分析
2023-12-05孟超敏卿桂霞耿翡翡李雪林张富厚
孟超敏,卿桂霞,耿翡翡,李雪林,张富厚
(河南科技大学农学院/河南省旱地作物种质资源利用工程研究中心,河南洛阳 471000)
磷素是核酸的重要组成成分之一,在植物体内的新陈代谢中起着关键性的作用,低磷胁迫不利于作物生长发育,缺磷棉花植株叶面积小,叶绿素含量低,生长发育受阻,影响产量和品质的提升[1]。向土壤中施加磷肥,磷会被快速吸附至土壤颗粒表面或者和其中的铁、铝、钙等物质反应形成难以溶解的磷酸盐,最终导致磷的有效性降低[2-3],也会造成农田环境污染以及土壤中磷素的累积等问题。诸多研究[4-6]表明,同一作物的不同品种基因型之间在磷吸收效率和磷利用效率方面存在差异。在土壤磷有限的情况下,磷高效型作物品种通过根系吸收、磷素的同化、转运和再利用获取足够的有效磷来维持植株的正常生长,从而形成更多的产量[7]。因此,为应对缺磷带来的生产危机,研究作物对低磷胁迫的响应机制以及提高作物的磷利用效率显得尤为重要。
卤代酸脱卤酶(HAD)超家族(HAD-like hydrolase superfamily)是以细菌中发现的卤代酸脱卤酶命名的,包括脱卤酶、磷酸化酶、糖磷酸变位酶、磷酸酯酶和ATP酶等[8],该酶能水解多种有机磷酸盐基质,这些蛋白质在共价催化中使用保守的羧酸盐催化磷或碳中心的亲核取代反应。在拟南芥中,磷饥饿显著诱导AtPECP1和AtPS2的表达[9],在一些与磷酸盐饥饿相关的转录组学研究中PECP1和PS2被列为强诱导型。这些酶在饥饿条件下可以从磷酸胆碱和磷酸乙醇胺中回收磷[10-12],在拟南芥中,磷饥饿也诱导了HAD磷酸酶的分泌,这些磷酸酶可能参与了细胞内和细胞外磷的利用[13]。HAD超家族中绝大多数已知的催化活性都针对磷酰基转移[14],而该酶蛋白催化焦磷酸盐的高度特异性裂解,它被命名为拟南芥焦磷酸特异性磷酸酶1,代表了第1个具有这种底物特异性的HAD超家族酶[15-16]。这些研究说明HAD基因在调节植物生长发育和响应磷缺乏胁迫方面起重要作用,但对于棉花HAD基因在生长发育和耐受低磷胁迫方面的研究几乎处于空白。
本试验以前期鉴定的磷高效陆地棉品种‘新陆早19’为材料来源[17],克隆得到GhPS2基因,并对该基因进行生物信息学分析及组织和低磷胁迫表达模式分析,为深入研究棉花GhPS2的生物学功能奠定了基础,以期为棉花磷高效基因工程育种提供基因资源。
1 材料和方法
1.1 试验材料及处理方法
选取自交留种中籽粒饱满的‘新陆早19’棉花种子用70%酒精杀菌30 min,冲洗干净后泡种 24 h 至棉花露白,分别播种于室内培养箱沙土中和河南科技大学农学院试验田。沙土中的棉花在28 ℃恒温培养箱培养至四叶期左右用以植株总RNA的提取。在试验田棉花花铃期取根、茎、叶、花等4个组织迅速放入液氮中备用。
选取三叶一心期整齐度均匀一致的‘新陆早19’幼苗,利用1/2 Hoagland营养液[18]培养1周后,进行低磷(LP:0.01 mmol/L)胁迫处理,以适磷处理(SP:1.0 mmol/L)为对照,分别处理0,4,12,24,72 h后,取3株生长一致的棉花植株,混合其根部组织作为试验样品。 取样后迅速将样品置于液氮中冷冻,并保存于-80 ℃ 超低温冰箱中备用。
1.2 引物设计与合成
利用基因表达谱筛选得到‘新陆早19’在低磷和适磷2种不同处理下差异表达序列DT464576为探针进行序列延伸和克隆。根据拼接的GhPS2的基因序列,使用Primer 5.0软件设计了克隆基因的全长引物和qRT-PCR引物,内参选用棉花GhActin基因,所有引物均由生工生物上海有限公司合成(表1)。

表1 PCR引物
1.3 陆地棉基因组DNA、总RNA提取和cDNA合成
采用CTAB法提取陆地棉基因组DNA,DNA经Nanodrop 2000和1%的琼脂糖凝胶电泳检测合格后保存-20 ℃备用。按照RNAprep Pure植物总RNA提取试剂盒(Tian-Gen,北京)提取棉株总RNA,然后利用超微量分光光度计测定RNA浓度,并用1%琼脂糖凝胶电泳检测其完整性。若总RNA质量符合要求,则根据HiScript®Ⅱ1st Strand cDNA Synthesis Kit cDNA第一链合成试剂盒将所提取的符合要求的总RNA反转录合成cDNA第一链,-20 ℃保存用于后续实验。
1.4 陆地棉GhPS2基因克隆与测序
分别以陆地棉‘新陆早19’的DNA和的cDNA为扩增模板,扩增陆地棉GhPS2基因的CDS区。再利用1%琼脂糖凝胶电泳进行PCR扩增检测。将目的条带的PCR产物与TOPO-T载体进行连接,转化、菌液PCR检测,然后目标条带的菌液送至生工生物上海有限公司测序,并保留一些菌液。
1.5 生物信息学分析
采用NCBI数据库中的blastn和blastp分析GhPS2基因的核苷酸序列及编码氨基酸序列的同源性,使用DNAMAN对GhPS2与同源蛋白序列多重比对,使用ProtParam分析GhPS2蛋白的基本理化性质,利用SOPMA对其二级结构进行预测。基于SWISS-MODEL和CD-Search分别对GhPS2蛋白进行三维结构同源建模和功能结构域的分析,使用SingalP3.0和TMHMM 2.0分别对GhPS2蛋白的信号肽和跨膜螺旋结构域进行分析,其磷化位点和亚细胞定位分别利用NetPhos3.1 Server和Plant-mPLoc软件进行分析,利用MEGA 5.0的邻接法构建系统发育进化树。
1.6 GhPS2表达的qRT-PCR
提取陆地棉‘新陆早19’植株不同部位(根部、茎部、叶部和花部)的RNA;提取低磷和适磷处理(0,4,12,24,72 h)的棉株根部RNA,以不同样本的RNA模板反转录获得第1条cDNA,作为qRT-PCR模板。内参基因为GhActin,所用引物见表1。
反应体系按照SYBR®Green Premix Pro Taq HS qPCR Kit试剂盒说明配制,使用的荧光定量PCR仪型号为CFX96,采用2-ΔΔCT计算目的基因相对表达量,利用Origin 9.0对数据进行统计分析并作图。
2 结果与分析
2.1 GhPS2基因克隆
利用DNASTAR将以低磷胁迫差异表达序列DT464576为探针检索的相似序列进行拼接,得到了片段大小为1 206 bp序列。分别以陆地棉新陆早19植株的DNA和cDNA为模板,进行PCR扩增(图1),得到的目的片段大小分别为1 717 bp(图1,泳道1)与1 152 bp(图1,泳道2)。该基因的开放阅读框为813 bp,共编码270个氨基酸。该编码区具有保守的DXDXT基序,因此该基因GhPS2是HAD家族成员。
2.2 GhPS2基因结构分析
将分别以DNA和cDNA为模板测序获得的序列导入分析工具GSDS(gene structure display server2.0)绘制基因内含子-外显子结构图(图2),该基因编码序列包含3个内含子和4个外显子,含有上下游区域5′与3′非编码序列。
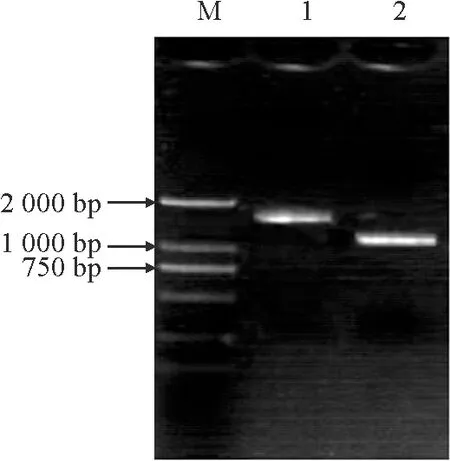
M. Marker 2000;1. DNA的PCR扩增片段;2. cDNA的PCR扩增片段。 图1 GhPS2基因编码序列的PCR扩增M. Marker 2000; 1. PCR amplified fragment of DNA;2. PCR amplified fragment of cDNA.Fig.1 PCR amplification of GhPS2 CDS

图2 GhPS2基因结构分析Fig.2 GhPS2 Gene structure analysis
2.3 GhPS2蛋白理化性质及结构分析
陆地棉GhPS2蛋白分子式是C1346H2106N354O399S18,相对分子质量为30.21 kD,理论等电点约为4.92,是一种稳定的亲水蛋白质(不稳定系数为33.92,总亲水性平均系数为-0.041)。蛋白质二级结构预测表明,其二级结构由无规则卷曲(39.63%)、ɑ-螺旋(38.89%)、延伸链(14.44%)和β-折叠(7.04%)组成。GhPS2蛋白三维结构同源建模显示(图3),其含有类卤代酸脱卤酶。蛋白的三级结构主要由无规则卷曲和α-螺旋构成,与二级结构分析结果一致。SignalP分析表明,其不存在信号肽序列;TMHMM-2.0分析所编码蛋白无跨膜结构域,也不属于跨膜蛋白。NetPhos 3.1 Server预测结果显示,GhPS2蛋白含有15个能被磷酸化的位点(超过阈值线),包括Ser位点8个、Thr位点6个和Tyr位点1个。亚细胞定位预测,该蛋白定位于细胞膜,与跨膜结构预测分析结果相同,推测该基因可能直接在细胞膜发挥作用。

图3 GhPS2蛋白质的三级结构Fig.3 Tertiary structure of GhPS2 protein
2.4 GhPS2蛋白同源性比对及系统进化树构建
利用NCBI当中的CD-search工具预测基因的保守结构域,GhPS2蛋白含有1个特异匹配为Put_Phosphatase,共有3段保守位点的氨基酸,这些位点可能是催化位点或者结合位点,匹配所属的超家族是HAD基因家族。该基因具有HAD家族特有的DXDXT基序特征,如图4所示。

红色方框表示DXDXT基序。图4 GhPS2与其他物种HAD家族同源蛋白的多序列比对分析结果The red box indicates the DXDXT motif.Fig.4 Multi-alignment of GhPS2 amino acid sequence with other HAD family in different plants
根据DNAMAN比对,该基因编码270 aa,包含了该基因完全的开放阅读框。GhPS2蛋白序列与其他棉种PS2蛋白序列相似性达到93%,与榴莲PS2蛋白序列的相似性达到83.15%。通过MEGA5对GhPS2和不同棉种以及其他植物同源蛋白构建系统进化树(图5),陆地棉蛋白序列与雷蒙德氏棉、澳洲棉和亚洲棉在一个小支上,与不同物种中的榴莲、毛果杨、麻风树、巴西橡胶树、木薯的亲缘关系最近,与其余6个物种的亲缘关系较远,不在一个大支上。
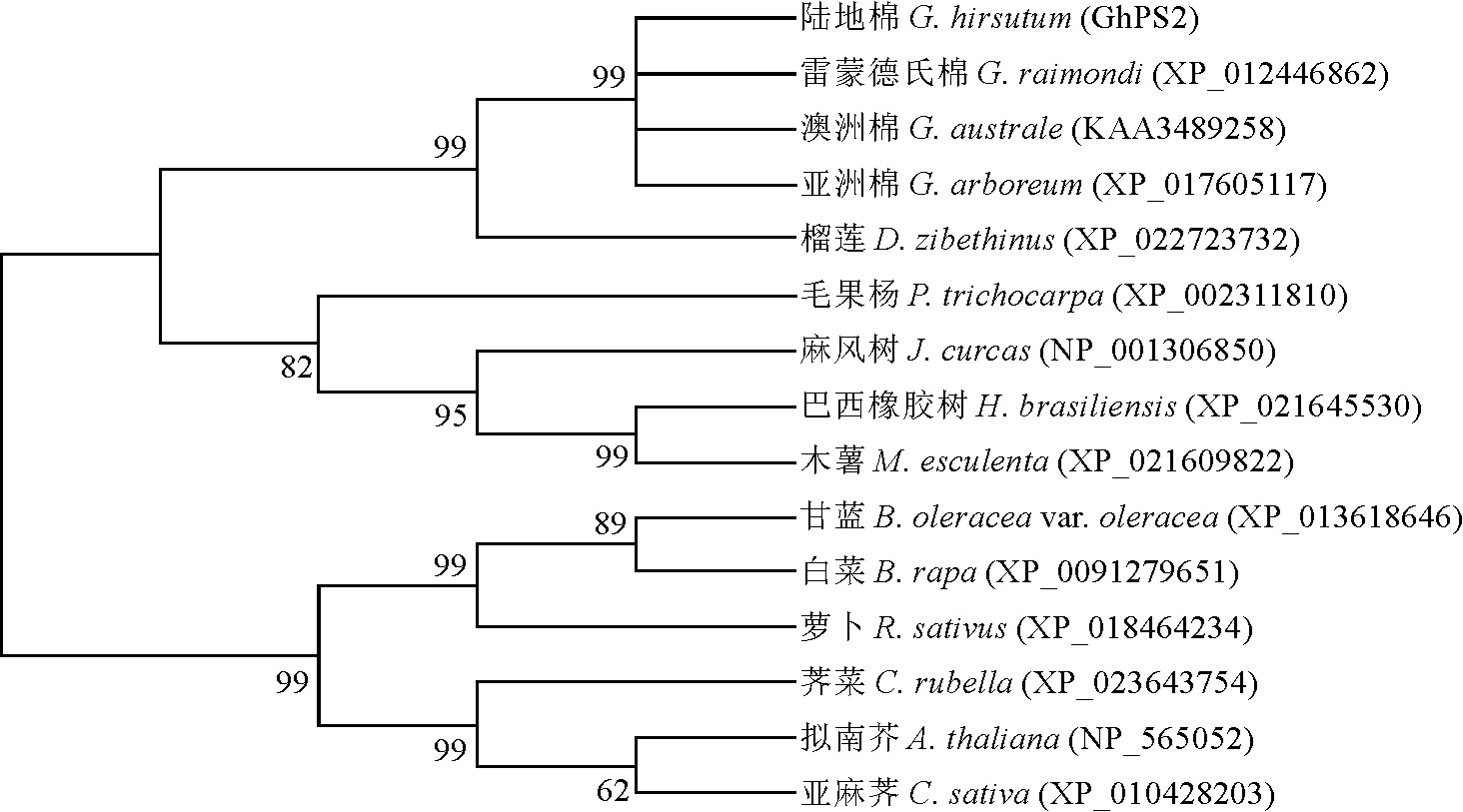
图5 GhPS2基因系统进化树分析Fig.5 GhPS2 Phylogenetic tree analysis
2.5 GhPS2基因在不同组织及低磷胁迫处理下表达模式分析
利用qRT-PCR技术检测GhPS2基因在根、茎、叶和花4个器官中的表达情况,发现GhPS2基因在不同组织中均有表达,表达水平由高到低依次为根、茎、叶和花,表明GhPS2在陆地棉不同组织之间表达水平具有差异性(图6)。

不同字母表示差异显著(P<0.05)。图6 GhPS2基因在不同组织的相对表达分析Different letters indicate significant differences (P<0.05).Fig.6 The relative expression of GhPS2 gene in tissues
对陆地棉幼苗进行低磷胁迫,以处理不同时间的陆地棉根部组织为材料进行qRT-PCR分析GhPS2基因表达情况,由图7可以看出,4~72 h低磷处理下的表达量均比适磷处理下的表达量高。而低磷胁迫表达的趋势:低磷处理4 h时相对表达量达到最高峰,低磷处理4~24 h这个时间段表达量逐渐下降,72 h时其表达量又明显上升,是适磷处理的16.66倍。上述结果提示,GhPS2基因可能在棉花低磷胁迫调控中起一定的作用。

**表示与适磷处理相比差异显著(P<0.05)。图7 GhPS2基因在根部低磷胁迫不同时间的表达模式** indicates significant difference between suitable and low phosphorus stress at 0.05 level.Fig.7 The relative expression analysis of GhPS2 gene low phosphorus treatment at different time points in roots
3 讨 论
为了应对磷胁迫,植物已经进化出复杂的系统来调节对胁迫信号的适应。适应过程的许多方面,包括发育、生理和生化变化,都受到胁迫反应基因表达的调节[19-20]。本研究所得的基因序列与拟南芥中HAD家族中的无机焦磷酸酶基因PS2同源性较高[15-16],含有HAD超家族共有的结构特征DXDXT基序,属于HAD超家族成员。二级结构分析表明GhPS2蛋白主要由无规则卷曲和α-螺旋构成,基于同源建模对GhPS2蛋白三级结构预测可知其含有类卤代酸脱卤酶[8]。据报道HAD超家族成员它参与各种细胞过程,由此推测GhPS2基因具有同样的功能。
缺磷引起植物局部或系统性防御反应取决于外部磷供给水平和植物体内磷含量分布及形态,根系的形态结构与建成过程依赖介质中磷浓度的局部信号调控,而不是依赖植株整体磷水平的系统信号调控[21],但是磷的吸收、恢复、脂质代谢、金属转运及参与不同功能的基因成员都依赖于复杂的调控系统[22]。卤代酸脱卤酶(HAD)超家族成员,受磷缺乏的调节[23]。在拟南芥中,有2种低磷反应的HAD家族成员,AtPS2和AtPECP1分别编码功能性焦磷酸酶和磷酸乙醇胺磷酸酶[9]。LePS2是番茄中第1个低磷诱导HAD超家族基因,过度表达LePS2的蛋白导致磷酸酶活性增加、花青素积累和番茄开花延迟[24]。LePS2的质膜定位同系物PvPS2:1在过度表达转基因的拟南芥中增加了磷的获得和根系生长[25]。在低磷环境胁迫下,植物会在分子机制、生理生化和形态结构等多环节的调整来增加自身的适应性,而根系作为植物吸收矿质元素的主要器官对植物适应磷饥饿具有重要作用[26-27]。本研究得到的GhPS2基因qRT-PCR定量结果表明该基因在根中的表达量最高,其次在茎和花中,在叶中表达最低。在低磷胁迫4 h时棉花根部组织的相对表达量达到最高值,低磷处理4~72 h的表达量均大于适磷处理4~72 h,低磷胁迫72 h时是适磷处理的16.66倍,依次推测GhPS2基因在根系发挥作用,并且会持续性地对低磷胁迫作出应答,在棉花磷信号调控机制中可能具有重要的的生物学功能。
截至目前,棉花中关于HAD基因的鉴定、等位变异和表征等信息并不多,因此为进一步探讨该基因在棉花中的生物学功能,后续可通过酵母杂交、VIGS等技术验证和分析GhPS2基因如何在低磷胁迫中发挥作用,并揭示该基因在棉花应对低磷胁迫逆境时的作用机理。
