超表达AVP1基因提高甜菜的耐低磷和耐盐抗旱性
2023-12-05孙亚卿王晓娇李宁宁李国龙张少英
孙亚卿,王晓娇,2,刘 雪,李宁宁,李国龙,张少英*
(1 内蒙古农业大学 农学院,呼和浩特 010019; 2 内蒙古自治区农牧业科学院,呼和浩特 010031)
甜菜是中国重要的糖料作物,也是内蒙古地区具有地域优势的经济作物。得益于生产种植的规模化和机械化,近年来发展势头良好,其生产主要分布在北纬40°以北各省区,而该区域盐碱、干旱土地集中,各种非生物胁迫是制约甜菜产业高质量发展的主要因素之一,因此提高甜菜的抗逆性、保证甜菜产质量稳定提升是保障甜菜生产可持续发展的重要基础[1]。在传统育种的基础上,利用生物技术对其加以遗传改良,以培育出优质、高产、抗逆性强的新品种,对提高北方地区甜菜产量以及改良和利用大面积盐碱地和荒漠化土地有重要意义[2-3]。多项研究证明,H+-PPase(H+-焦磷酸酶)基因的过表达可为液泡膜的次级转运系统提供能量,在多种非生物胁迫适应性中起着重要的作用,包括提高植物细胞对盐碱和干旱的耐受性。
通过过表达该基因,不仅可促进转基因植株的根系生长,还可通过分泌有机酸,提高植物根系对磷的吸收效率[4-5]。可见,H+-PPase基因作为提高作物抗性的候选基因是一个非常具有潜力的有效基因。本研究在已有研究基础上,将拟南芥H+-PPase基因AVP1对甜菜进行转化,对获得的转基因甜菜植株进行不同非生物胁迫处理(盐胁迫、低磷和干旱),分析各处理条件下转基因甜菜的磷吸收能力和抗逆性能,为培育高产、高抗性的甜菜新品种提供参考。
1 材料和方法
1.1 转基因甜菜的获得
克隆于拟南芥的AVP1基因和经改造的携带AVP1基因的质粒pCAMBIA2301(图1)由本课题组先期完成,参见王晓娇[6]方法,利用农杆菌菌株LBA4404,对甜菜品系DF1031进行遗传转化。将甜菜种壳打磨后采用10% NaClO和0.1% HgCl2各处理10 min的灭菌剂组合,MS培养基培养获得无菌苗。甜菜子叶节置于MS+1.0 mg/L 6-BA的分化培养基上预培养2~3 d,用OD600为0.4~0.5的菌液侵染6~8 min,共培养48 h后,转入含0.1 g/L卡那霉素和0.3 g/L羧苄青霉素的分化培养基(MS+1.0 mg/L 6-BA+0.2 mg/L NAA)上进行筛选培养。外植体分化出不定芽后,移到生根培养基(1/2 MS+2.0 mg/L NAA)上生根成苗。对得到的抗性苗随机取样不同部位,且经PCR和RT-PCR检测全部为阳性的植株,选取长势一致的植株用于进一步处理研究。

图1 质粒pCAMBIA2301示意图Fig.1 Schematic map of the plasmid pCAMBIA1301
1.2 转AVP1基因甜菜的分子检测
1.2.1 转基因甜菜的PCR检测
根据所用植物表达载体序列合成引物(表1),扩增长度为600 bp的片段,分别以质粒和野生型植株作为正负对照,用于抗性苗的基因整合鉴定。
1.2.2 转基因甜菜的qRT-PCR检测
采用TRIzol方法提取经PCR鉴定阳性甜菜植株组织RNA,纯化后的RNA 反转录合成cDNA,步骤见王晓娇方法[6]。用甜菜Actin基因当内参基因(表1),进行荧光定量PCR (quantitative real-time PCR,qRT-PCR),分别计算不同培养条件(低磷、干旱、盐胁迫)下叶片和块根中AVP1基因的相对表达量。
1.3 材料准备
对不同甜菜组培苗材料炼苗3~4 d后,将幼苗移入经高压灭菌过的珍珠岩/细砂/蛭石(1∶1∶1)基质中,遮荫3~4 d后观察幼苗生长情况,然后逐渐去除遮荫网,自然光照射。每2 d浇入1/2霍格兰营养液,期间温度和湿度适宜。选取苗高、长势基本一致的植株作为试验材料。
1.4 不同磷浓度处理
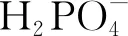
1.5 干旱胁迫处理
挑选前期培养的长势基本一致的转基因和野生型植株幼苗,采用25% PEG 6000进行干旱胁迫,不胁迫为对照,3个重复,在干旱胁迫处理期间,每2 d取1次样品测定相关指标,每个指标6次重复。
1.6 盐胁迫处理
挑选上述培养的转基因和野生型植株幼苗,用l/8霍格兰营养液浇灌(其中含50 mmol/L NaCl),NaCl浓度每隔1 d增加50 mmol/L,最后达到终浓度200 mmol/L。继续培养7 d后,取样测定相关指标,每个指标6次重复。
1.7 指标测定
土壤总磷量采用分光光度法定量测定[7]。植株总磷量采用锑抗比色法[8]。游离脯氨酸含量采用酸性茚三酮法。丙二醛(MDA)含量采用硫代巴比妥酸(TBA)-分光光度法。
1.8 数据分析
所得数据应用SAS 9.0软件进行方差分析,利用Excel 2003进行作图。
2 结果与分析
2.1 不同培养条件下转基因甜菜AVP1的表达差异
对经PCR检测鉴定为阳性(图2)的植株材料,采用qRT-PCR分析其在不同培养条件下甜菜叶片和块根中AVP1基因表达量的差异。
M. DL3000;1. ddH2O;2. 质粒(CK+);3. 野生型(CK-);4-10. 转基因甜菜。图2 T1代转AVP1基因甜菜 PCR检测M. DL3000; 1. ddH2O; 2. Plasmid(CK+);3. Wild-type(CK-); 4-10. Transgenic sugar beet.Fig.2 The PCR electrophoretogram of T1 generation AVP1 gene transgenic sugar beet
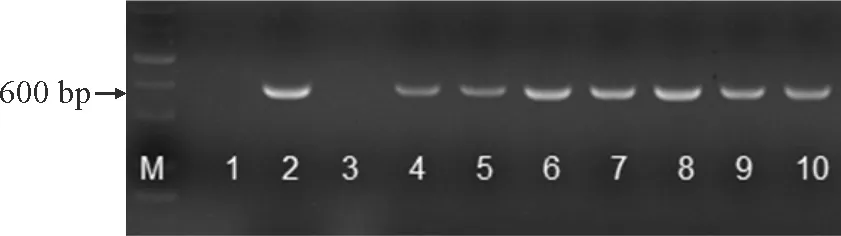
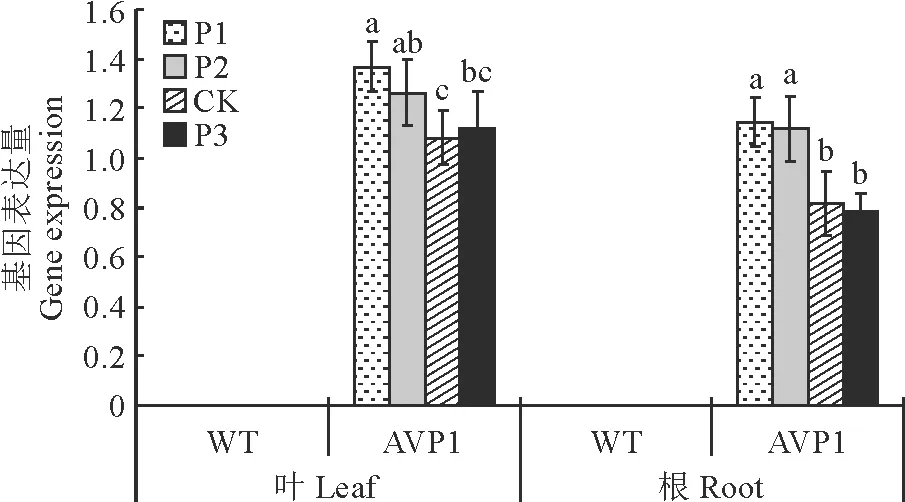
结果显示,无论在不同磷处理(图3)、高盐和干旱胁迫(图4)条件下,野生型甜菜叶片和块根中AVP1基因均未表达,而转基因甜菜的叶片和块根中AVP1均有不同程度的表达,其中叶片中的表达量较强。与对照比较,低磷处理下,AVP1基因在叶片和块根中的表达量均显著增加,而在高磷处理下,AVP1基因的表达量却没有增加,在转基因甜菜叶片中AVP1基因具有表达优势。在胁迫条件后,AVP1基因在转基因甜菜叶片和块根中的表达量均显著增强(图4)。
WT.野生型;AVP1.转基因植株;不同小写字母代表处理间差异显著(P<0.05)。下同。图3 不同磷浓度对转基因甜菜AVP1基因表达的影响WT. Wild type; AVP1. Transgenic plants; Different normal letters indicate significant difference among treatments at 0.05 level (P<0.05). The same below.Fig.3 The effect of different P concentrations on the gene expression of wild and transgenic types
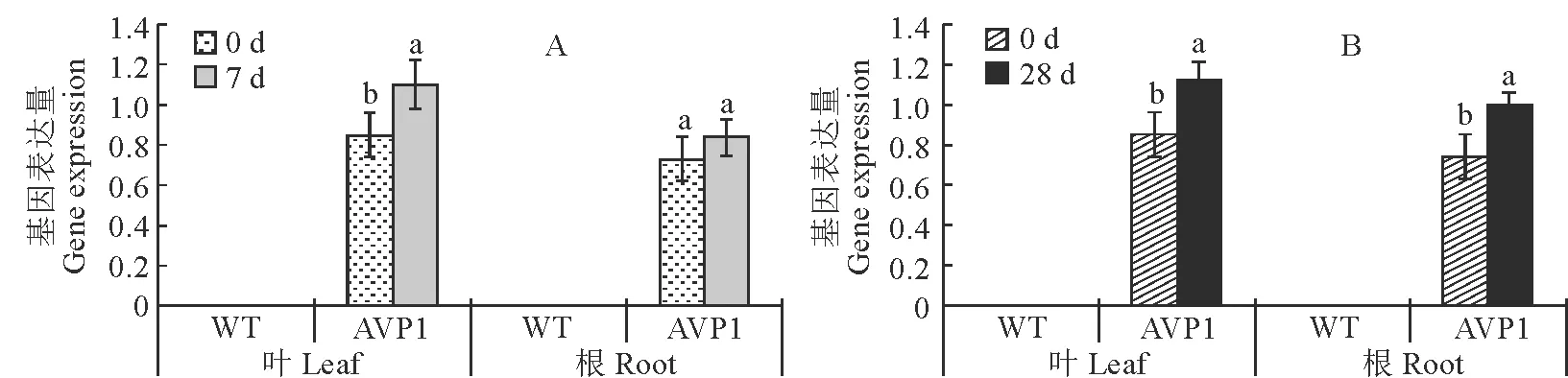
图4 干旱(A)和高盐(B)胁迫下甜菜不同器官AVP1基因表达Fig.4 AVP1 gene expression level under drought stress (A) or salt stress (B)
2.2 转AVP1基因提高甜菜磷素吸收能力的影响
如图5,A显示了在不同磷供给处理下的土壤磷含量,结果显示培养转AVP1基因甜菜的土壤磷含量均低于种植WT甜菜的土壤,且差异显著(P<0.05)。在相同的磷含量供应和相同的处理方法下,转基因甜菜含磷量均高于野生型甜菜,其中在CK条件下,前者比后者高出65%,可见转基因甜菜比野生型具有更高的磷吸收能力。
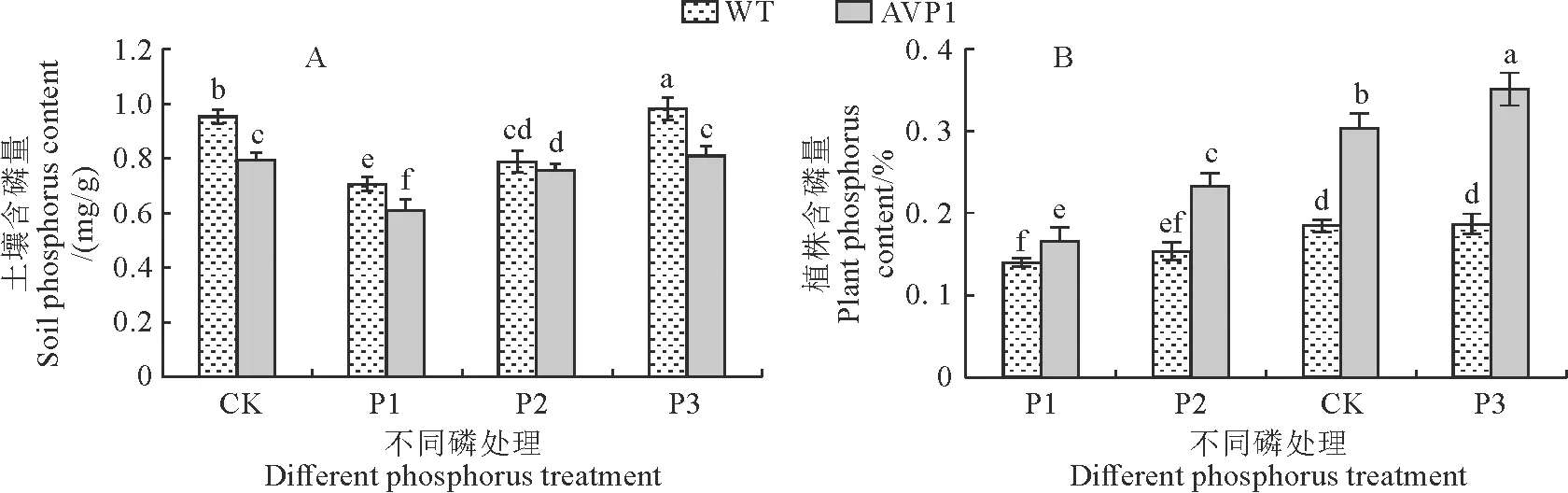
图5 不同磷浓度对土壤和转基因甜菜植株含磷量的影响Fig.5 The phosphorus content of soil and plants under different P concentrations
植株叶片内磷浓度取决于土壤磷供应水平,低磷条件(P1)下,虽转基因甜菜和野生型甜菜的磷含量与CK条件相比均显著降低,但转AVP1植株仍显著高于WT植株。转基因甜菜的含磷量随着磷供给的增加而增加趋势明显,而野生型植株在高磷条件(P3)下磷含量与CK条件无明显差异,可见转基因甜菜与野生型植株相比具有充分利用过量磷的吸收能力。
2.3 转AVP1基因甜菜抗旱性
野生型植株在正常生长条件与转基因植株在生长形态上基本一致,没有明显差别(图6,A)。但随着干旱胁迫的持续,野生型植株的生长在处理第5天时首先出现萎蔫现象,生长受到抑制,而同时转基因植株仍然正常生长,直到第7天才发生萎薦(图6,B),而此时野生型植株表现受害程度更重;干旱处理第8天对所有植株做复水处理,2 d后,转基因植株解除萎蔫并基本恢复正常生长,而野生型植株则发生永久萎薦,最后死亡(图6,C)。可见,AVP1基因的超表达提高了转基因甜菜的抗旱性。

A.干旱胁迫前; B.干旱胁迫7 d; C.恢复灌水2 d。图6 干旱胁迫对转基因植株与野生型植株形态变化的影响A. Before drought stress; B. 7 days after drought stress;C. 2 days after resuming irrigation.Fig.6 The effect of drought stress on the morphological changes of transgenic type and wild
2.4 转AVP1基因甜菜耐盐性
选取植株生长形态基本一致的转基因和野生型植株(图7,A)用200 mmol/L NaCl处理,1周后二者的叶片均表现部分变黄,生长速度明显缓慢,但野生型植株表现相对较严重的失绿现象。盐胁迫处理期间,转AVP1基因材料的长势表现相对强于WT植株,总体受抑程度轻于野生型植株(图7,B)。植株生物量测定结果显示,在200 mmol/L NaCl处理14 d后,无论是地上部还是地下部,转基因植株的生物量均显著高于野生型植株,如转基因植株的地上部鲜重是野生型植株的1.4倍(图8)。可见,AVP1转基因植株具有比野生型植株更强的耐盐性。

A.盐胁迫处理前; B.盐胁迫处理28 d后。图7 盐胁迫对野生型植株与转基因植株形态的影响A. Before salt stress; B. 28 days after salt stress.Fig.7 The morphological changes of transgenic type and wild type under salt stress
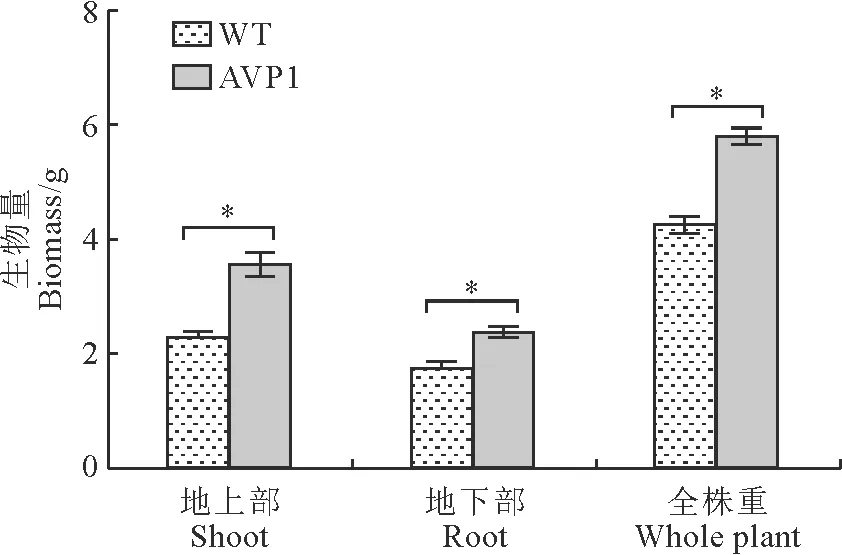
*表示材料间在0.05水平差异显著。图8 200 mmol/L NaCl处理植株生物量* represents significant difference between materials at 0.05 level.Fig.8 Biomass of plants treated with 200 mmol/L NaCl
2.5 转AVP1基因植株中细胞膜稳定性和渗透能力
植物器官在逆境伤害下往往发生膜脂过氧化作用,丙二醛(MDA)是细胞膜脂质过氧化作用的产物之一,其含量一定程度上可以反映遭受逆境伤害的程度[9]。
本研究中,WT植株与转AVP1基因植株叶片中MDA含量在胁迫处理前没有差异(图9),但随着NaCl浓度的增加或干旱胁迫的加剧,二者植株叶片MDA含量均呈增加趋势,但转基因甜菜表现较为缓慢的增加趋势,在盐处理14 d或干旱胁迫5 d后,二者的MDA含量开始表现明显差异,盐处理继续到21,28 d时,WT植株的MDA含量比转AVP1植株分别高出24.5%和26.7%;而在干旱处理5 d、7 d后,则分别高出15.6%和22.1%,由以上结果可见转AVP1基因植株具有较高细胞膜稳定性,因而比野生型植株表现较高抗盐和抗旱性。
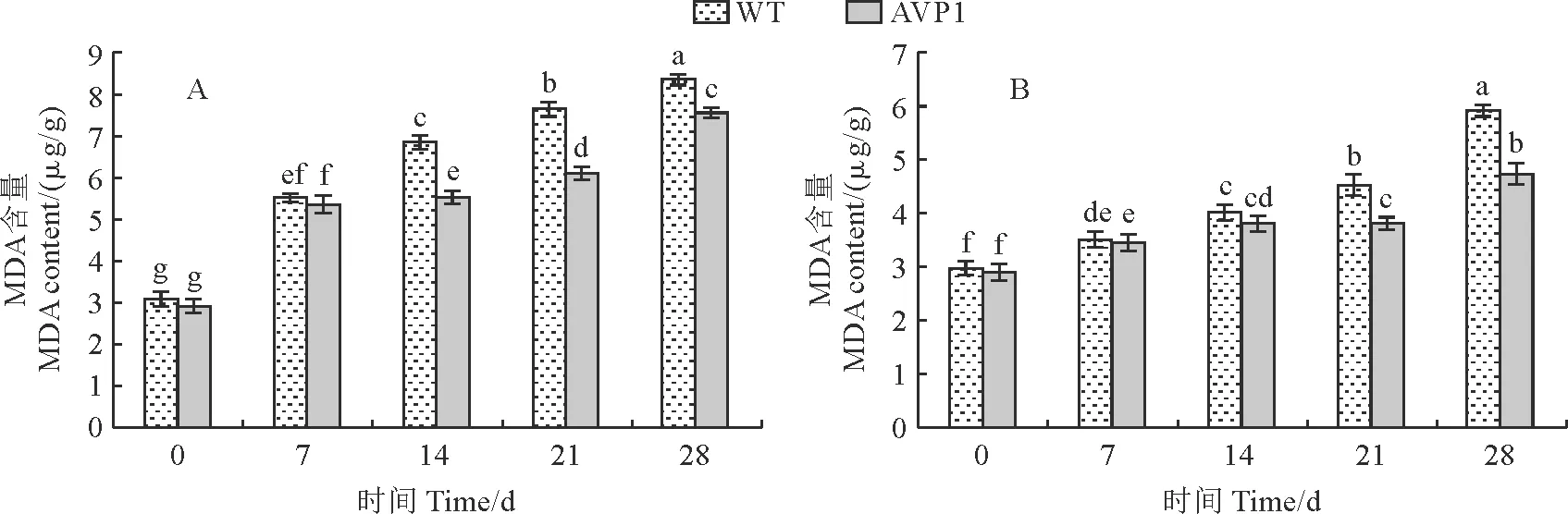
图9 盐胁迫(A)和干旱条件(B)下甜菜植株叶片丙二醛含量Fig.9 MDA content in leaves of sugar beet plants under salt (A) and drought (B) stress
由图10可知,在逆境条件下,植物体内具有较强水合能力的游离脯氨酸含量会显著增加,其通过稳定原生质胶体及组织内的代谢过程来提高植物的抗逆性。本试验中,转AVP1基因甜菜植株和WT植株在盐胁迫和干旱处理条件下,游离脯氨酸含量均高于处理前,但增加幅度表现为转AVP1基因甜菜植株大于WT植株。

图10 干旱(A)、盐胁迫(B)条件下甜菜植株叶片脯氨酸含量Fig.10 Proline content in leaves of sugarbeet plants under drought (A) and salt (B) stress
盐胁迫28 d和干旱胁迫7 d后,前者游离脯氨酸含量比后者分别高出27.1%和30.3%,均达到显著差异(P<0.05)。表明转基因甜菜比野生型植株具有较强渗透调节能力,从而可缓解高盐或干旱条件对植株造成的渗透胁迫,一定程度上缓解其造成的伤害。
3 讨 论
由于外源基因遗传具有不稳定性,在转基因植株体内表达水平相对较低,甚至靶基因丢失的现象时有发生[10]。此外,研究发现,在相同的条件下,用同样的转化方法转化同一种外源基因,所获得的转基因植株间不仅外源基因表达水平差异很大,而且由于转基因的间接作用还可能使转基因植物出现额外的表型变异[11],这可能是由于DNA插入位点不同而造成的,从而在一定程度上限制了转基因植物的商品化进程[9]。本研究中采用qRT-PCR方法检测AVP1基因在甜菜中的表达特性,结果表明目的基因在甜菜继代培养植株中稳定存在,在转基因甜菜中正常表达,但在根和叶中的表达强度不同。在温室盆栽培养条件下,转AVP1基因甜菜与野生型植株生长表现无差异,说明该外源靶基因的插入并未对其生长发育产生不利影响。
甜菜对磷需求量大,但甜菜的主要产区的北方地区土壤普遍磷供应不足,因有效磷浓度低、磷肥利用率低等条件对甜菜生产造成一定的限制。土壤中磷素容易被固定,因此植物根系发育程度对磷的吸收起重要作用[12]。研究表明H+-焦磷酸酶编码基因的过表达可促进多种植物根系的生长和发育[4-5]。本研究比较了转AVP1基因甜菜和野生型甜菜的低磷耐受性,研究结果表明利用生物技术手段在甜菜中过表达AVP1基因提高甜菜对磷的吸收,从而提高低磷条件下甜菜的产质量是可选择的有效途径。
干旱、高盐等是限制植物生长的主要非生物胁迫因素,利用生物技术手段将与耐盐抗旱特性相关的外源基因引入植物中,进而选育耐盐抗旱新品种一直是植物抗逆研究的研究热点[13]。不同非生物逆境条件可对植物细胞膜造成氧化伤害及引起渗透胁迫,进而影响相关生理代谢过程[14]。本研究中通过分析转AVP1基因甜菜在干旱胁迫和盐胁迫下的生理生化指标表明,在相关逆境胁迫下MDA含量均有所增加,但与野生型植株相比,转基因材料具有较低MDA含量和较高游离脯氨酸含量。可见外源基因AVP1的表达一定程度上保护了细胞的膜系统,同时转基因甜菜可通过自身积累游离脯氨酸参与渗透调节,缓解相关逆境条件造成的渗透胁迫,增强转化植株对相关逆境胁迫的耐受性,从而可以更好地适应干旱或盐胁迫环境。
本研究以AVP1基因转化甜菜,结果显示AVP1基因可在甜菜地上、地下部表达,且逆境胁迫条件下表达量增强,转AVP1基因甜菜具有比野生型甜菜更高的磷素吸收利用效率;干旱、盐胁迫处理条件下,AVP1基因在转基因甜菜中显著上升,与野生型植株相比,转基因植株体内MDA含量较低而脯氨酸含量显著增加,AVP1基因可减轻逆境对甜菜细胞膜损伤,提高甜菜细胞渗透调节能力,由此可见AVP1基因过量表达一定程度上提高了转基因甜菜的磷素吸收能力和耐盐性、抗旱性,这对培育甜菜新品系创制了新的育种材料。随着对H+-PPase功能的逐渐了解,以及对植物抗逆分子机制的研究和生物技术不断完善,有望为培育高效、耐盐、抗旱同时具有高效磷吸收能力的甜菜新品种开辟新的途径。
