体外产气法评价菌酶协同发酵对花棒瘤胃发酵特性的影响
2023-12-04杨双鸣马煜斌赵晓清王笠年王文倩徐晓锋
杨双鸣 马煜斌 田 梅 沈 艳 赵晓清 王笠年 王文倩 苟 妍 徐晓锋*
(1.宁夏大学动物科技学院,银川 750021;2.宁夏大学林业与草业学院,银川 750021;3.额尔克哈什哈苏木综合保障和技术推广中心,阿拉善左旗 750316)
随着国内市场对粗饲料的需求增多,优质粗饲料供应短缺问题愈发严重[1],寻找新的非常规饲料资源已成为畜牧业的主要研究内容,以减少对常规饲料的依赖。花棒(Hedysarumscoparium),别名细枝岩黄耆,为荒漠地区豆科大灌木[2],其纤维木质化程度较高,适口性较差,导致花棒直接饲喂效果较差,但有研究表明花棒的相对饲用价值和有机物消化率较高[3],是一种具有潜在饲用价值的非常规粗饲料资源,可是目前将花棒用于饲料利用和营养价值研究还不够充分。
微生物发酵技术是把植物原料按比例添加1种或多种有益微生物菌剂,在密闭和适宜的条件下,通过有益微生物的繁殖与发酵作用,把原料分解成蛋白质、多糖等大分子物质,生成有机酸、小肽和维生素等有益代谢物[4],同时能有效降低饲料中的抗营养因子水平,提高饲料利用率[5]。体外产气法具有简便易行、重复性好、容易标准化操作等优点[6],目前大多采用体外产气法来研究饲料的营养价值。因此,本研究通过体外产气法探究菌酶协同发酵对花棒瘤胃发酵特性的影响,旨在为花棒的开发利用及其家畜饲养中应用提供依据。
1 材料与方法
1.1 试验材料
试验材料选取内蒙古自治区阿拉善盟阿拉善左旗额尔克哈什哈苏木于5月进行全株刈割的花棒,对所采花棒立即机械揉丝粉碎,混合均匀,后用作微贮试验材料。添加剂:糖蜜、地衣芽孢杆菌(由山东某生物工程有限公司提供,活菌数为1×1011CFU/g)、乳酸杆菌(由山东某生物工程有限公司提供,活菌数为1×1010CFU/g)、纤维素酶(由北京某科技有限公司提供,活性为5×104U/g)。
1.2 瘤胃液供体动物及饲养管理
选取1头健康、装有永久性瘤胃瘘管的中国荷斯坦奶牛为瘤胃液供体动物,奶牛饲粮精粗比为30∶70(风干基础),基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) %
1.3 试验设计和样品制备
试验采用完全随机试验设计,共分为4组,对照组(CK组)不添加任何菌酶剂,J组添加5×106U/g植物乳杆菌和1×106U/g地衣芽孢杆菌,M组添加50 U/g纤维素酶,JM组添加5×106U/g植物乳杆菌、1×106U/g地衣芽孢杆菌和50 U/g纤维素酶,各组均添加5%的糖蜜辅助发酵,每组3个重复。
将揉丝过的花棒切为2~3 cm,混合均匀,加入蒸馏水使水分含量在60%左右,将相应添加剂与花棒搅拌均匀装入微贮袋(45 cm×26 cm),每袋300 g,每组设置3个重复,最后用真空封口机封口,置室内25 ℃左右避光保存,分别在微贮的第7、14、30、60天取样。微贮花棒样品经过65 ℃干燥48 h制成风干样,粉碎过1 mm筛,密封保存备用,经测定,各组微贮花棒营养成分见表2。
1.4 瘤胃发酵培养液制备
于晨饲后2 h,通过瘘管装置在奶牛瘤胃的不同位置采集瘤胃液,将采集到的瘤胃液充分混合后用4层纱布过滤处理,立刻放入通有二氧化碳的保温瓶(39 ℃热水预热)中带回实验室。人工瘤胃液参考Menke等[7]的方法配制,将配制好的混合缓冲液与置于39 ℃水浴锅中,并迅速将制备好的瘤胃液按比例(缓冲液:瘤胃液配比为2∶1)加入即可得到瘤胃发酵培养液。
1.5 瘤胃体外发酵试验
以微贮的花棒作为体外发酵底物,进行模拟体外瘤胃发酵。试验分批次进行,共分为4组(CK组、J组、M组、JM组),每组6个重复,同时设置空白组(6个重复),用以校正产气量(空白组只添加人工瘤胃培养液,无饲料),培养管为100 mL玻璃注射器,最小刻度为1 mL,注射器前端安装乳胶管,用乳胶管夹子进行封闭。分别准确称取约200 mg样品于培养管内,向各培养管内加入约30 mL混合培养液,倒置于已充分预热(39 ℃)的水浴摇床内。记录培养管活塞的初始刻度值(mL),启动水浴摇床开始培养,进行72 h体外瘤胃培养。
1.6 测定指标及方法
总产气量测定:分别记录培养3、6、9、12、24、36、48、72 h时各培养管的刻度值(mL)。某时间点实际产气量等于该时间点活塞位置读数减去该培养管初始读数。
产气参数的计算根据Ørskov等[8]动态发酵参数模型公式:
GP=a+b(1-exp-ct)。
式中:GP为t时间点累积产气量(mL);t为发酵开始中某一时间(h);a为快速产气量(mL);b为慢速产气量(mL);c为产气速度(%/h)。
根据非线性最小二乘法原理,将不同时间点的体外产气量代入,可计算出快速产气量、慢速产气量、产气速度等产气动力参数。
pH:培养液发酵结束后,迅速用冰水混合物冷凝发酵液,将pH计探头插入培养液中,待稳定后记录数值。
采用比色法[9]测定氨态氮(NH3-N)浓度,采用考马斯亮蓝法[10]测定微生物蛋白(MCP)浓度,采用日本岛津GC-2030气相色谱仪[11]测定乙酸、丙酸和丁酸等挥发性脂肪酸(VFA)浓度。
1.7 数据统计分析
所有试验数据用Excel 2019软件进行记录整理,以SPSS 22.0统计软件中的ANOVA程序进行单因素方差分析,并采用Duncan氏法进行各组间的多重比较,以P<0.05表示差异显著,试验数据用平均值±标准差表示。
2 结果与分析
2.1 菌酶协同发酵对花棒体外产气参数的影响
由表3可知,随发酵时间的增长,J组和JM组快速产气量整体呈增长趋势,J组、M组和JM组在发酵第60天的快速产气量均显著高于发酵第7、14天(P<0.05)。在发酵第14天,JM组慢速产气量显著高于对照组(P<0.05),在发酵第30、60天,J组和JM组慢速产气量显著高于对照组(P<0.05)。J组在发酵第30天的慢速产气量显著高于发酵第14天和第60天(P<0.05);M组在发酵第60天的慢速产气量显著高于发酵第14和30天(P<0.05)。

表3 菌酶协同发酵对花棒体外产气参数的影响Table 3 Effects of cooperative fermentation by bacteria and enzymes on in vitro gas production parameters of Hedysarum scoparium
2.2 菌酶协同发酵对花棒体外瘤胃发酵参数的影响
由表4可知,J组和M组在4个不同发酵时间pH均无显著差异(P>0.05)。在发酵第14天,J组和M组pH显著低于对照组(P<0.05)。JM组在发酵第60天的pH显著低于发酵第7和14天(P<0.05)。
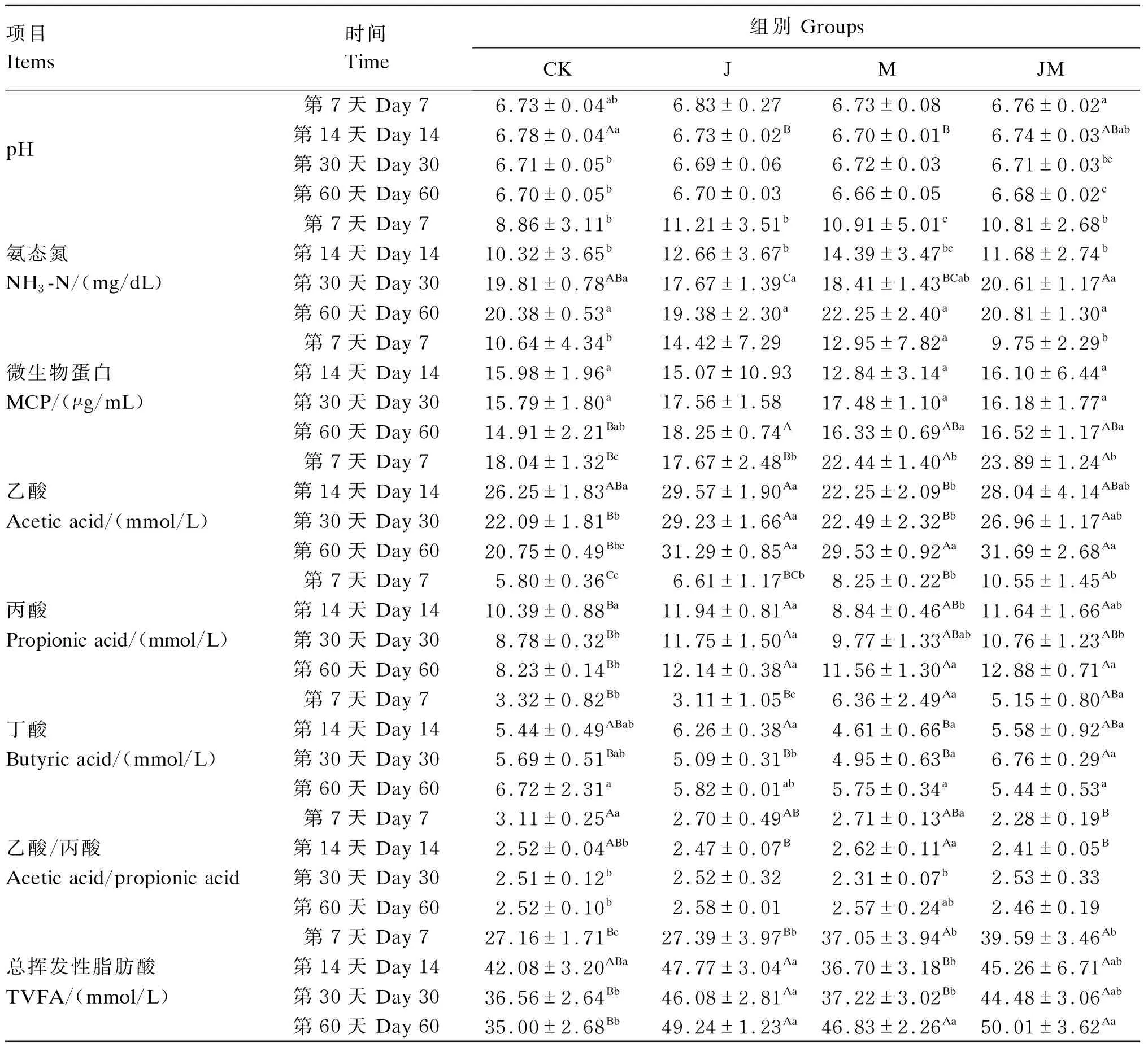
表4 菌酶协同发酵对花棒体外瘤胃发酵参数的影响Table 4 Effects of cooperative fermentation by bacteria and enzymes on in vitro rumen fermentation parameters of Hedysarum scoparium
在发酵第7天,M组和JM组乙酸、丙酸浓度均显著高于对照组(P<0.05),J组、M组和JM组MCP浓度与对照组无显著差异(P>0.05)。在发酵第14天,J组和JM组丙酸浓度显著高于对照组(P<0.05),J组乙酸、丁酸浓度显著高于M组(P<0.05)。在发酵第30天,JM组NH3-N浓度显著高于J组和M组(P<0.05),J组和JM组乙酸和总挥发酸浓度显著高于对照组(P<0.05),J组丙酸浓度显著高于对照组(P<0.05),JM组丁酸浓度显著高于对照组(P<0.05)。在发酵第60天,各组之间NH3-N浓度差异不显著(P>0.05);J组MCP浓度显著高于对照组(P<0.05),J组、M组和JM组MCP浓度无显著差异(P>0.05);J组、M组和JM组乙酸、丙酸和总挥发酸浓度均显著高于对照组(P<0.05)。
J组和JM组在发酵第30和60天的NH3-N浓度显著高于发酵第7和14天(P<0.05);M组在发酵第60天的乙酸浓度显著高于发酵第7、14和30天(P<0.05),J组和JM组在发酵第60天的乙酸浓度显著高于发酵第7天(P<0.05);J组在发酵第14、30、60天的丙酸浓度显著高于发酵第7天(P<0.05),M组在发酵第60天的丙酸浓度显著高于发酵第7、14天(P<0.05),JM组在发酵第60天的丙酸浓度显著高于发酵第30天(P<0.05)。其中JM组的乙酸、丙酸和总挥发酸浓度较高,分别为31.69、12.88和50.01mmol/L。通过以上的分析,在发酵第60天,JM组的体外瘤胃发酵效果较好。
3 讨 论
3.1 菌酶协同发酵对花棒体外产气量的影响
产气量是反刍动物瘤胃底物发酵程度的综合指标,产气量与瘤胃细菌的活性呈正相关,饲料中可发酵的有机物含量越多,产气量越高。袁玖等[12]通过体外研究发现,饲料体外发酵快速产气量为负值,说明饲料可能存在产气滞后效应。本试验中,J组和JM组在发酵第7天和14天时快速产气量都存在产气滞后效应;有研究表明,快速产气量与粗蛋白质含量呈正相关[13],随着花棒微贮发酵时间增长,粗蛋白质含量有明显改善,各组发酵第60天时快速产气量也显著高于发酵第7天,而慢速产气量随发酵时间增长而没有显著变化,J组和JM组在微贮第60天的慢速产气量均显著高于对照组,可能是瘤胃中琥珀酸、丙酸代谢途径增强,导致丙酸和二氧化碳产量上升,引起瘤胃空间体积的变化[14],说明添加地衣芽孢杆菌和植物乳杆菌具有提高花棒微贮体外瘤胃消化率的潜力。任亚琼等[15]研究发现,添加植物乳杆菌和地衣芽孢杆菌的微贮玉米秸秆在瘤胃发酵48 h产气量最高,说明发酵过程中地衣芽孢杆菌、植物乳杆菌协同效果较好,充分发酵底物。本试验中,添加纤维素酶的M组在发酵第60天的产气量高于对照组,体外产气量与瘤胃干物质降解率呈正相关[16],产气量越高,干物质降解率越高。曾辉等[17]研究表明,纤维素酶能够打破植物饲料的细胞壁,植物中纤维降解,提高纤维素的比表面积,使细胞壁对瘤胃微生物的抗性减弱,提高饲料与瘤胃中的消化酶的接触面积,从而使饲料更容易被消化,提高瘤胃降解率,产气量升高。随着发酵时间的延长,各组的产气量也逐渐增加。Sun等[18]用纤维素酶或乳酸杆菌处理玉米青贮秸秆及其组分的体外产气参数,包括最大产气率、产气速率和滞后时间均得到了改善。
3.2 菌酶协同发酵对花棒体外瘤胃发酵参数的影响
pH是瘤胃主要的发酵参数之一,瘤胃pH正常范围在6.0~7.0[19],主要受瘤胃上皮对挥发酸的吸收、饲料外流速率和唾液分泌量的影响[20]。同时植物乳杆菌接种确保了有足够数量的产酸细菌,从而导致pH迅速降低,这将有助于减少不良发酵,减少蛋白质水解。此外,添加纤维素酶导致了微贮中更多的乳酸生产。本试验中pH为6.66~6.83,各组的瘤胃发酵pH均在正常范围内,说明各组的体外发酵比较平稳,不会对瘤胃pH造成影响[21],对维持瘤胃内环境稳态有积极影响。
NH3-N是蛋白质类有机物在瘤胃中消化代谢的中间产物,其含量是反映瘤胃发酵底物中蛋白质降解程度的重要指标之一[22]。瘤胃微生物不仅可以利用NH3-N合成MCP,也可以分解饲料中蛋白质生成NH3-N,在瘤胃微生物区系中,大部分微生物将NH3-N作为唯一氮源[23]。瘤胃中NH3-N浓度受采食量、微生物的利用效率、营养物质消化率和瘤胃生态的影响。有学者研究发现,瘤胃中NH3-N浓度与饲粮中粗蛋白质含量和蛋白质降解速度呈正相关[24]。本试验中,JM组和M组在微贮发酵第60天的NH3-N浓度均高于对照组,推测添加复合菌和纤维素酶促进了体外发酵瘤胃微生物对微贮发酵底物中含氮化合物的分解,使NH3-N浓度升高。
MCP是反刍动物最主要的氮源,是瘤胃微生物通过利用各种养分来合成的微生物体蛋白,占进入小肠非NH3-N的60%~80%。本试验中,M组和JM组在发酵第60天的MCP浓度高于对照组,由于微贮发酵提高了快速产气量,使降解碳水化合物组分速率增加,为MCP的合成提供了更多发酵底物。这说明复合菌和纤维素酶处理花棒利于提高MCP浓度;但J组NH3-N浓度较低,可能是植物乳杆菌和地衣芽孢杆菌微贮花棒的协同作用,促进瘤胃微生物对NH3-N的利用[25],提高了MCP的合成。
挥发性脂肪酸主要是由微生物发酵碳水化合物和氨基酸产生,主要包括乙酸、丙酸、丁酸,可为反刍动物提供总能量的70%~80%[26],是反刍动物赖以生存的主要能量来源。乙酸和丙酸是瘤胃中浓度较高并影响瘤胃发酵类型的2种挥发性脂肪酸。乙酸是瘤胃微生物活动的主要产物,在反刍动物体内主要用于合成乳脂,丙酸是肝脏糖异生的主要底物,主要用于合成体脂和乳糖,因此乙酸/丙酸可以反映能量利用的情况。本试验中,J组、M组和JM组在发酵第60天时乙酸、丙酸含量均显著高于对照组,添加植物乳杆菌和纤维素酶促进了微贮饲料中碳水化合物在瘤胃中的降解[27],而地衣芽孢杆菌可分泌纤维素酶[28],进一步促进对反刍动物瘤胃中的纤维物质降解,进而改善瘤胃发酵。J组和JM组在发酵第60天时乳酸含量较高,乳酸或丙酮酸转化为丙酸[29]。当乳酸在瘤胃中由乳酸利用菌进行二次发酵时,一般会产生丙酸,高乳酸含量微贮饲料可能提高了瘤胃发酵中丙酸产量[30]。李娅楠[31]研究发现,在稻草中添加植物乳杆菌与地衣芽孢杆菌复合微贮能提高体外瘤胃发酵总挥发性脂肪酸浓度,提高了稻草的营养价值。本试验中,添加植物乳杆菌、地衣芽孢杆菌与纤维素酶在花棒微贮发酵第60天时,总挥发性脂肪酸浓度较高且显著高于对照组,说明添加植物乳杆菌、地衣芽孢杆菌与纤维素酶对体外发酵效率有协同作用,对花棒的营养价值有积极影响。
4 结 论
① 各组随发酵时间的增长,快速产气量逐渐增加,其中添加植物乳杆菌、地衣芽孢杆菌与纤维素酶在发酵第60天时快速产气量最高。
② J组、M组和JM组在发酵第60天时的乙酸、丙酸和总挥发性脂肪酸浓度均显著高于对照组,说明添加植物乳杆菌、地衣芽孢杆菌与纤维素酶对体外发酵效率有协同作用,对花棒的营养价值有积极影响。
