L-精氨酸对脂多糖应激下大鼠抗氧化能力、免疫功能和肠道健康的影响
2023-12-04焦靖娴彭煜畅孟小龙刘慧茹甄东恒张立阳
焦靖娴 王 瑶 彭煜畅 孟小龙 刘慧茹 甄东恒 张立阳 张 薇 付 彤
(河南农业大学动物科技学院,河南省家畜营养调控与生态养殖国际联合实验室,郑州 450046)
蛋白质是动物机体生长发育的基础,氨基酸的组成与来源、氨基酸的平衡及供给量与动物健康及生产性能密切相关。精氨酸(arginine,Arg)是一种半必需或条件性必需氨基酸,分为D-Arg和L-Arg。L-Arg是一种功能性氨基酸,机体几乎所有的组织都使用L-Arg来合成细胞质蛋白和核蛋白,可促进蛋白质合成、细胞分裂、伤口恢复、激素分泌等生理过程[1]。已证实Arg可以促进肌肉蛋白质合成、多胺和激素的产生,从而提高动物的生长性能和促进营养素吸收[2]。研究显示,饲粮中添加1.44%的Arg可显著增加肉鸡14、28和42日龄体重,提高其生长性能[3]。此外,Arg具有较强的清除自由基能力,能够提高动物机体的抗氧化能力,缓解畜禽氧化应激[4-5]。Mo等[6]研究发现,饲粮中补充Arg可调节抗氧化相关信号分子的表达,提高抗氧化酶的活性,减轻机体氧化应激损伤,提高抗氧化能力。Arg不仅参与各种营养物质的合成和分解代谢,还具有营养和免疫调节的双重作用,可改善肠道黏膜屏障功能,维护肠道健康[7]。Yu等[3]的研究结果表明,添加不同水平的L-Arg可提高十二指肠和回肠的绒毛高度,促进雏鸡早期肠道黏膜发育。脂多糖(LPS)是革兰氏阴性菌外膜的主要成分,是先天免疫反应的有力激活剂,腹腔注射LPS是构建动物免疫应激模型最常用的方法之一。目前,关于Arg对免疫应激条件下动物抗氧化能力、免疫功能和肠道健康方面的研究相对较少。因此,本研究以SD大鼠为研究对象,通过腹腔注射LPS模拟大鼠免疫应激模型,探究L-Arg对大鼠抗氧化能力、免疫功能和肠道健康的影响,以期为L-Arg在畜禽养殖中的应用提供理论依据。
1 材料与方法
1.1 试验材料
雄性SD大鼠购自北京维通利华实验动物技术有限公司;L-Arg购自广州某药业有限公司,纯度>98%,白色粉末;LPS(血清型055:B5)购自于美国Sigma公司。
1.2 试验设计
选取体重相近[(180.18±10.00) g]的健康雄性大鼠24只,随机分为2组,分别为空白对照组(CON组)和L-Arg处理组(L-Arg组),每组6个重复,每个重复2只。L-Arg和LPS溶于无菌生理盐水制备成L-Arg溶液和LPS溶液,用于后续试验灌胃和腹腔注射。L-Arg组每日灌胃2 mLL-Arg溶液(0.2 g/kg BWL-Arg),CON组每日灌胃等量生理盐水。试验为期18 d,其中预试期3 d,正试期15 d,试验期间确保大鼠自由采食,充足饮水。正式试验第14天,每个重复随机挑选1只大鼠(每组6只)腹腔注射2 mL LPS溶液(2 mg/kg BW LPS),其余大鼠注射等量无菌生理盐水。依据是否注射LPS,将大鼠重新分为4组(CON组、L-Arg组、LPS组、L-Arg+LPS组)。注射LPS后禁食12 h,之后进行屠宰采样。
基础饲粮组成及营养水平见表1。饲粮中粗蛋白质含量的测定参照GB/T 6432—2018,粗脂肪含量的测定参照GB/T 6433—2006,钙含量测定参照GB/T 6436—2018中的乙二胺四乙酸二钠络合滴定法,总磷含量的测定参照GB/T 6437—2018。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.3 样品采集
在正式试验第15天(LPS注射后12 h),使用戊巴比妥钠将大鼠麻醉后,对所有大鼠进行心脏取血,血液静置30 min后,4 000 r/min离心10 min制备血清,-20 ℃低温保存备用。采血后用颈椎脱臼法处死大鼠并进行解剖,快速收集肝脏、脾脏和胸腺,剔除表面脂肪后称重并置于液氮保存;分离出肠道,采集部分回肠纵向剪开,用预冷的生理盐水冲洗食糜,随后用无菌载玻片刮取回肠黏膜,分装于2 mL冻存管中,于-80 ℃保存备用。另取回肠中端2 cm,于4%多聚甲醛固定液中固定,进行回肠形态学观察。
1.4 测定指标及方法
1.4.1 生长性能测定
试验期间每天记录每个笼中大鼠的饲喂量和剩料量,并计算大鼠的采食量,每间隔5 d对大鼠进行空腹称重,计算大鼠的平均日采食量(ADFI)、平均日增重(ADG)以及料重比(F/G)。
1.4.2 免疫器官指数测定
根据免疫器官重量和宰前体重计算免疫器官指数,计算公式如下:
肝脏指数(%)=[肝脏鲜重(g)/
宰前体重(g)]×100;
胸腺指数(%)=[胸腺鲜重(g)/
宰前体重(g)]×100;
脾脏指数(%)=[脾脏鲜重(g)/
宰前体重(g)]×100。
1.4.3 血清生化指标测定
从冰箱取出血清室温融化并混匀后,采用全自动血清生化分析仪(Beckman Coulter AU5800)对血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)的活性与总蛋白(TP)、白蛋白(ALB)、总胆固醇(TCHO)、甘油三酯(TG)和葡萄糖(Glu)含量进行测定。
1.4.4 血清免疫球蛋白和炎性细胞因子含量测定
从冰箱取出血清室温融化并混匀后,使用酶联免疫吸附测定(ELISA)试剂盒测定血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)含量。试剂盒购自南京建成生物工程研究所,试验操作按照说明书要求进行。
1.4.5 血清和回肠黏膜抗氧化指标测定
从冰箱取出血清室温融化并混匀,将冷冻保存的回肠黏膜解冻后制备成10%匀浆液,严格按照试剂盒(南京建成生物工程研究所)说明书所示的试验条件和操作步骤采用多功能酶标仪(Thermo Fisher Scientific公司,美国)测定血清和回肠黏膜中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性,丙二醛(MDA)含量及总抗氧化能力(T-AOC)。
1.4.6 回肠组织形态学观察
回肠组织在4%多聚甲醛固定液中固定24 h后,进行常规脱水与石蜡包埋处理,5 μm厚度切片。切片苏木精-伊红(HE)染色后在40倍显微镜视野下观察,采用Motic images advanced 3.2病理图像分析系统测量绒毛高度、绒毛宽度和隐窝深度,并计算绒毛高度与隐窝深度的比值。
1.5 数据统计与分析
试验数据应用SPSS 26.0软件进行统计分析,生长性能数据采用独立样本t检验进行差异分析,其余数据采用one-way ANOVA程序进行单因素方差分析,并采用Duncan氏法进行多重比较检验。结果均以平均值与均值标准误(SEM)表示,P<0.05为差异显著,0.05≤P<0.10为差异有显著的趋势。
2 结果与分析
2.1 L-Arg对大鼠生长性能的影响
由表2可知,与CON组相比,L-Arg组大鼠第10天体重、末重和ADFI均显著升高(P<0.05),而初重、第5天体重、ADG和F/G无显著差异(P>0.05)。

表2 L-Arg对大鼠生长性能的影响Table 2 Effects of L-Arg on growth performance of rats
2.2 L-Arg对LPS攻毒大鼠免疫器官指数的影响
由表3可知,各组间肝脏指数、胸腺指数以及脾脏指数均无显著差异(P>0.05)。

表3 L-Arg对LPS攻毒大鼠免疫器官指数的影响Table 3 Effects of L-Arg on immune organ indexes of rats challenged by LPS %
2.3 L-Arg对LPS攻毒大鼠血清生化指标的影响
由表4可知,与CON组相比,LPS组大鼠血清ALT和AST活性显著升高(P<0.05),ALB和TP含量显著下降(P<0.05);与LPS组相比,L-Arg处理显著降低LPS攻毒大鼠血清ALT和AST活性(P<0.05),显著提高ALB和TP含量(P<0.05)。

表4 L-Arg对LPS攻毒大鼠血清生化指标的影响Table 4 Effects of L-Arg on serum biochemical indexes of rats challenged by LPS
2.4 L-Arg对LPS攻毒大鼠血清免疫球蛋白及炎性细胞因子含量的影响
由表5可知,与CON组相比,LPS组大鼠血清免疫球蛋白IgA、IgG、IgM以及炎性细胞因子IL-1β、IL-6、IL-8和TNF-α含量显著上升(P<0.05);与LPS组相比,L-Arg处理显著降低LPS攻毒大鼠血清免疫球蛋白IgA、IgG、IgM以及炎性细胞因子IL-1β、IL-8和TNF-α含量(P<0.05)。

表5 L-Arg对LPS攻毒大鼠血清免疫球蛋白及炎性细胞因子含量的影响Table 5 Effects of L-Arg on serum immunoglobulin and inflammatory cytokine contents of rats challenged by LPS
2.5 L-Arg对LPS攻毒大鼠血清抗氧化指标的影响
由表6可知,与CON组相比,LPS组大鼠血清MDA含量显著上升(P<0.05),CAT活性和T-AOC显著下降(P<0.05),SOD活性则有显著下降的趋势(0.05≤P<0.10),而L-Arg组血清CAT活性显著上升(P<0.05);与LPS组相比,L-Arg处理显著降低LPS攻毒大鼠血清MDA含量(P<0.05),显著提高T-AOC(P<0.05)。
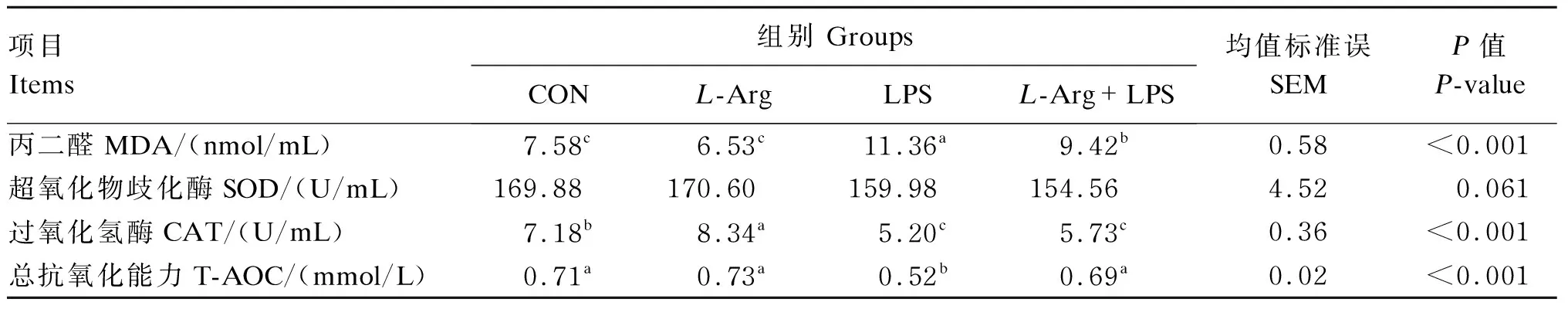
表6 L-Arg对LPS攻毒大鼠血清抗氧化指标的影响Table 6 Effects of L-Arg on serum antioxidant indexes of rats challenged by LPS
2.6 L-Arg对LPS攻毒大鼠回肠组织形态的影响
图1所示为大鼠回肠HE染色图片。对回肠组织切片进行观察发现,各组大鼠回肠绒毛结构完整,边缘刷状缘结构连续规则。由表7可知,与CON组和LPS组相比,L-Arg组与L-Arg+LPS组大鼠回肠绒毛高度显著升高(P<0.05),绒毛高度与隐窝深度的比值显著升高(P<0.05);此外,与CON组和LPS组相比,L-Arg组大鼠回肠隐窝深度显著降低(P<0.05);各组大鼠回肠绒毛宽度无显著差异(P>0.05)。

表7 L-Arg对LPS攻毒大鼠回肠组织形态的影响Table 7 Effects of L-Arg on ileum morphology of rats challenged by LPS
2.7 L-Arg对LPS攻毒大鼠回肠黏膜抗氧化指标的影响
由表8可知,与CON组相比,LPS组大鼠回肠黏膜MDA含量显著升高(P<0.05),CAT活性和T-AOC显著下降(P<0.05),而L-Arg组MDA含量显著下降(P<0.05),CAT活性显著上升(P<0.05);与LPS组相比,L-Arg处理显著提高LPS攻毒大鼠回肠黏膜CAT活性及T-AOC(P<0.05)。

表8 L-Arg对LPS攻毒大鼠回肠黏膜抗氧化指标的影响Table 8 Effects of L-Arg on antioxidant indexes in ileum mucosa of rats challenged by LPS
3 讨 论
3.1 L-Arg对大鼠生长性能的影响
Arg是生长激素(GH)、胰岛素(INS)和胰岛素样生长因子-1(IGF-1)等激素的促分泌剂,血液中相关激素的增加促使动物机体的蛋白质合成增加,进而影响动物的生长发育[8]。Arg在动物机体内分解代谢会形成一氧化氮(NO),在多种酶的作用下生成多胺,而多胺可与核酸分子相互结合,提高核酸的稳定性,促进蛋白质的翻译,合成肌肉蛋白质,从而稳定细胞结构及促进细胞增殖,改善动物生长发育状况[9]。相关研究表明,饲粮中添加Arg能显著提高仔猪[10]和肉鸡[11]的体重和ADFI。本试验获得了相似的结果,灌喂L-Arg可以显著提高大鼠的ADFI,且试验第10天时体重出现显著增长的现象。由此可知,L-Arg能够增加大鼠的采食量,进而提高其生长性能。
3.2 L-Arg对LPS攻毒大鼠免疫器官指数的影响
免疫器官是身体发挥免疫功能的组织结构,是淋巴细胞和其他免疫细胞协同聚集、分化、增殖并产生免疫反应的地方。一般来说,人们认为免疫器官指数的增加意味着动物的免疫系统成熟得更快[12-13]。有研究表明,饲粮Arg缺乏会显著降低肉鸡的脾脏指数、胸腺指数和法氏囊指数,而饲粮添加高水平Arg可显著提高肉鸡脾脏指数和胸腺指数[14]。然而,也有报道显示饲粮补充Arg对肉鸡的器官(肝脏、肌胃、心脏、胸腺、法氏囊和脾脏)重量无显著影响[15]。本试验结果显示,灌喂L-Arg对大鼠的肝脏指数、胸腺指数以及脾脏指数均无显著影响,这可能是因为不同物种对Arg的响应有所差别。
3.3 L-Arg对LPS攻毒大鼠血清生化指标的影响
血清生化指标可以在一定程度上反映动物的健康状况、营养状况和对环境的适应性。当肝细胞受损时,细胞膜完整性受损,转氨酶(ALT和AST)从肝细胞释放到血液中,导致血清ALT和AST活性升高[16]。因此,通常以血清ALT和AST活性的升高作为肝脏病变严重程度的基本生化指标。血清TP含量可以反映机体的营养状况,而ALB是一种由肝脏产生的蛋白质,占血浆TP的40%~50%,其含量通常与肝脏的合成功能有关[17]。本试验中,LPS处理导致大鼠与肝毒性相关的指标血清ALT和AST活性显著升高,ALB和TP含量显著下降,与前人报道结果[18]一致。此外,L-Arg处理可以在一定程度上降低LPS攻毒大鼠血清ALT和AST活性,提高ALB和TP含量,表明L-Arg处理可以预防LPS诱导的部分损伤,对肝脏功能具有一定保护作用。L-Arg已被证明可通过诱导诱导性一氧化氮合酶(iNOS)表达和NO合成预防急性胆汁淤积症中的肝脏损伤,而NO主要负责血管舒张和抑制血小板及巨噬细胞的活性[19],这可能是L-Arg改善肝脏功能的潜在机制。
3.4 L-Arg对LPS攻毒大鼠血清免疫球蛋白及炎性细胞因子含量的影响
免疫球蛋白(IgM、IgA和IgG)均由B淋巴细胞产生,是体液免疫中的重要效应分子,可以中和细菌毒素的毒性,增强单核巨噬细胞的吞噬作用,并结合病毒抗原调节免疫。IgM主要参与对外来物质的反应,由补体系统的激活介导;IgA是一种单体,驱动黏膜对病原体的反应;IgG也是单体结构,是最丰富的免疫球蛋白,参与对抗毒素和病毒的第二反应[20]。已知这些免疫球蛋白在LPS攻击过程中介导免疫反应。与先前的研究报道[21]一致,本试验结果显示LPS处理显著增加大鼠血清IgA、IgG和IgM含量,尽管L-Arg单独处理不会显著改变血清免疫球蛋白含量,但L-Arg处理可以降低LPS诱导的血清免疫球蛋白含量升高,表明LPS处理可诱发机体体液免疫反应,免疫系统过度激活,而L-Arg对LPS导致的体液免疫反应有一定的调节作用。众所周知,炎性细胞因子对参与先天免疫反应过程至关重要,炎性细胞因子分为促炎和抗炎细胞因子2类。在这些炎性细胞因子中,TNF-α是促炎细胞因子的原型,可导致许多致病过程,如牙周炎和急性肺损伤[22]。同样,IL-1β是从巨噬细胞释放的白细胞介素-1(IL-1)家族中被研究最多的成员,IL-6是急性期反应的主要调节因子之一[23]。IL-8可以将各种炎症细胞募集到损伤中,从而加剧炎症反应,因此,它被视为一种趋化因子[24]。先前的研究表明,在LPS诱导的小鼠应激模型中,血清中炎性细胞因子TNF-α、IL-1β、IL-6和IL-8的产生显著增加[25]。本试验获得同样的结果,LPS处理显著提高大鼠血清TNF-α、IL-1β、IL-6和IL-8等炎性细胞因子含量,而L-Arg单独处理对血清炎性细胞因子含量无显著影响,但L-Arg处理可以通过减少炎症细胞因子的表达和释放,缓解LPS诱导的应激反应。L-Arg对炎症反应的负调控可能是通过增强蛋白激酶B(AKT)、哺乳动物雷帕霉素靶蛋白(mTOR)和核糖体蛋白S6激酶1(S6K1)的磷酸化表达激活磷脂酰肌醇-3-激酶(PI3K)/AKT/mTOR途径,继而阻断核因子-κB(NF-κB)反式激活来实现的[26]。
3.5 L-Arg对LPS攻毒大鼠血清和回肠黏膜抗氧化指标的影响
在正常生理条件下,机体尤其是细胞内抗氧化剂与氧化剂之间存在微妙的平衡,这种平衡负责协调多种新陈代谢途径,以维持免疫竞争、生长发育以及抗应激的正常进行。当机体内氧化与抗氧化失去平衡,自由基过度产生导致活性氧簇和活性氮簇在体内蓄积,进而引起组织氧化应激损伤。通常,机体可以通过抗氧化防御系统的酶清除过量的自由基,以保护身体免受氧化损伤,而氧化损伤可以通过测量抗氧化酶的活性和MDA的含量来判断[27]。其中,T-AOC作为评价抗氧化系统的综合指标,反映了抗氧化剂在体内的累积作用,在一定范围内其数值越高,表明机体的抗氧化能力越强。SOD和CAT被认为是抗氧化酶系统对抗氧化应激过程中产生的ROS的第1道防线。MDA是ROS和多不饱和脂肪酸在体内反应产生的脂质过氧化物,其含量可以反映氧化损伤的程度,过量产生会引起细胞毒性,因此也是反映动物氧化应激的主要生化指标之一[28]。在本试验中,大鼠腹腔注射LPS后血清及回肠黏膜中MDA含量显著上升,CAT活性和T-AOC显著下降,表明LPS处理导致大鼠产生氧化应激;L-Arg处理可在一定程度上缓解LPS诱导的氧化应激,提高大鼠血清和回肠黏膜T-AOC及回肠黏膜CAT活性,抑制脂质过氧化物产生。研究表明,Arg的抗氧化作用主要通过激活核因子E2相关因子2(Nrf2)/ARE通路诱导下游多种抗氧化基因的表达,减少羟自由基的产生,降低细胞脂质过氧化[29]。此外,Arg能通过精氨酸酶1途径降低猪肠上皮细胞IPEC-2中LPS诱导的氧化应激[30]。L-Arg还可通过生成NO而具有间接抗氧化作用,NO通过中断脂质过氧化的链式反应和开发非自由基新型含氮脂质分子来防止氧化应激[31]。
3.6 L-Arg对LPS攻毒大鼠回肠组织形态的影响
肠道结构的完整性是维持屏障功能的基础,肠上皮由不同类型的细胞组成,由黏液层覆盖,形成屏障,将充满微生物和营养的肠腔与基本上无菌的底层组织隔开[32]。在一定范围内,绒毛高度与小肠营养物质吸收能力呈正相关,隐窝深度与肠道健康呈负相关[33]。Arg主要在小肠中段吸收,在精氨酸酶作用下分解为鸟氨酸和尿素,而鸟氨酸是合成多胺类物质的前体。研究证实,Arg可以提高小肠精胺的浓度,继而促进小肠黏膜上皮细胞的增殖和分化[34],进而提高十二指肠和回肠的绒毛高度,增加绒毛高度与隐窝深度的比值,促进早期肠道黏膜发育,改善肠道黏膜屏障功能[3,35]。本试验结果显示,LPS处理对大鼠回肠组织形态无明显影响,灌喂L-Arg后大鼠回肠绒毛高度以及绒毛高度与隐窝深度的比值均显著提高,与前人结果一致。上述结果说明L-Arg可改善大鼠回肠组织形态,促进肠道黏膜发育。
4 结 论
综上所述,LPS应激可诱导大鼠肝脏损伤、氧化应激和免疫系统过度活化;L-Arg能够促进大鼠生长,并可通过提高机体抗氧化能力、免疫功能以及改善回肠形态而在一定程度上预防和缓解LPS攻毒对大鼠造成的负面影响。
