不同青绿饲料附生微生物交换与组合对青贮品质的影响
2023-12-04张男吉邵鹏程杨兴泽邹彩霞
张男吉 邵鹏程 杨兴泽 林 波 邹彩霞
(广西大学动物科学技术学院,南宁 530005)
青贮是一种利用微生物发酵青绿饲料,使其pH下降,从而长期保存青绿饲料的方法。由于广西地区气候湿热,许多青贮微生物添加剂在南方高温环境下使用时,不能达到预期效果[1-2],所以适应于南方湿热环境的微生物添加剂亟待开发。Cao等[3]发现,植物附生乳酸菌比商业乳酸菌在提高青贮品质上有更好的效果;也有许多研究发现,从西南地区植物表面筛选出的乳酸菌添加剂对青贮品质有更好的改善效果[4-6]。而由新鲜牧草制备的乳酸菌发酵汁[7-8]和预发酵汁[9-10]作为添加剂接种于青贮时,观察到的结果不一致,这可能是由于微生物组成随植物来源而异[11]。青贮发酵品质很大程度上取决于附生微生物群落组成,不同作物的附生微生物有很大差异。Mogodiniyai等[12]对比了几种廉价的灭菌方法,发现高温干燥灭菌对原料的化学组成影响最小,并成功地重构青贮,且发现青贮的发酵质量主要与牧草来源有关,有氧稳定性受微生物的影响[13]。甘蔗尾叶和象草是广西地区重要的青贮原料,甘蔗尾叶的青贮中通常发现有大量的乙醇[14],同时有大量的干物质(DM)损失。象草青贮通常有较高的青贮品质,但也有报道发现,象草青贮过程中有乳酸转变为乙酸和丁酸的现象,导致青贮品质较差[15]。但谢华德等[16]研究发现,甘蔗尾叶和象草的混合青贮品质优于单独青贮。这说明这2种青绿饲料的附生微生物在对青贮品质的影响上可能互补。因此,本试验采用灭菌后重构青贮的方法,探究交换、组合甘蔗尾叶和象草的附生微生物对青绿饲料青贮品质和有氧稳定性的影响,为专用微生物添加剂的研发提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用甘蔗尾叶和象草均采自广西大学实验田,采集时间为2021年1月12日,2种牧草采集后用机器切割成2~3 cm长度,备用。将备用的原料分成2份,一份进行灭菌,另一份用于收集附生微生物。
1.2 附生微生物的收集
根据Mogodiniyai等[17]改良方法来收集植物表面的附生微生物,操作步骤如下:取每种青贮原料3.5 kg,按原料与林格氏液重量1∶9进行浸泡,浸泡时间1 h,实验室振荡器振荡2 min。用3层纱布过滤悬浮液,过滤的纱布浸泡在无菌超纯水中,置于4 ℃冰箱保存备用。将过滤后的悬浮液进行离心,15 000×g离心90 min。丢弃上层液体,将沉淀重新溶解于50 mL林格试液中。
1.3 灭菌材料制备
根据Mogodiniyai等[13]方法进行青贮原料灭菌。操作步骤如下:取预先干燥好的青贮原料放入灭菌的锥形瓶中,每个锥形瓶约可放80 g,用锡箔纸对锥形瓶进行封口(不密封),在烘箱中60 ℃干燥3 h,接着105 ℃干燥15 h。灭菌完成后,用锡箔纸立即将锥形瓶口密封,材料冷却至室温备用。
1.4 试验设计
将灭菌后的甘蔗尾叶(S)和象草(E)分别接种甘蔗尾叶附生微生物(MS)、象草附生微生物(ME)以及两者混合附生微生物(1∶1)(MES)进行青贮。试验共6个处理,分别为E×ME、E×MS、E×MES、S×ME、S×MS和S×MES,每个处理5个重复。
将附生微生物悬浮液经超纯水稀释后按比例添加到青贮灭菌原料中,使其DM含量达40% FM,在超净台混合均匀后,置于250 mL青贮瓶中青贮,每个罐子样品重量约200 g(80 g灭菌材料+220 g材料表面收集的附生微生物),每个处理5个重复。用封口膜缠绕密封青贮瓶,避光放置于室内100 d。开罐后,去除表层取样,立即测定相应指标,并进行为期12 d的有氧稳定性测定,采样时间分别为2、4、6、8、10、12 d。各处理主要附生微生物数量如表1所示。
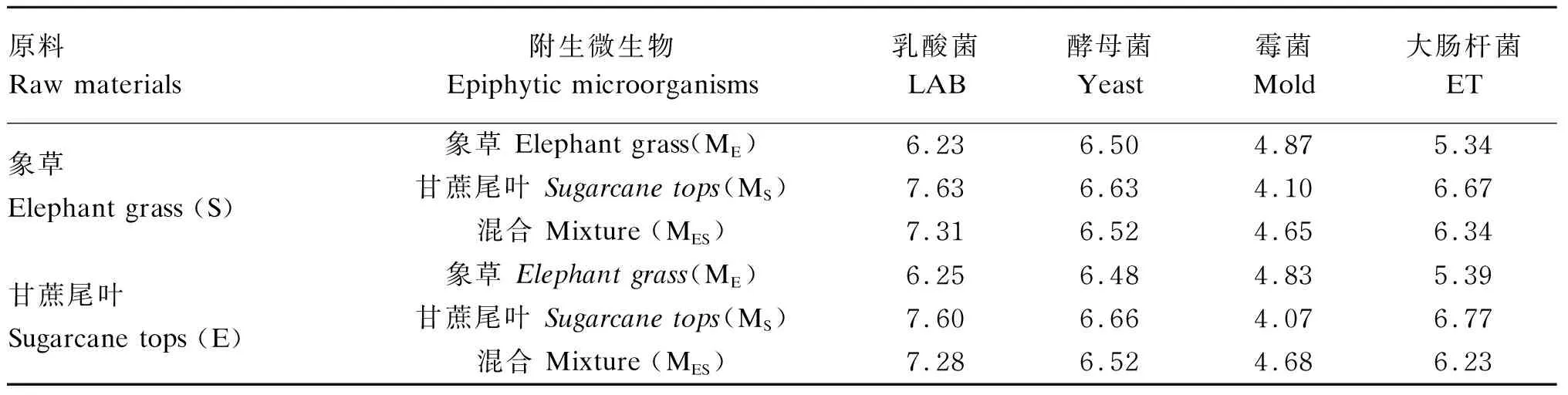
表1 各处理主要附生微生物数量Table 1 Main microorganisms number in each treatment lg(CFU/g FM)
1.5 测定指标
测定灭菌前后及青贮后甘蔗尾叶和象草的常规养分和微生物数量,及青贮后和有氧暴露期间的发酵指标。常规养分包括DM、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、酸性洗涤不溶氮(ADIN)、粗纤维(CF)、粗灰分(Ash)、粗蛋白质(CP)、可溶性碳水化合物(WSC)含量及缓冲容量(BC);微生物计数包括乳酸菌(LAB)、酵母菌(yeast)、霉菌(mold)和大肠杆菌(ET)数量。发酵指标包括pH及乳酸(LA)、氨态氮(NH3-N)、乙醇(ET)、乙酸(AA)、丙酸(PA)和丁酸(BA)含量。
1.6 测定方法
1.6.1 青贮品质测定
青贮后各组样品混匀,取样20 g,加入180 mL林格氏液,搅拌30 min后用4层纱布过滤得浸提液,立即用pH计测定浸提液的pH。将浸提液收集至15 mL离心管,于-20 ℃冰箱冷冻保存,用于后续指标测定。
将浸提液解冻、离心后,采用对羟基联苯法测定浸提液中乳酸含量[18];用苯酚-次氯酸法测定氨态氮含量[19];用Erwin等[20]方法,使用气相色谱仪测定挥发性脂肪酸和乙醇含量。
1.6.2 常规养分测定
取切碎后的新鲜甘蔗尾叶和象草和青贮结束后的青贮样品约100 g,置于烘箱105 ℃烘干2 h后转65 ℃烘48 h,取出放至室温后称重,计算得DM含量。CP和ADIN含量由全自动凯氏定氮仪(Gerhardt)测定[21]。ADF、NDF及CF含量由半自动纤维仪(ANKOM A200i)测定[22]。Ash含量由马弗炉550 ℃灼烧2 h后称重测定。WSC含量利用葡萄糖为标准品,采用蒽酮法比色测定[23]。缓冲容量根据Plane等[24]的方法测定。
1.6.3 有氧稳定性测定
将青贮开封时样品取50 g左右置于250 mL洁净塑料罐中,不封口,不压实,罐口覆盖2层纱布,每组21个重复。每2 d取样1次,每次3个重复。每个重复取20 g样品与灭菌后180 mL林格氏液混合,晃动0.5 h后4层纱布过滤。浸提液用于测定pH及乳酸、氨态氮、挥发性脂肪酸、乙醇含量和青贮相关微生物数量。pH用于分析青贮有氧稳定性,当pH变化小于0.5个单位时,青贮被认为是稳定的[25]。
1.6.4 微生物数量测定
将浸提液用灭菌纯水按梯度从102稀释至10-6,选取适当含量菌液,取200 μL进行涂布培养。乳酸菌选用MRS固体培养基(含纳他霉素),酵母和霉菌选用马铃薯琼脂培养基(含氯霉素),大肠杆菌选用紫红胆盐培养基。乳酸菌于37 ℃培养48 h,酵母和霉菌于28 ℃培养48 h,大肠杆菌于31 ℃培养48 h。
1.7 数据统计分析
使用Excel 2019整理数据,微生物数量由微生物计数后进行对数转换进行计数,使用SPSS 21.0的一般线性模型对原料和附生微生物进行双因素方差分析,其他数据采用单因素方差分析,并采用Duncan氏法进行多重比较。P<0.05为差异显著。
2 结果与分析
2.1 高温灭菌对青贮原料常规养分和微生物数量的影响
由表2可知,新鲜甘蔗尾叶的DM含量为33.23%,CP含量为5.09% DM,WSC含量为24.57% DM,缓冲容量为141.55 mE/kg DM,ADIN含量为2.16% DM,NDF、ADF含量分别为69.70% DM和35.14% DM,CF含量为33.18% DM,Ash含量为5.83% DM,乳酸菌、酵母菌、霉菌和大肠杆菌数量分别为7.75、6.75、4.05和6.89 lg(CFU/g FM)。高温灭菌显著降低了甘蔗尾叶的WSC含量(P<0.05),同时显著增加了ADIN含量(P<0.05),对其他常规养分含量无显著影响(P>0.05)。高温灭菌后未培养出微生物群落。

表2 高温灭菌对不同青贮原料常规养分和微生物数量的影响Table 2 Effects of high temperature sterilization on conventional nutrients and microorganisms number of different silage materials
象草的DM含量为21.15%,CP含量为7.14%DM,WSC含量为18.70%DM,缓冲容量为240.13 mE/kg DM,ADIN含量为3.07% DM,NDF、ADF含量分别为64.53% DM和37.45% DM,CF含量为36.84% DM,Ash含量为4.56% DM,乳酸菌、酵母菌、霉菌和大肠杆菌数量分别为6.54、6.47、5.00和5.44 lg(CFU/g FM),经高温灭菌后,ADIN含量显著增加(P<0.05),WSC含量显著减少(P<0.05),对其他常规养分含量无显著影响(P>0.05)。高温灭菌后未培养出微生物群落。
2.2 不同处理对青贮饲料常规养分的影响
由表3可知,青贮原料对青贮DM、NDF、ADF、CP和Ash含量有显著影响(P<0.05),附生微生物对青贮DM、CF、Ash含量有显著影响(P<0.05)。青贮原料与附生微生物的交互作用对青贮DM、NDF、CP、CF和Ash含量有显著影响(P<0.05)。

表3 不同处理对青贮饲料常规养分的影响Table 3 Effects of different treatments on conventional nutrients of silage %
在以灭菌象草为原料的青贮中,象草和甘蔗尾叶混合附生微生物发酵显著降低了DM和CP含量(P<0.05),同时也显著增加了NDF含量(P<0.05)。象草附生微生物发酵的青贮有着更低的NDF、ADF和CF含量,同时有更高的WSC含量(P<0.05),甘蔗尾叶附生微生物发酵的青贮WSC含量最低。
在以灭菌甘蔗尾叶为原料的青贮中,甘蔗尾叶附生微生物发酵的青贮CF含量显著高于象草附生微生物发酵的青贮和混合附生微生物发酵的青贮(P<0.05)。附生微生物对甘蔗尾叶为原料的青贮中其他常规养分含量无显著影响(P>0.05)。
2.3 不同处理对青贮发酵指标和微生物数量的影响
由表4可知,青贮原料对青贮的pH及乳酸、氨态氮、乙醇、乙酸、丙酸和丁酸含量均有显著影响(P<0.05)。附生微生物对青贮的pH及乳酸、氨态氮、乙醇、乙酸、丙酸、和丁酸含量均有显著影响(P<0.05)。青贮原料与附生微生物的交互作用对青贮的pH及乳酸、氨态氮、乙醇、乙酸、丙酸和丁酸含量也同样有显著影响(P<0.05)。

表4 不同处理对青贮发酵指标的影响Table 4 Effects of different treatments on fermentation parameters of silage
在以灭菌象草为原料的青贮中,象草和甘蔗尾叶混合附生微生物发酵显著增加了青贮的pH及乙醇、丙酸和丁酸含量(P<0.05),显著降低了青贮的乳酸含量(P<0.05)。甘蔗尾叶附生微生物和混合附生微生物发酵的青贮的乙酸含量显著高于象草附生微生物发酵的青贮(P<0.05)。
在以灭菌甘蔗尾叶为原料的青贮中,混合附生微生物发酵青贮的乳酸含量显著高于其他2个处理发酵P<0.05);氨态氮和丁酸含量低于其他2个处理发酵,但差异不显著(P>0.05)。象草附生微生物和混合附生微生物发酵青贮的乙醇含量显著高于甘蔗尾叶附生微生物发酵的青贮(P<0.05),乙酸含量显著低于甘蔗尾叶附生微生物发酵的青贮(P<0.05)。
象草附生微生物发酵时,灭菌甘蔗尾叶青贮的pH及乳酸和丁酸含量显著低于灭菌象草青贮(P<0.05);乙醇和乙酸含量显著高于灭菌象草青贮(P<0.05)。甘蔗尾叶附生微生物发酵时,灭菌甘蔗尾叶青贮的pH及乳酸和丁酸含量显著低于灭菌象草青贮(P<0.05),乙醇和乙酸含量显著高于灭菌象草青贮(P<0.05)。混合附生微生物青贮时,灭菌甘蔗尾叶青贮的pH及氨态氮、丙酸和丁酸含量显著低于灭菌象草青贮(P<0.05),乙醇和乙酸含量显著高于灭菌象草青贮(P<0.05)。
由表5可知,青贮原料对乳酸菌、酵母菌和霉菌数量有显著影响(P<0.05),附生微生物对青贮乳酸菌、酵母菌和霉菌数量有显著影响(P<0.05),青贮原料与附生微生物的交互作用对青贮乳酸菌、酵母菌和霉菌数量有显著影响(P<0.05)。

表5 不同处理对青贮微生物数量的影响Table 5 Effects of different treatments on microorganisms number of silage lg(CFU/g FM)
在以灭菌象草为原料的青贮中,象草和甘蔗尾叶混合附生微生物发酵显著减少了青贮开封时乳酸菌和霉菌数量(P<0.05),甘蔗尾叶附生微生物发酵后青贮的乳酸菌和酵母菌数量显著高于其他2个处理发酵(P<0.05)。
在以灭菌甘蔗尾叶为原料的青贮中,混合附生微生物发酵后的霉菌数量显著高于其他2个处理发酵(P<0.05);乳酸菌数量增加,但差异不显著(P>0.05)。象草附生微生物发酵后的酵母菌数量显著高于其他2个处理(P<0.05),霉菌数量显著低于其他2个处理(P<0.05)。
象草附生微生物发酵时,灭菌象草青贮的乳酸菌数量显著高于灭菌甘蔗尾叶青贮(P<0.05),酵母菌数量显著低于灭菌甘蔗尾叶青贮(P<0.05),霉菌数量差异不显著(P>0.05)。甘蔗尾叶附生微生物发酵时,灭菌象草青贮的乳酸菌和酵母菌数量显著高于灭菌甘蔗尾叶青贮(P<0.05),霉菌数量显著低于灭菌甘蔗尾叶青贮(P<0.05)。混合附生微生物发酵时,灭菌象草青贮的酵母菌数量显著高于灭菌甘蔗尾叶青贮(P<0.05),霉菌数量显著低于霉菌甘蔗尾叶青贮(P<0.05),乳酸菌数量差异不显著(P>0.05)。
各组合青贮开封时的大肠杆菌数量均小于可检数量[2.00 lg(CFU/g FM)]。
2.4 有氧暴露过程不同处理对青贮pH的影响
有氧暴露期间,各处理青贮的pH变化如图1所示。在有氧暴露4 d内,各处理pH均较稳定。E×MS和E×MES处理青贮在有氧暴露第12天时,pH与青贮刚结束时的变化量超过0.5,其他处理青贮均在第6天时pH变化量超0.5,即有氧不稳定[25],有氧不稳定时,pH增加迅速。
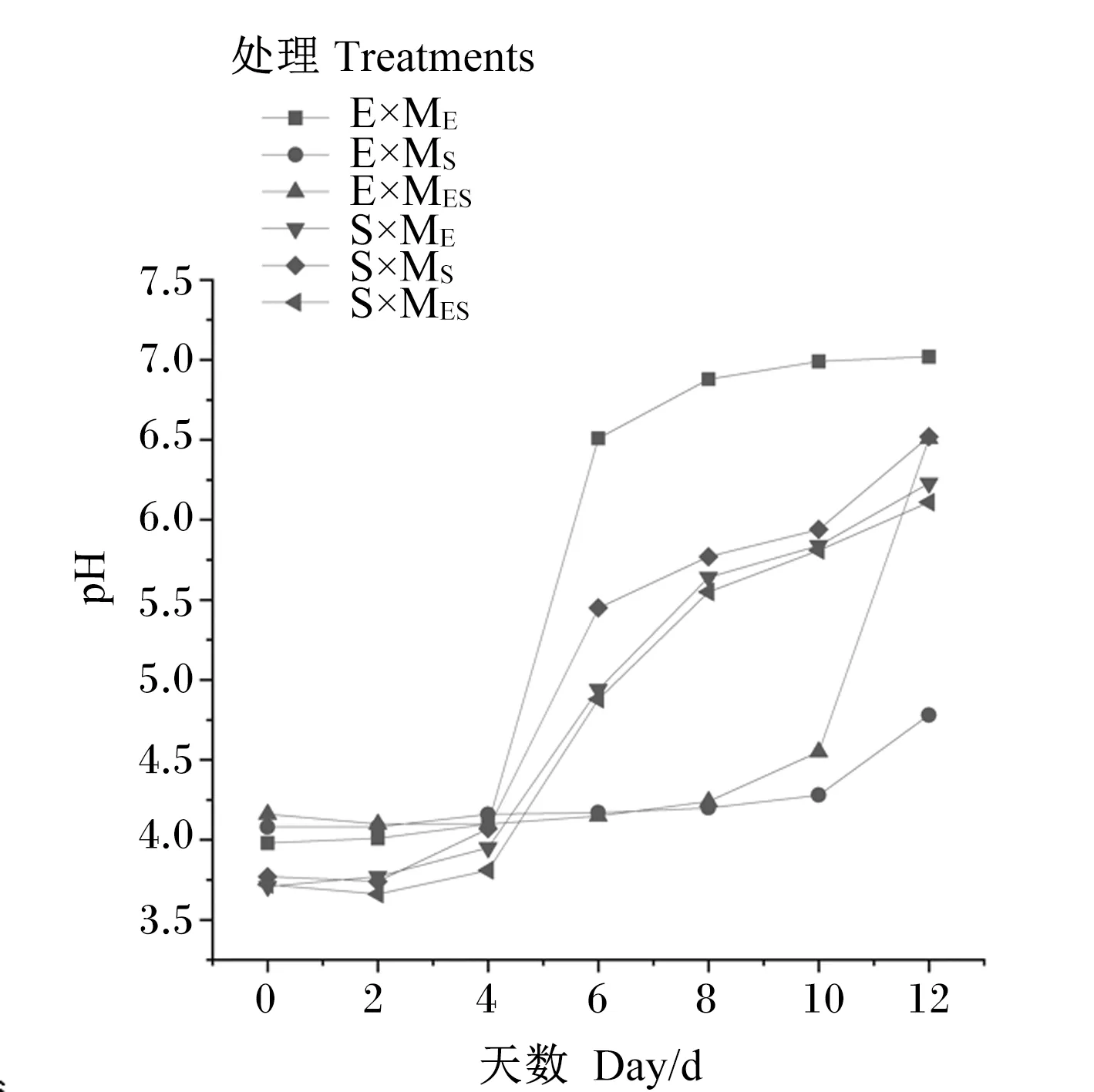
E表示灭菌象草原料,S表示灭菌甘蔗尾叶原料。ME表示象草附生微生物,MS表示甘蔗尾叶附生微生物,MES表示象草和甘蔗尾叶混合附生微生物(1∶1)。E stands for sterilized elephant grass material, S stands for sterilized Sugarcane tops material. ME represents epiphytes of elephant grass, MS represents epiphytes of Sugarcane tops, MES represents mixed epiphytes of elephant grass and Sugarcane tops (1∶1).图1 有氧暴露期间青贮的pHFig.1 pH of silage during aerobic exposure
2.5 不同处理对有氧不稳定时青贮发酵指标和微生物数量的影响
由表6可知,有氧不稳定时,青贮原料对青贮的pH及乳酸、氨态氮、乙醇、乙酸、丙酸和丁酸含量均有显著影响(P<0.05)。附生微生物对青贮的pH及乳酸、氨态氮、乙醇、乙酸、丙酸和丁酸含量均有显著影响(P<0.05)。青贮原料与附生微生物的交互作用对青贮的pH及乳酸、氨态氮、乙醇、乙酸、丙酸和丁酸含量也同样有显著影响(P<0.05)。
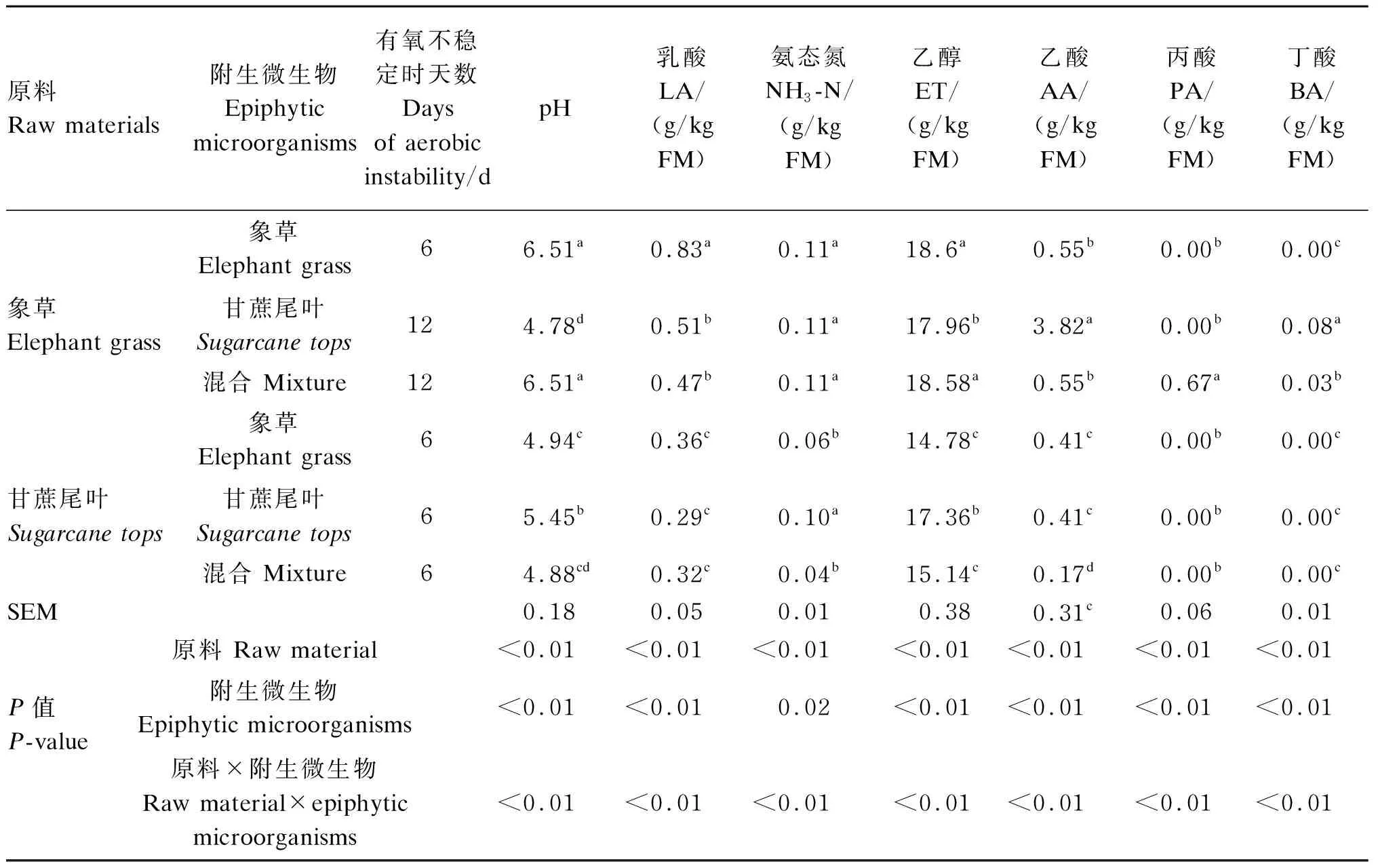
表6 不同处理对有氧不稳定时青贮发酵指标的影响Table 6 Effects of different treatments on fermentation parameters of silage under aerobic instability
在以灭菌象草为原料的青贮中,甘蔗尾叶附生微生物和混合附生微生物发酵延长了有氧暴露稳定时间,同时也显著降低了乳酸含量(P<0.05)。在有氧不稳定时,甘蔗尾叶附生微生物发酵的青贮乙酸和丁酸含量显著高于其他2个处理(P<0.05),乙醇含量显著低于其他2个处理(P<0.05);混合附生微生物发酵的青贮丙酸含量显著高于其他2个处理(P<0.05)。
在以灭菌甘蔗尾叶为原料的青贮中,有氧不稳定时,甘蔗尾叶附生微生物发酵的乳酸含量最低,但差异不显著(P>0.05),氨态氮和乙醇含量显著高于其他2个处理(P<0.05),混合附生微生物发酵的乙酸含量显著低于其他2个处理(P<0.05)。
象草附生微生物发酵的青贮,在有氧不稳定时,灭菌象草青贮的乳酸、氨态氮、乙醇、乙酸含量显著高于灭菌甘蔗尾叶青贮(P<0.05)。甘蔗尾叶附生微生物发酵的青贮,在有氧不稳定时,灭菌象草青贮的乳酸、乙酸和丁酸含量显著高于灭菌甘蔗尾叶青贮(P<0.05),灭菌象草青贮的氨态氮和乙醇含量高于灭菌甘蔗尾叶青贮,但差异不显著(P>0.05)。混合附生微生物发酵的青贮,在有氧不稳定时,灭菌象草青贮的乳酸、氨态氮、乙醇、乙酸、丙酸和丁酸含量显著高于灭菌甘蔗尾叶青贮(P<0.05)。
由表7可知,青贮原料对乳酸菌、酵母菌、霉菌和肠杆菌数量有显著影响(P<0.05),附生微生物对青贮乳酸菌、酵母菌和霉菌数量有显著影响(P<0.05),青贮原料与附生微生物的交互作用对青贮酵母菌和霉菌数量有显著影响(P<0.05)。

表7 不同处理对有氧不稳定时青贮微生物数量的影响Table 7 Effects of different treatments on microorganisms number of silage under aerobic instability lg(CFU/g FM)
在以灭菌象草为原料的青贮中,有氧不稳定时,象草附生微生物发酵处理乳酸菌数量最少,显著低于其他2个处理(P<0.05),霉菌数量最多,显著高于其他2个处理(P<0.05)。混合附生微生物发酵处理酵母菌数量最多,显著高于其他2个处理(P<0.05)。各处理间大肠杆菌数量无显著差异(P>0.05)。
在以灭菌甘蔗尾叶为原料的青贮中,有氧不稳定时,象草附生微生物发酵处理霉菌数量显著高于其他2个处理(P<0.05),混合附生微生物发酵处理的乳酸菌数量最多,酵母菌数量最少。各处理间大肠杆菌数量无显著差异(P>0.05)。
象草附生微生物发酵的青贮,在有氧不稳定时,灭菌甘蔗尾叶青贮的酵母菌和霉菌数量显著多于灭菌象草青贮(P<0.05)。甘蔗尾叶附生微生物发酵的青贮,在有氧不稳定时,灭菌甘蔗尾叶青贮的乳酸菌数量显著低于灭菌象草青贮(P<0.05),酵母菌、霉菌和大肠杆菌数量显著多于灭菌象草青贮(P<0.05)。混合附生微生物发酵的青贮,在有氧不稳定时,灭菌象草青贮的霉菌和大肠杆菌数量显著低于其他2个处理(P<0.05),酵母菌数量显著多于其他2个处理(P<0.05)。
3 讨 论
3.1 高温灭菌对青贮原料的影响
高温灭菌对青贮原料有一定影响,主要表现在甘蔗尾叶和象草的的WSC和ADIN含量上,对其余常规养分含量无显著影响。Mogodiniyai等[13]在探索廉价灭菌方法时,也同样发现高温灭菌情况下,牧草的WSC含量有显著降低,同时ADIN含量显著增加。且高温灭菌后,原料上未检测到微生物,说明高温灭菌是个可行的灭菌方法。且高温灭菌对青贮原料的缓冲容量无显著影响,这说明了高温灭菌后的原料在发酵特性上,与未灭菌原料相似[26]。由于参照Mogodiniyai等[17]的方法不能完全收集植物的附生微生物,收集的数量约为实际的90%,为保证相似的初始菌群数量,和相似的WSC底物含量,故适当增加了重构青贮的DM含量至40%。
3.2 不同原料和附生微生物组合对青贮常规养分的影响
DM含量的降低是青贮过程中常见的现象,主要由异型发酵乳酸菌、酵母菌、梭菌等微生物在发酵过程中将底物转变为气体、水等成分所引起的,造成青贮DM损失。本试验中,灭菌甘蔗尾叶为原料时,象草附生微生物的添加显著增加了青贮的DM含量,说明象草附生微生物可以减少甘蔗尾叶青贮的DM损失。不同附生微生物也同样对灭菌象草青贮的DM含量有显著影响,甘蔗尾叶附生微生物增加了灭菌象草青贮的DM含量,但混合附生微生物降低了灭菌象草青贮的DM含量。许多研究发现,甘蔗尾叶青贮有更高的DM损失,这可能与甘蔗尾叶附生微生物中较多的酿酒酵母有关[14]。接种附生微生物的不同还显著影响了青贮的CF含量,这可能与附生微生物对CF的降解作用有关。青贮前灭菌象草的CF含量更高,而青贮开封时,原料来源对青贮的CF含量无显著影响,说明微生物接种于象草上,有更强的CF降解能力,青贮原料的不同,会显著影响到微生物对CF的降解作用。乳酸菌在青贮发酵过程中,会产生纤维素酶[27],从而减少纤维素的含量。这说明乳酸菌在象草青贮上更易繁殖,本试验同样发现灭菌象草青贮后的乳酸含量较灭菌甘蔗尾叶青贮高。青贮的NDF、ADF和CP含量主要与青贮原料有关。尽管不同附生微生物处理对各组合青贮的NDF、ADF含量无显著差异,但灭菌甘蔗尾叶青贮的NDF、ADF含量较青贮前降低幅度更大。许留兴等[28]研究发现,添加蔗糖的青贮会有更低的NDF含量。
本试验中混合附生微生物接种于灭菌象草的青贮组合,相较于其他2个灭菌象草青贮组合,有着最高的NDF、ADF含量,同时有最低的CP含量,说明该组合的蛋白质损失更大。而混合附生微生物发酵的灭菌甘蔗尾叶青贮的NDF含量相较于其他2个组合的甘蔗尾叶青贮更低,CP含量更高,说明该组合青贮品质更优。在以灭菌象草为原料时,用象草附生微生物发酵有更低的NDF、ADF和CF含量,而在以灭菌甘蔗尾叶为原料时,用甘蔗尾叶附生微生物发酵有更低的ADF含量。这说明了来源于原料本身的附生微生物对该原料ADF的降解更有效。接种象草附生微生物和混合附生微生物的甘蔗尾叶青贮,相较于接种自身附生微生物的甘蔗尾叶青贮有更高的DM、ADF和CP含量,更低的CF含量。这说明象草附生微生物可以减少青贮蛋白质损失,有效降解原料的CF,且添加了象草附生微生物的甘蔗尾叶青贮有更低的DM损失。同型乳酸菌可以降低青贮的DM损失[29],推测象草的附生微生物中可能有较多的同型乳酸菌。
3.3 不同原料和附生微生物组合对青贮发酵指标和微生物数量的影响
青贮的原料和接种的附生微生物对青贮发酵指标和微生物数量均有显著影响,原料不同时,相同的附生微生物接种对发酵指标和微生物数量也有不同的影响[30]。
青贮开封时的灭菌象草有更高的pH和丁酸含量,更低的乙醇和乙酸含量,这可能是由于灭菌甘蔗尾叶原料有更高的WSC含量,更易使乳酸菌发酵,使得青贮pH更低[31-32]。同时,pH的下降使得生成丁酸的腐败菌受到抑制,使灭菌甘蔗尾叶青贮的丁酸含量降低[33]。许多研究发现,甘蔗尾叶青贮有较高的乙醇含量[14,34-35],也有研究发现,青贮原料中较高的WSC含量,会促进酵母菌和霉菌的发酵,使青贮中乙醇含量升高[36]。黄峰[26]也同样研究发现,不同处理的灭菌甘蔗尾叶青贮中的乙酸含量较高。灭菌象草青贮有更多的乳酸菌数量,这可能是灭菌象草青贮的pH更高造成的[33]。灭菌甘蔗尾叶青贮有更多的霉菌数量,这可能与原料中较高的WSC含量有关[14]。
本试验发现,接种象草附生微生物的青贮有着更低的pH和乙酸含量。而接种甘蔗尾叶附生微生物的青贮,相较于其他处理,乙醇含量更低。乙酸的生成通常与异型发酵乳酸菌或大肠杆菌的活动有关[37],甘蔗尾叶附生微生物中,大肠杆菌的数量多于象草附生微生物可能解释了这个原因,也有可能是甘蔗尾叶附生微生物中有更多的异型发酵乳酸菌的数量。乙醇的产生主要与酵母菌和霉菌的发酵有关,象草附生微生物的霉菌数量更多。
混合附生微生物的发酵使灭菌象草青贮的乳酸含量更低,氨态氮和丁酸含量更高,而同样混合附生微生物发酵的灭菌甘蔗尾叶却恰恰相反,该组合青贮乳酸含量高于接种其他2种附生微生物的组合,氨态氮和丁酸含量也更低。这可能是由于灭菌象草原料的WSC含量相对较低,使得多种微生物在发酵初期竞争激烈[32],限制了青贮的进程。Dong等[38]将苜蓿附生微生物接种于未灭菌的象草,同样发现该组青贮品质低于单一附生微生物的青贮。而灭菌甘蔗尾叶仍有较高的WSC含量,足够微生物的发酵活动,且青贮初始微生物多样性较高时,青贮品质倾向于更佳[39]。
3.4 不同原料和附生微生物组合对有氧不稳定时发酵指标和微生物数量的影响
青贮的微生物在有氧暴露条件下激活后,表现出与青贮状态不一样的规律。而微生物组成的变化,尤其是乳酸菌和霉菌的大量繁殖,会造成青贮的营养损失和发酵指标的改变。Ashbell等[25]认为,青贮pH的增加小于0.5时,青贮被认为是稳定的。本试验中,E×MS和E×MES处理青贮在有氧暴露第12天时pH的增加量相较于初始状态大于0.5,其余处理青贮在有氧暴露第6天时,pH的变化量大于0.5。这说明了甘蔗尾叶附生微生物可延长象草青贮的有氧稳定时间。一般乙酸的含量与青贮的有氧稳定性相关,表现为乙酸含量越高,有氧稳定性越强[40-41],灭菌甘蔗尾叶青贮有较高的乙酸含量,但均在第6天时有氧不稳定,这是由于高糖的青贮有氧稳定性更差[42]。
有氧暴露不稳定时,各处理青贮乳酸、乙醇、丙酸和丁酸含量均明显下降,除E×MS处理乙酸含量有所上升外,其余各处理乙酸含量均下降,且有氧不稳定时,各处理的乳酸菌、酵母菌、霉菌和大肠杆菌数量均有明显增加,与前人研究结果[26]一致。
4 结 论
① 甘蔗尾叶附生微生物会增加灭菌甘蔗尾叶和象草青贮的乙酸含量;象草附生微生物会增加灭菌甘蔗尾叶和象草青贮的乙醇含量,且降解纤维的能力更强。
② 灭菌甘蔗尾叶青贮相较于灭菌象草青贮的pH更低,乙醇、乙酸含量更高。
③ 甘蔗尾叶附生微生物以及甘蔗尾叶和象草混合附生微生物会提高象草青贮的有氧稳定性,甘蔗尾叶和象草混合附生微生物的发酵会提高甘蔗尾叶青贮的品质。
