牛油果油对肥胖小鼠体重、血清生化指标和肝脏中胆固醇代谢相关基因表达的影响
2023-12-04李亚婷陈鹏浩司雄元檀华蓉汪雪雁
李亚婷 李 强 李 娜 陈鹏浩 司雄元 檀华蓉 汪雪雁*
(1.安徽农业大学茶与食品科技学院,合肥 230036;2.安徽农业大学生物技术中心,合肥 230036)
牛油果(PerseaamericanaMill.)是一种热带水果,也称为油梨、鳄梨、酪梨,属樟科鳄梨属。牛油果含有大量油脂,果肉含油量约为60%,果皮约为7%,种子约为2%[1]。牛油果油营养成分丰富,含有多种不饱和脂肪酸,少量植物甾醇、生育酚等有益活性物质,其中油酸含量最高[2-3]。高油酸被证明能调节血脂、降血糖、促进伤口愈合、保护心脏,有益于癌症、自身免疫病和炎症性疾病的改善[4-5]。牛油果具有高能低糖的特性,能够降低血液中脂质和胆固醇含量,保护肝脏免受损伤,对由肥胖引起的代谢类疾病与心血管疾病可能有改善效果[1,6-9]。
肥胖症被世界卫生组织(WHO)定义为全球流行的代谢性疾病,常引起机体胆固醇代谢紊乱。目前,他汀类等合成药物是降低胆固醇的重要药物治疗手段,但长期使用这类药物可能会带来肝功能、肾功能损伤等副作用,因此,使用天然产物替代化学合成药物来改善机体胆固醇代谢紊乱对人体健康更有益。牛油果富含单不饱和脂肪酸,有助于膳食脂肪的消耗,但目前对牛油果的研究多集中于提取工艺、贮藏方法、理化性质、组成和药理作用等,对其作用机制研究较少。本研究通过评估牛油果油对由高脂饲粮诱导的肥胖小鼠生长性能、血脂代谢、肝脏和脂肪组织的影响,探究牛油果油调控胆固醇代谢的机制,为牛油果在食品、医药等方面的开发与利用提供科学依据。
1 材料与方法
1.1 试验材料与试剂
牛油果油,实验室自制,于0~4 ℃贮藏;辛伐他汀片,杭州默沙东制药有限公司;60%高脂饲粮(60%的热量由脂肪提供,碳水化合物和蛋白质供能比分别为20.6%和19.4%)、低脂对照饲粮(10%的热量由脂肪提供,碳水化合物和蛋白质供能比分别为75.9%和14.1%),江苏南通特洛菲科技有限公司。
RNA later样本保存液,美国Sigma-Aldrich公司;甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)试剂盒,南京建成生物工程研究所;RNAiso Plus、PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(Perfect Real Time)、TB Green®Premix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒,TaKaRa生物工程有限公司。
1.2 试验设备与仪器
DF-101SZ集热式磁力加热搅拌器(上海凌科实业发展有限公司)、Beckman-Allegra高速冷冻离心机(美国Beckman科技公司)、GCMS-QP2010气相色谱质谱联用仪(日本岛津公司)、全波段酶标仪(美国Molecular Devices公司)、实时荧光定量PCR仪(美国Thermo Fisher公司)。
1.3 试验动物
C57BL/6J雄性小鼠,无特定病原体(SPF)级,5周龄,浙江维通利华实验动物技术有限公司[许可证号:SCX(浙)2019-0011];小鼠饲养于安徽农业大学SPF动物实验中心,饲养环境温度(23±2) ℃,相对湿度(50±10)%,昼夜节律12 h明暗循环,小鼠自由饮食和饮水。试验动物的饲养经过安徽农业大学实验动物伦理委员会批准,动物伦理编号为AHAU2021013。
1.4 牛油果油的提取与脂肪酸组成的测定
本试验参考崔晓冰[10]和刘义军等[11]的方法,采取水代法提取牛油果油。按照1∶2的料液比,将新鲜牛油果果肉置于适量蒸馏水中粉碎打浆,在水浴温度为50 ℃下中低速搅拌2 h;取出已搅拌好的牛油果浆,在10 000 r/min下离心10 min,取出最上层的油脂与乳化层,放于-20 ℃冰箱冷冻过夜破乳,以10 000 r/min离心10 min,取上清液,置于4 ℃冰箱保存。
采用气相色谱质谱联用仪对水代法提取的牛油果油中的脂肪酸成分进行定性和定量分析。色谱条件:色谱柱为DB-5石英毛细管柱(60 m×0.25 mm,0.25 μm);升温程序为150 ℃保持1 min,以15 ℃/min升至250 ℃,保持10 min;载气为氦气(99.999%),流速1.0 mL/min,压力1 kPa,进样量10 μL;分流比=100∶1。质谱条件:电子轰击电离源(EI源)电压为70 eV,离子源温度为230 ℃,接口温度为250 ℃,四极杆温度为150 ℃,质量扫描范围质荷比(m/z)为30~500。
1.5 C57BL/6J小鼠肥胖模型构建
通过饲喂C57BL/6J小鼠高脂饲粮构建肥胖模型。76只5周龄SPF级雄性C57BL/6J小鼠在屏障系统下适应性喂养1周后,随机取24只小鼠为低脂组(LFD组),给予低脂对照饲粮饲养;剩下的52只小鼠为高脂组(HFD组),给予60%高脂饲粮饲养。所有小鼠自由采食和饮水,每隔2 d监测1次摄食量和饮水量,每周称量1次体重。在8周后,通过体重指标即高脂组体重超过低脂组体重20%为标准筛选出达标的小鼠,同时检测血清生化指标与肝脏和脂肪病理切片,最后选取出40只肥胖小鼠进行干预试验。
1.6 小鼠分组与牛油果油干预
将16只采用低脂对照饲粮饲养的小鼠分为对照组(LF组)和牛油果油组(LFA组),均给予低脂对照饲粮喂养。将选出的40只由60%高脂饲粮喂养的肥胖小鼠分为5组,分别为高脂对照组(HF组)、辛伐他汀组(HS组)、牛油果油低剂量组(AO-L组)、牛油果油中剂量组(AO-M组)和牛油果油高剂量组(AO-H组),每组8只小鼠。每2 d测量1次摄食量与饮水量,每周称量1次体重,小鼠自由饮水与摄食。所有组均以灌胃方式给药,每天在同一时间段灌胃1次,共干预4周。根据前期预试验结果,LFA组以650 mg/(kg·d)的剂量灌胃牛油果油;AO-L、AO-M和AO-H组给予的牛油果油剂量分别为325(低剂量)、650(中剂量)和975 mg/(kg·d)(高剂量);HS组给予的辛伐他汀剂量为3 mg/(kg·d),辛伐他汀片用蒸馏水制成悬浊液进行灌胃;LF和HF组灌胃0.2 mL的蒸馏水。
1.7 小鼠血清和组织的采集
灌胃结束后,所有小鼠禁食12 h,用4%水合氯醛溶液进行麻醉;摘眼球取血,室温放置后离心得到血清;然后颈椎脱臼处死,解剖,取肝脏、肾脏和附睾脂肪,称重,计算肝脏系数和附睾脂肪系数;取部分肝脏于4%多聚甲醛溶液中固定,室温放置,部分放于RNA later样本保存液中,缓冻,最后储存于-80 ℃;取附睾脂肪组织于脂肪固定液中固定,室温放置。
1.8 血清生化指标分析
采用试剂盒测定血清中的4项血脂指标(TC、TG、HDL-C、LDL-C含量)和2项肝功能指标(ALT和AST活性)。
1.9 组织病理学分析
将固定在4%多聚甲醛溶液中的肝脏和固定在脂肪固定液中的附睾脂肪组织取出,进行脱水、石蜡包埋、切片和苏木精-伊红(HE)染色,最后镜检,观察并拍摄病理切片。
1.10 实时荧光定量PCR测定肝脏胆固醇代谢相关基因的表达
采用Trizol法提取肝脏总RNA,然后使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒去除基因组DNA并通过反转录得到cDNA,最后用TB Green®Premix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒进行实时荧光定量PCR,引物序列如表1所示。采用2-ΔΔCt的计算方法,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,计算目标基因的mRNA相对表达量。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences for qRT-PCR
1.11 数据处理与分析
采用SPSS 21.0软件对数据进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较检验,P<0.05表示具有统计学差异;绘图采用GraphPad Prism 8.0软件。结果以平均值±标准误表示。
2 结果与分析
2.1 牛油果油的脂肪酸组成
用气相色谱-质谱联用(GC-MS)法测定水代法提取的牛油果油的脂肪酸组成,其色谱图见图1。通过NIST11.L质谱库进行检索,并用归一化法计算检测出的化合物的相对百分含量,结果见表2。
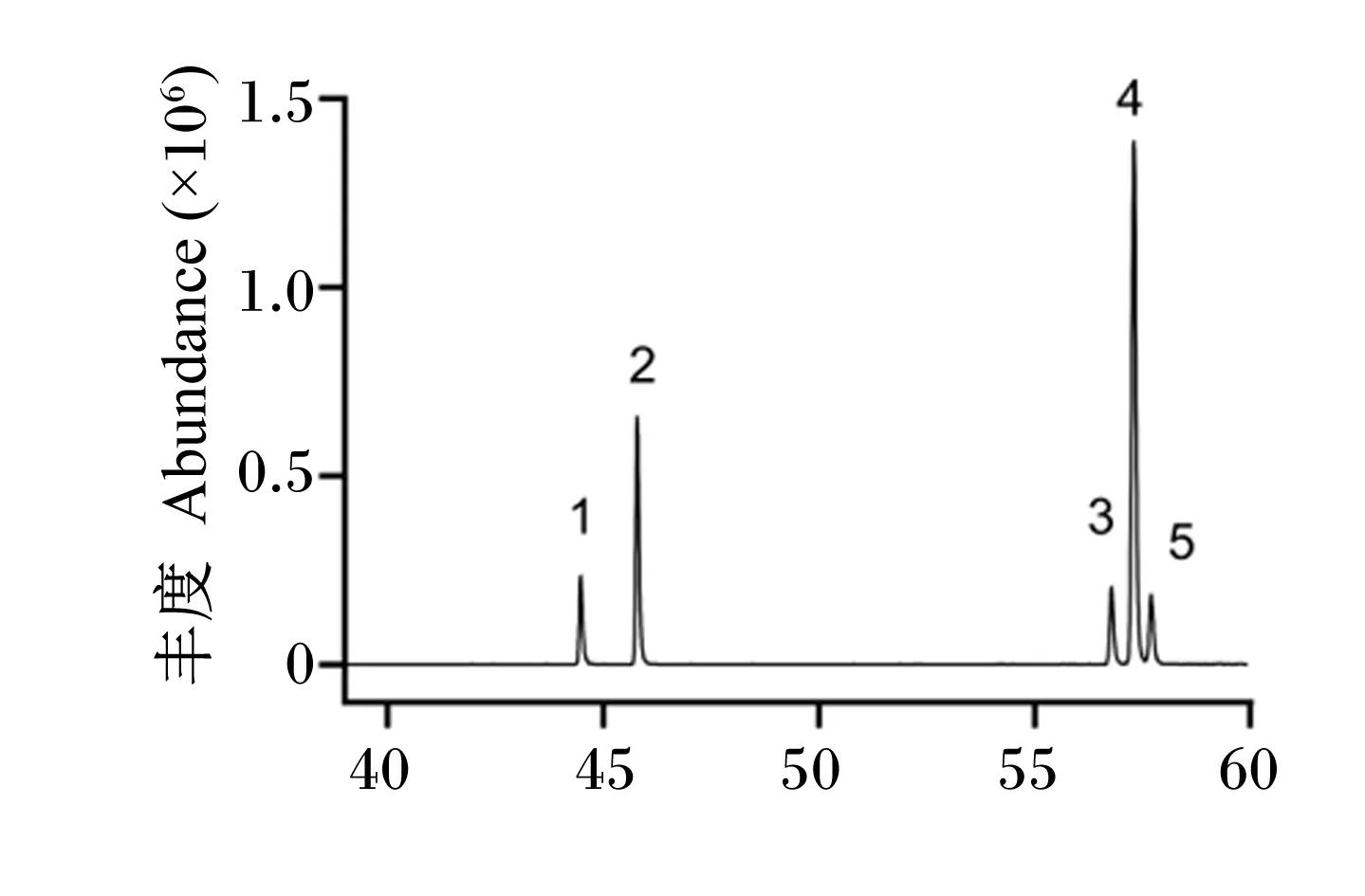
1:棕榈油酸 palmitoleic acid;2:棕榈酸 palmitic acid;3:亚油酸 linoleic acid;4:油酸 oleic acid;5:13-十八碳烯酸 13-octadecenoic acid。图1 牛油果油的脂肪酸GC-MS图谱Fig.1 GC-MS spectrum of fatty acids in avocado oil

表2 牛油果油脂肪酸的主要成分及相对百分含量Table 2 Main components and relative percentage contents of fatty acids in avocado oil
牛油果油共含有5种脂肪酸(表2),其中不饱和脂肪酸的相对百分含量为77.64%,包括棕榈油酸、亚油酸、油酸等,饱和脂肪酸的相对百分含量为22.36%。在牛油果油所含脂肪酸中,以油酸的相对百分含量最高,高达55.56%。
2.2 肥胖模型指标
2.2.1 高脂饲粮对小鼠体重和血脂指标的影响
本试验用60%高脂饲粮进行小鼠肥胖模型的构建,造模期间,所有小鼠均正常摄食和饮水,精神状态较好,无病态以及死亡现象。由表3可知,HFD组与LFD组小鼠的始重无统计学差异(P>0.05),但在饲喂8周后,HFD组小鼠体重较LFD组小鼠增加了25.43%(P<0.001),这表明小鼠肥胖模型造模成功;相较于LFD组,HFD组血清TC和LDL-C含量分别提高了2.55和3.49倍(P<0.01),TG和HDL-C含量均无统计学差异(P>0.05)。

表3 高脂饲粮对小鼠体重和血脂指标的影响Table 3 Effects of high-fat diet on body weight and blood lipid indexes of mice
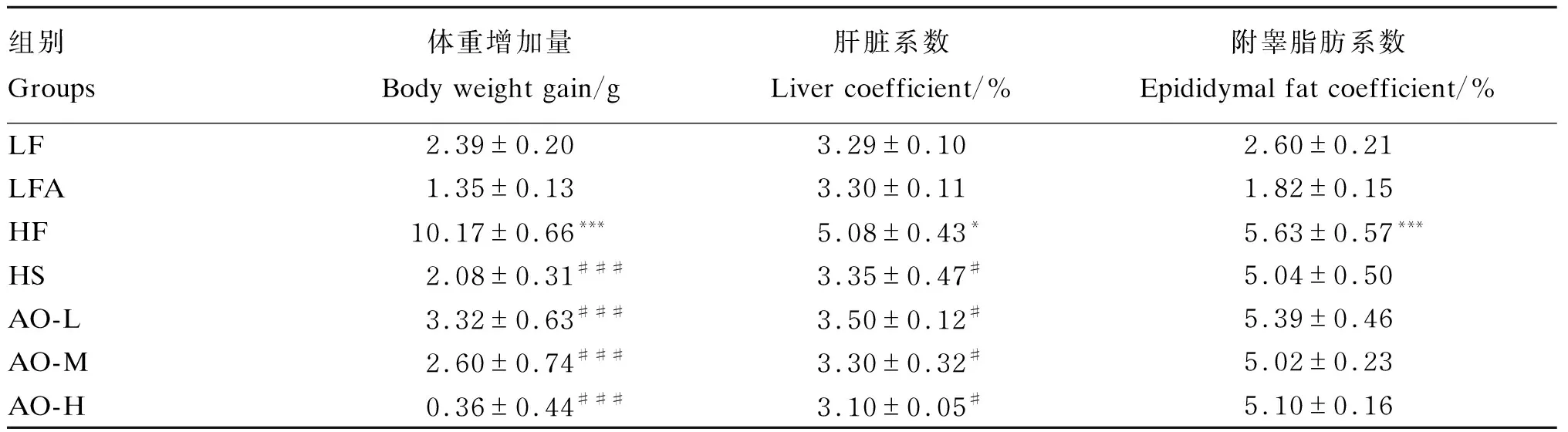
表4 牛油果油对肥胖小鼠体重增加量、肝脏系数和附睾脂肪系数的影响Table 4 Effects of avocado oil on body weight gain, liver coefficient and epididymal fat coefficient of obese mice
2.2.2 高脂饲粮对小鼠肝脏和脂肪组织形态的影响
进一步采用HE染色法检查了高脂饲粮对小鼠肝脏和脂肪组织形态的影响(图2和图3),结果显示,LFD组小鼠肝细胞形态正常,无明显细胞质空泡、肿胀和炎症反应;HFD组小鼠可见明显的肝细胞变性现象,部分细胞内脂肪聚集严重且有较大脂滴形成;HFD组小鼠的脂肪组织细胞体积相较于LFD组变大,且排列较松散。

LFD:LFD组;HFD:HFD组。图片均为原始图片×200倍,比例尺为50 μm。下图同。LFD: LFD group; HFD: HFD group. The pictures are 200 times larger than the original pictures, and the scale is 50 μm. The same as below.图2 高脂饲粮对小鼠肝脏病理学变化的影响Fig.2 Effects of high-fat diet on liver pathological changes of mice
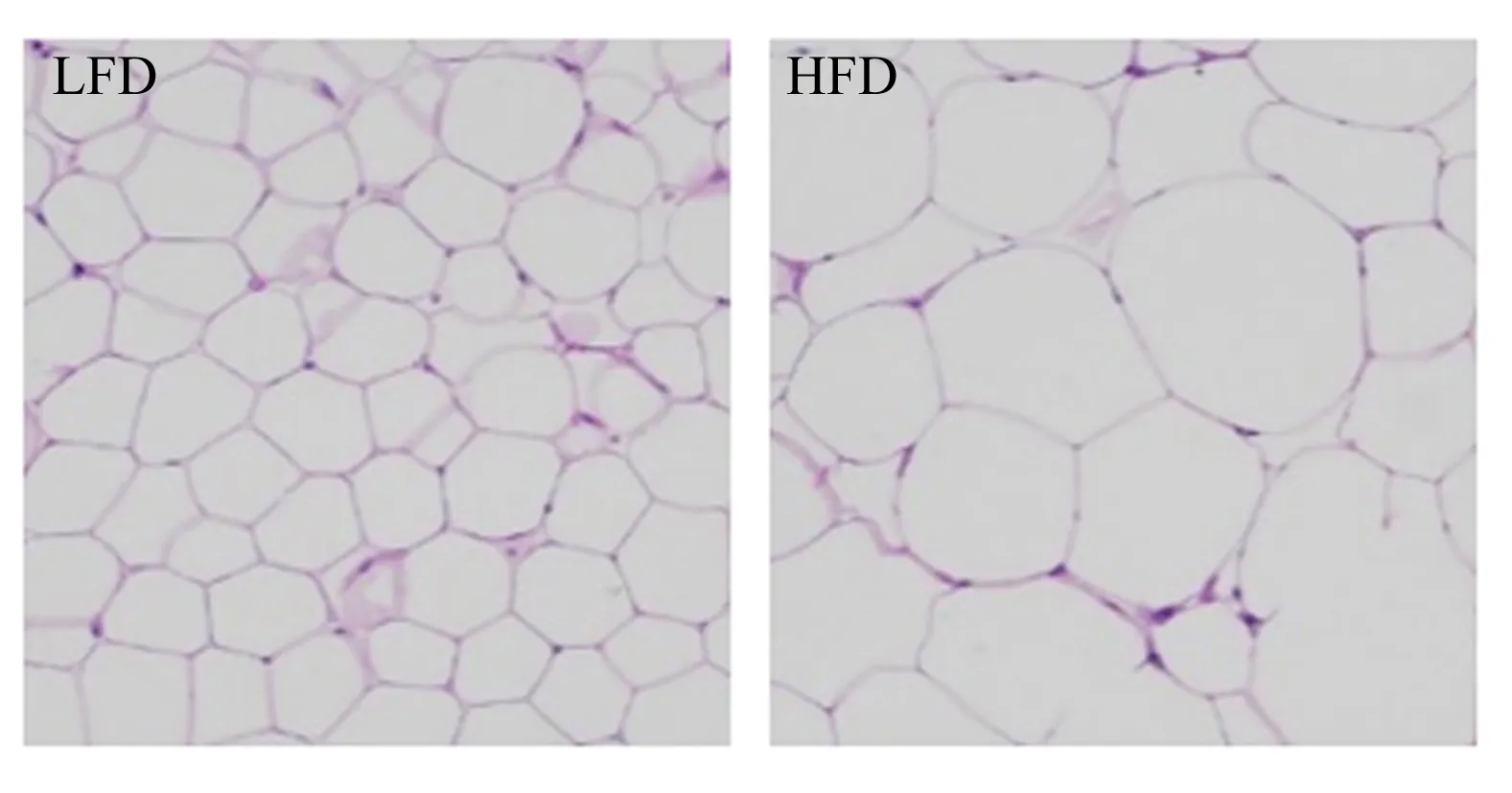
图3 高脂饲粮对小鼠脂肪组织形态的影响Fig.3 Effects of high-fat diet on fat morphology of mice
2.3 牛油果油对肥胖小鼠体重增加量、肝脏系数和附睾脂肪系数的影响
在使用不同剂量牛油果油干预4周后,LFA组小鼠体重增加量相较于LF组无显著差异(P>0.05);HF组小鼠体重增加量是LF组的4.26倍(P<0.001)。与HF组相比,HS、AO-L、AO-M和AO-H组体重增加量(P<0.001)和肝脏系数(P<0.05)均显著降低,但附睾脂肪系数无统计学差异(P>0.05)。由上述结果可知,牛油果油能显著降低由高脂饲粮引起的小鼠体重和肝脏系数的增加。
2.4 牛油果油对肥胖小鼠血清生化指标的影响
由表5可知,在血清TC、TG、LDL-C、HDL-C含量与ALT、AST活性上,LF组与LFA组均无统计学差异(P>0.05)。HF组血清TC、LDL-C含量与ALT、AST活性相较于LF组显著增加(P<0.001)。与HF组相比,HS、AO-M和AO-H组血清TC、LDL-C含量和AST活性均显著降低(P<0.01);HS、AO-L、AO-M和AO-H组血清ALT活性显著降低(P<0.001);HS、AO-L、AO-M和AO-H组血清TG含量均有所下降,但无统计学差异(P>0.05);AO-L、AO-M和AO-H组血清HDL-C含量均显著增加(P<0.05)。以上结果表明,牛油果油能够有效抑制肥胖小鼠血清TC、TG、LDL-C含量与ALT、AST活性的增加,促进血清HDL-C含量的增加,从而有效降低肥胖小鼠的血脂水平,改善肥胖小鼠血脂代谢紊乱和肝功能损伤。

表5 牛油果油对肥胖小鼠血清生化指标的影响Table 5 Effects of avocado oil on serum biochemical indexes of obese mice
2.5 牛油果油对肥胖小鼠肝脏和脂肪组织形态的影响
长期摄入高脂饲粮对肝脏会产生较大的影响,肝脏积蓄大量脂肪甚至引起脂肪肝[12]。从小鼠肝脏组织病理学检查的结果(图4)可以看出,LF和LFA组小鼠肝组织细胞形态正常,排列整齐;HF组小鼠可见明显的肝细胞变性现象,脂滴浸润严重。与HF组相比,HS、AO-L、AO-M和AO-H组肝脏病变均有减轻,脂滴空泡数量减少。

LF:LF组 LF group;LFA:LFA组 LFA group;HF:HF组 HF group;HS:HS组 HS group;AO-L:AO-L组 AO-L group;AO-M;AO-M组 AO-M group;AO-H:AO-H组 AO-H group。下图同 the same as below。图4 牛油果油对肥胖小鼠肝脏病理学变化的影响Fig.4 Effects of avocado oil on liver pathological changes of obese mice
附睾脂肪组织HE染色结果(图5)显示,LF组小鼠的脂肪细胞较小,排列紧凑;HF组小鼠的脂肪组织细胞的轮廓大于LF组,且排列较松散;与HF组相比,HS、AO-L、AO-M和AO-H组小鼠的脂肪细胞体积均有所变小,且细胞排列变紧密。
2.6 牛油果油对肥胖小鼠肝脏胆固醇合成的影响
如图6所示,相比于LF组,LFA组肝脏中固醇调控元件结合蛋白2(SREBP2)的mRNA相对表达量显著上调(P<0.05);与HF组相比,HS、AO-M和AO-H组肝脏中肝X受体(LXR)、腺苷酸活化蛋白激酶α(AMPKα)的mRNA相对表达量显著上调(P<0.05),AO-M和AO-H组肝脏中SREBP2的mRNA相对表达量显著下调(P<0.05),HS组肝脏中SREBP2和3-羟基3-甲基戊二酰辅酶A还原酶(HMGCR)的mRNA相对表达量显著上调(P<0.05)。

数据柱形标注不同小写字母表示差异显著(P<0.05)。下图同。Value columns with different small letters mean significant difference (P<0.05). The same as below.图6 牛油果油对肥胖小鼠肝脏中胆固醇合成相关基因表达的影响Fig.6 Effects of avocado oil on expression of genes involved in cholesterol synthesis in liver of obese mice
2.7 牛油果油对肥胖小鼠肝脏胆固醇逆转运(RCT)的影响
胆固醇的逆转运是指外周组织细胞中胆固醇以HDL-C为载体转运到肝脏组织中,进入机体的循环,并且以胆汁酸形式排泄出体外的过程[13]。
2.7.1 牛油果油对肥胖小鼠肝脏胆固醇转运相关基因表达的影响
如图7所示,LFA组肝脏中清道夫受体-BI(SR-BI)的mRNA相对表达量显著低于LF组(P<0.05);与HF组相比,牛油果油与辛伐他汀的干预对肥胖小鼠肝脏中SR-BI、低密度脂蛋白受体(LDLR)的mRNA相对表达量无显著影响(P>0.05),辛伐他汀以及低、中剂量的牛油果油干预均显著下调了肥胖小鼠肝脏中ATP结合盒转运体G1(ABCG1)的mRNA相对表达量(P<0.05)。
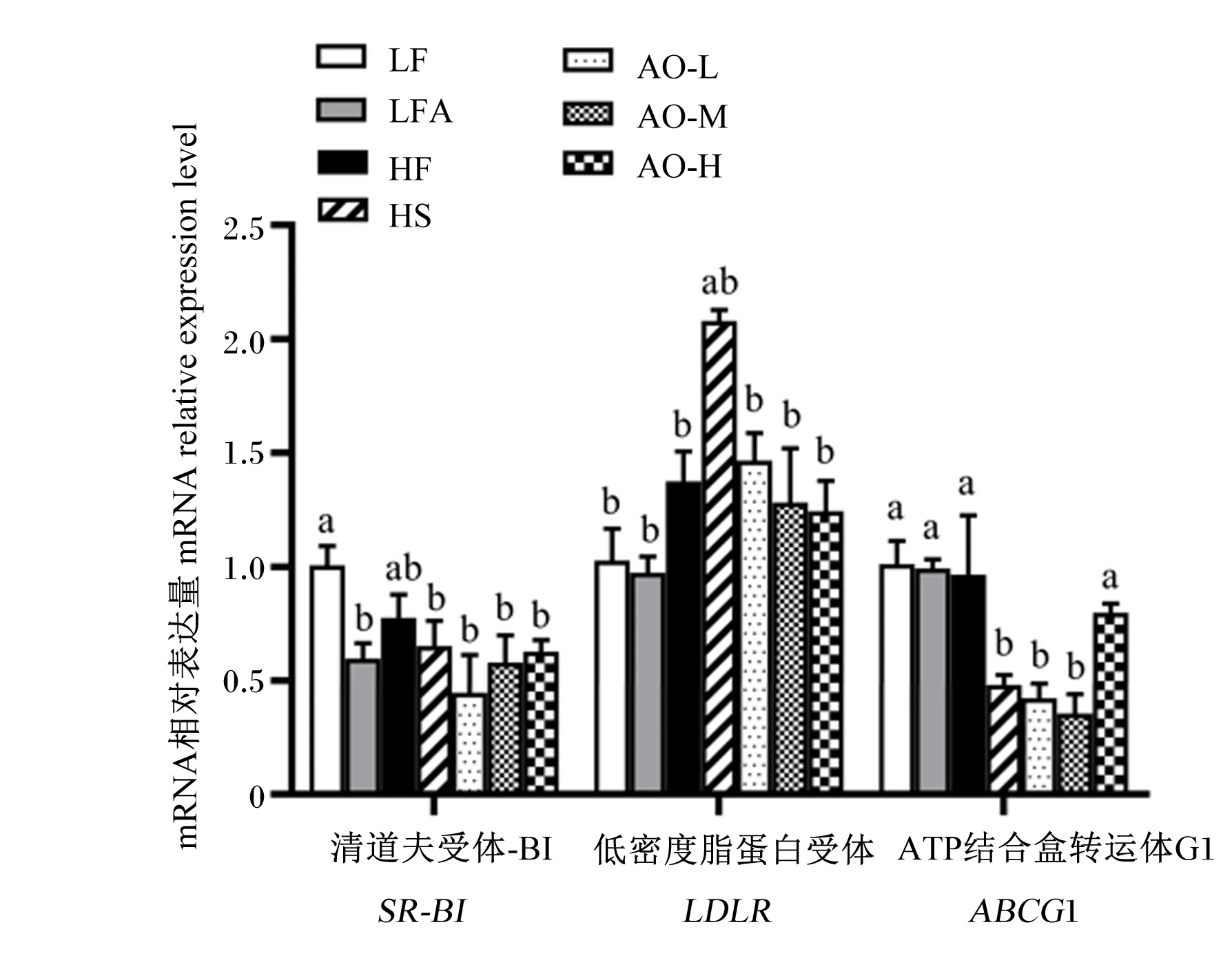
图7 牛油果油对肥胖小鼠肝脏中胆固醇转运相关基因表达的影响Fig.7 Effects of avocado oil on expression of genes involved in cholesterol transport in liver of obese mice
2.7.2 牛油果油对肥胖小鼠肝脏胆汁酸合成相关基因表达的影响
如图8所示,相较于LF组,LFA组肝脏中法尼基衍生物X受体(FXR)的mRNA相对表达量显著下调(P<0.05),胆固醇7α-羟化酶(CYP7A1)、胆固醇27α-羟化酶(CYP27A1)的mRNA相对表达量均显著上调(P<0.05);与HF组相比,HS、AO-L、AO-M、AO-H组肝脏中FXR的mRNA相对表达量均显著下调(P<0.05),CYP7A1的mRNA相对表达量均显著上调(P<0.05);HS和AO-H组肝脏中CYP27A1的mRNA相对表达量均显著上调(P<0.05)。
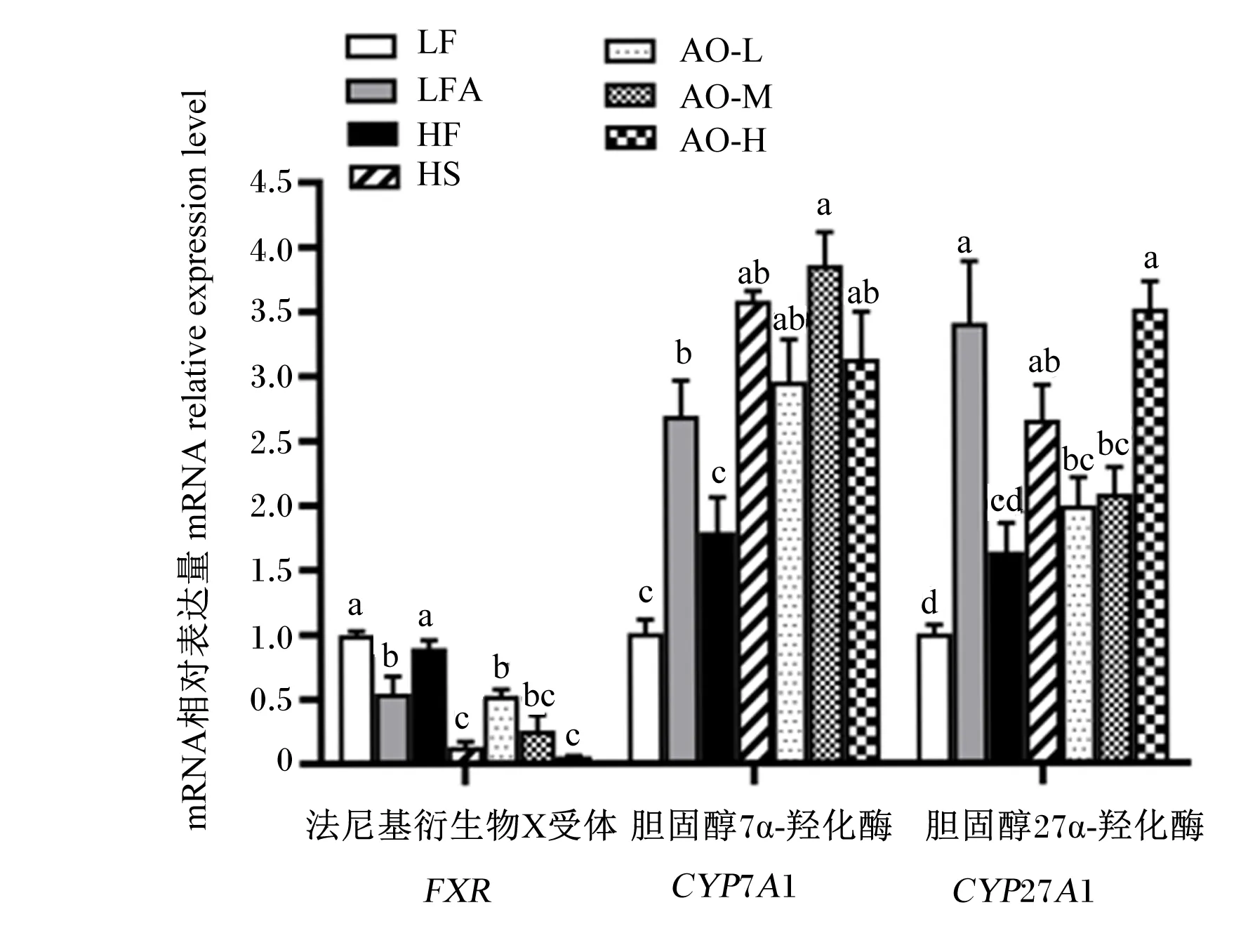
图8 牛油果油对肥胖小鼠肝脏中胆汁酸合成相关基因表达的影响Fig.8 Effects of avocado oil on expression of genes involved in bile acid synthesis in liver of obese mice
2.8 牛油果油对肥胖小鼠肝脏胆固醇排出的影响
如图9所示,相较于LF组,LFA组肝脏中ATP结合盒转运体G5(ABCG5)的mRNA相对表达量显著下调(P<0.05),ATP结合盒转运体G8(ABCG8)的mRNA相对表达量显著上调(P<0.05);相较于HF组,牛油果油和辛伐他汀干预均显著上调了肥胖小鼠肝脏中ABCG5和ABCG8的mRNA相对表达量(P<0.05)。

图9 牛油果油对肥胖小鼠肝脏中胆固醇排出相关基因表达的影响Fig.9 Effects of avocado oil on expression of genes involved in cholesterol excretion in liver of obese mice
3 讨 论
3.1 牛油果油改善肥胖小鼠的体重和血脂代谢紊乱
牛油果是一种高油酸含量的食物,研究发现富含油酸的膳食模式具有预防肥胖、调节血糖、调节血脂和抗炎症等多种保健作用[14]。当亚油酸和油酸含量在一定比例时(含量相同或亚油酸含量低于油酸),有降低LDL-C的作用,HDL-C可以被相对地提高[15]。本研究发现,牛油果油富含单不饱和脂肪酸,特别是油酸;对肥胖小鼠进行干预后,牛油果油可抑制肥胖小鼠体重的增加,降低肝脏系数,减少血清中TC、TG、LDL-C含量,增加血清中HDL-C含量,对肥胖小鼠的血脂代谢紊乱具有较好的调节作用。
3.2 牛油果油改善肥胖小鼠的肝脏损伤
肥胖不是指单纯的体重增加,而是体内脂肪组织积蓄过剩的状态。ALT、AST是肝细胞受损的重要标志,反映了肝脏细胞膜和细胞器的损伤程度,肝脏组织脂肪的过度堆积导致肝细胞中的ALT和AST进入血液,因此血清中二者活性的高低可衡量肝脏受损程度[16]。本研究结果发现,牛油果油干预后肥胖小鼠血清中ALT和AST活性显著降低;此外,对肝脏组织和睾周脂肪组织进行HE染色,发现牛油果油能有效抑制肥胖小鼠肝脏脂肪的堆积,减少脂滴的形成,控制脂肪组织的扩张和脂肪细胞的变大。因此,牛油果油对由高脂饲粮引起的小鼠血清ALT、AST活性升高具有较好的抑制作用,对肝脏起到了保护作用,并且可抑制肝脏脂肪的堆积。
3.3 牛油果油调节肥胖小鼠胆固醇代谢途径中相关基因的表达
胆固醇的生物合成过程受多方面调控,研究发现肝脏LXR基因敲除小鼠体内的胆固醇逆转运、分解代谢和排出均被损害,这提示了肝脏LXR在全身胆固醇动态平衡中的重要性[17],有助于消除细胞内多余的胆固醇,调节胆固醇代谢途径中相关蛋白和基因的表达[18-19]。本研究结果显示,中、高剂量的牛油果油显著提高了肥胖小鼠肝脏中LXR的表达,而LXR一直被认为是体外和体内ABCG5和ABCG8的正调节因子[20],能通过靶基因ABCG5和ABCG8调节中性类固醇进入胆汁和肠腔,促进肝脏内胆固醇流入胆汁[21-22]。本试验结果表明,牛油果油的干预能上调肥胖小鼠肝脏中ABCG5和ABCG8基因的表达,促进肝脏中胆固醇外排到胆汁,最终可能引起粪便中胆固醇排出量增加,降低血清胆固醇含量。
胆固醇生物合成途径中的关键限速酶HMGCR是典型的SREBP2反应基因,它的活性可通过可逆的磷酸化来调节,抑制AMPKα的活性能激活HMGCR并促进胆固醇的生物合成[23]。Tang等[24]研究表明,增加肝细胞AMPKα的磷酸化,可以下调SREBP2及其下游靶基因的表达来抑制肝脏胆固醇合成。本试验结果显示,牛油果油促进了肥胖小鼠肝脏中AMPKα基因的表达,从而抑制了SREBP2基因的表达,对HMGCR基因的表达无显著影响,但辛伐他汀使肥胖小鼠肝脏中HMGCR基因的表达显著上调,这可能是因为辛伐他汀通过减少胆固醇合成来降低血清LDL-C含量这一酶促途径的靶向抑制导致了适应性机制的出现,为应对这种代谢阻断,肝脏中HMGCR基因的表达补偿性上调[25-26]。他汀类药物诱导内质网中胆固醇的耗竭又会激活SREBP2,SREBP2进入细胞核激活其下游靶标LDLR等基因的转录,清除血液中多余的LDL-C,以维持血脂的正常水平[27],因此本试验中辛伐他汀组肝脏中SREBP2和LDLR基因的表达均显著上调。而从本试验结果分析,牛油果油没有受到这一限制,牛油果油对LDLR的转录水平无显著影响,这可能与LXR的激活有关,在一种反调节机制中,LXR诱导LDLR的降解物(IDOL)表达,并随后降解LDLR,从而限制了外周组织如巨噬细胞对胆固醇的摄取[28];也可能是因为小鼠长期摄入高脂饲粮导致胆固醇积累过多。此外,胆固醇还可转变成胆汁酸,这是胆固醇分解的重要途径,主要由经典途径中的CYP7A1和替代途径中的CYP27A1调控[29]。Zhang等[30]研究发现,槲皮素能通过促进大鼠胆固醇向胆汁酸的转化来调节肝脏胆固醇代谢。本试验结果显示,肥胖小鼠肝脏中FXR基因的表达被抑制,影响了FXR介导的胆汁酸代谢的负反馈调节,从而上调了CYP7A1和CYP27A1的表达,促进肝脏中胆固醇的分解,增加胆汁酸的合成。
4 结 论
① 牛油果油的主要脂肪酸成分为油酸(55.56%)、棕榈酸(22.36%)、棕榈油酸(7.50%)、亚油酸(7.42%)和13-十八碳烯酸(7.16%)。
② 牛油果油能降低肥胖小鼠的体重和肝脏系数,促进胆固醇和胆汁酸排出,改善血脂代谢异常和肝功能损伤,减少脂质沉积。
③ 牛油果油能抑制肥胖小鼠肝脏中胆固醇的生物合成,促进胆汁酸的合成和胆固醇的排出。
