人脐血间充质干细胞激活磷脂酰肌醇3激酶/蛋白激酶B通路对脑缺血再灌注大鼠的神经保护作用
2023-12-04范金金丁立张跃亮陈俊张贝李雪清佟旭王云甫艾志兵
范金金,丁立,张跃亮,陈俊,张贝,李雪清,佟旭,王云甫,艾志兵
目的 探究人脐血间充质干细胞(human umbilical cord blood mesenchymal stem cells,hUCBMSCs)调控磷脂 肌醇3激酶/蛋白激酶B(phosphoinositide3-kinase/protein kinase B,PI3K/Akt)通路对脑缺血再灌注损伤大鼠周细胞表达和神经功能变化的影响。
方法 取雄性SD大鼠共72只,随机分组为假手术组、模型组、干细胞组、干细胞+抑制剂组,每组18只。除假手术组外,剩余各组均建立脑缺血再灌注模型。造模成功后,模型组尾静脉注射0.1 mL的磷酸盐缓冲盐溶液(phosphate-buffered saline,PBS),干细胞组尾静脉注射0.1 mL含有2×106个hUCBMSCs的PBS,干细胞+抑制剂组尾静脉注射0.1 mL含2×106个hUCBMSCs的PBS及腹腔注射PI3K/Akt抑制剂LY294002(0.03 mg/100 g),LY294002每天给药1次,直至处死。术后1、3、7、14 d测定改良神经功能缺损评分(modified neurological severity scores,mNSS)。术后7、14 d,采用2,3,5-氯化三苯基四氮 (2,3,5-triphenyltetrazolium chloride,TTC)染色法检测大鼠脑梗死面积,尼氏染色检测大脑皮质缺血半暗带正常神经元细胞数,免疫组织化学法检测大脑皮质缺血半暗带血小板衍生生长因子受体-β(platelet derived growth factor receptor-β,PDGFRβ)阳性周细胞的数量,免疫印迹法检测大脑皮质缺血半暗带PI3K/Akt通路相关蛋白p-Akt及Akt的表达。
结果 术后7 d,4组各项指标整体差异均有统计学意义(P<0.001)。与假手术组比较,模型组的大鼠正常神经元细胞数[(55.42±4.75)个 vs.(8.50±1.64)个,P<0.001]和p-Akt/Akt(1.00±0.00 vs.0.47±0.06,P=0.002)均降低,脑PDGFRβ+周细胞数量[(1.08±0.29)个 vs.(13.67±2.47)个,P<0.001]增加;与模型组比较,干细胞组大鼠的mNSS评分[(6.33±0.71)分 vs.(4.78±0.98)分,P<0.001]和脑梗死率(32.66%±1.76% vs.14.60%±0.52%,P<0.001)均降低,正常神经元细胞数[(8.50±1.64)个 vs.(23.17±1.77)个,P<0.001]、脑PDGFRβ+周细胞数量[(13.67±2.47)个 vs.(28.50±3.19)个,P<0.001]和p-Akt/Akt(0.47±0.06 vs.0.83±0.18,P=0.017)均增加;与干细胞组比较,干细胞+抑制剂组的大鼠mNSS评分[(4.78±0.98)分 vs.(6.11±0.78)分,P=0.002]和脑梗死率(14.60%±0.52% vs.27.85%±0.59%,P<0.001)均增加,正常神经元细胞数[(23.17±1.77)个 vs.(11.83±0.88)个,P=0.003]、脑PDGFRβ+周细胞数量[(28.50±3.19)个 vs.(20.33±1.44)个,P=0.007]和p-Akt/Akt(0.83±0.18 vs.0.36±0.11,P=0.003)均降低。术后14 d,4组各项指标整体差异均有统计学意义(P<0.001)。与假手术组比较,模型组的大鼠正常神经元细胞数[(57.08±3.79)个 vs.(11.25±5.52)个,P<0.001]和p-Akt/Akt(1.00±0.00 vs.0.53±0.12,P=0.002)均降低,脑PDGFRβ+周细胞数量[(2.00±0.25)个 vs.(13.42±1.04)个,P<0.001]增加;与模型组比较,干细胞组大鼠的mNSS评分[(4.89±0.78)分 vs.(2.33±0.87)分,P<0.001]和脑梗死率(32.58%±1.96% vs.11.78%±1.92%,P<0.001)均降低,正常神经元细胞数[(11.25±5.52)个 vs.(31.00±1.89)个,P<0.001]、脑PDGFRβ+周细胞数量[(13.42±1.04)个 vs.(31.42±3.66)个,P<0.001]和p-Akt/Akt(0.53±0.12 vs.0.93±0.12,P=0.004)均增加;与干细胞组比较,干细胞+抑制剂组大鼠的mNSS评分[(2.33±0.87)分 vs.(4.44±0.53)分,P<0.001]和脑梗死率(11.78%±1.92% vs.25.25%±2.76%,P<0.001)均增加,正常神经元细胞数[(31.00±1.89)个 vs.(13.83±1.04)个,P=0.002]、脑PDGFRβ+周细胞数量[(31.42±3.66)个 vs.(20.67±1.42)个,P<0.001]和p-Akt/Akt(0.93±0.12 vs.0.53±0.09,P=0.005)均降低。
结论 hUCBMSCs可能通过激活PI3K/Akt通路促进周细胞的存活募集,发挥神经保护的作用,进而促进脑缺血再灌注损伤大鼠的神经功能恢复。
再灌注治疗是缺血性卒中(ischemic stroke,IS)临床治疗最有效的方法,但由于其治疗时间窗较短,限制了再灌注治疗的广泛应用[1]。因此,新型治疗靶点及方法的研究对于IS的治疗具有重要的意义。
周细胞直接与内皮细胞相接触,是包裹、支持和控制微血管的壁细胞,位于神经血管单元(neurovascular unit,NVU)的中心[2]。周细胞作为血脑屏障(blood brain bar r ier,BBB)的重要组成部分,对于维持BBB的完整性十分重要[3-4]。周细胞募集至新形成的微血管,促进其成熟、稳定,被认为是卒中治疗的潜在靶点。间充质干细胞(mesenchymal stem cells,MSCs)由于其多向分化潜能已成为治疗IS的一个极具吸引力的候选细胞[5]。既往研究表明,MSCs对IS有神经保护作用[6-7]。磷脂酰肌醇3激酶/蛋白激酶B(phosphoinositide3-kinase/protein kinase B,PI3K/Akt)通路是介导细胞存活、分化、增殖、转移、凋亡和新陈代谢的重要信号传导途径[8]。动物实验发现,MSCs可激活PI3K/Akt通路,改善小鼠脊髓的缺血损伤[9]。更重要的是,该通路的激活通过增强内皮细胞之间以及内皮细胞和周细胞之间的相互作用来促进周细胞向新生内皮管的募集,对促进血管生成起着重要作用[10-11]。本研究旨在观察人脐血间充质干细胞(human umbilical cord blood mesenchymal stem cells,hUCBMSCs)通过PI3K/Akt通路对周细胞存活及募集的作用,以及对脑损伤大鼠的神经功能的影响,探讨干细胞治疗IS的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 SPF级雄性SD大鼠,体质量250~300 g,购自湖北医药学院实验动物中心,动物许可证号:SCXK(鄂)2019-0008。所有大鼠均饲养于湖北医药学院动物中心实验室,饲养温度25 ℃,相对湿度为50%~60%。将72只雄性SD大鼠随机分为假手术组、模型组、干细胞组、干细胞+抑制剂组,每组18只。
1.1.2 实验试剂 hUCBMSCs、完全细胞培养基、Akt抗体、p-Akt抗体、血小板衍生生长因子受体-β(platelet derived growth factor receptor-β,PDGFRβ)抗体、β肌动蛋白、辣根过氧化物酶标记的羊抗兔IgG、LY294002(PI3K/Akt抑制剂)、RIPA裂解液、蛋白酶抑制剂、BCA蛋白定量试剂盒。
1.2 方法
1.2.1 人脐血间充质干细胞的培养与传代 完全细胞培养基重悬hUCBMSCs,把细胞放入37 ℃、5% CO2、饱和湿度的培养箱中培养,当培养液的颜色变黄时则予以换液,换液间隔为3 d。当细胞达到80%~90%汇合时,按照1∶2进行传代,并于显微镜下观察细胞生长情况。用台盼蓝染色计数活细胞数,将第3代细胞磷酸盐缓冲盐溶液(phosphate-buffered saline,PBS)重悬后用于后续的大鼠尾静脉注射。
1.2.2 模型制作与给药 由颈外动脉插入栓线制备大脑中动脉闭塞模型,缺血90 min后,抽出栓线实现再灌注。假手术组仅做血管钝性分离,其余3组均制作缺血再灌注模型。待实验大鼠完全苏醒后,根据Longa 5分法进行评估,1~3分为造模成功。造模不成功及术中出血量过多死亡的大鼠共13只,补足脱漏只数。造模成功后,模型组于尾静脉注射0.1 mL无菌PBS;干细胞组尾静脉注射等体积含有2×106个hUCBMSCs的无菌PBS;干细胞+抑制剂组尾静脉注射等体积含2×106个hUCBMSCs的PBS及模型制作前30 min腹腔注射LY294002(0.03 mg/100 g),此后每天给药1次,直至处死。术后7、14 d,完成改良神经功能缺损评分(modified neurological severity scores,mNSS)测定后,处死大鼠用于后续的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色、免疫组化和免疫印迹实验。1.3 观察指标及检测方法
1.3.1 大鼠改良神经功能缺损评分 术后1、3、7、14 d,每组随机选取9只大鼠,对大鼠进行运动、感觉、反射及不正常运动等方面的评估,满分18分,评分越高说明大鼠神经功能损伤越严重。
1.3.2 TTC染色检测大鼠脑梗死面积 术后7、14 d,每组随机选取3只大鼠,将大鼠麻醉后断头取脑,置于脑切片膜具中。-20 ℃冰箱中冷冻,沿冠状面切成7片,2% TTC中避光显色。梗死区呈现白色,正常脑组织呈现鲜红色。拍照获取图像,Image J软件分析脑梗死面积。公式为:脑梗死率=脑梗死面积/全脑面积×100%。
1.3.3 尼氏染色检测神经元细胞损伤及正常神经元数量 术后7、14 d,每组随机选取3只大鼠,麻醉后断头取脑,石蜡包埋,切片机做病理切片,片厚3 μm,脱蜡、脱水,尼氏染色。镜下观察大脑皮质缺血半暗带神经元细胞损伤变化,计数4个不同视野的正常神经元的数量,取其平均值。
1.3.4 免疫组化染色检测PDGFRβ+周细胞数 术后7、14 d,每组随机选取3只大鼠,前述步骤同尼氏染色,石蜡切片脱蜡,抗原修复,3% H2O2孵育10 min,PBS冲洗3次,10%山羊血清孵育30 min,滴加PDGFRβ抗体(1∶200),4 ℃孵育过夜;PBS冲洗3次,37 ℃的湿盒中加入辣根过氧化物酶标记的羊抗兔IgG聚合物孵育30 min;PBS冲洗3次,二氨基联苯胺显色,再苏木素复染、脱水、透明、中性树胶封片,显微镜下观察并拍照。计数大脑皮质缺血半暗带4个非重叠区域的PDGFRβ抗体标记的阳性细胞数量,并取其平均值。
1.3.5 免疫印迹检测p-Akt及Akt蛋白表达水平 术后7、14 d,每组随机选取3只大鼠,冰上断头取脑,取大脑皮质缺血半暗带(根据Ashwal等[12]方法确定)脑组织提取总蛋白。脑组织称重,加入裂解液,匀浆机中迅速匀浆。冰上裂解30 min,4 ℃离心15 min取上清液。BCA法蛋白定量,100 ℃加热蛋白变性。SDSPAGE凝胶电泳、蛋白转膜至PVDF膜上、膜封闭2 h。一抗:Akt抗体(1∶1000)、p-Akt抗体(1∶1000)及β肌动蛋白(1∶5000),4 ℃过夜孵育。TBST洗膜,二抗(1∶4000)室温孵育90 min,增强型化学发光试剂显影。使用Image J软件分析Akt、p-Akt条带灰度值,β肌动蛋白用作内部对照,Akt作为p-Akt的比值对照,将假手术组标准化为1。
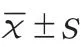
2 结果
2.1 改良神经功能缺损评分比较 各时间点、各组大鼠mNSS评分的整体差异均具有统计学意义(P<0.001)。术后1、3、7、14 d,与假手术组比较,模型组、干细胞组及干细胞+抑制剂组的mNSS评分均增加(P<0.001)。与模型组比较,干细胞组在术后1 d的mNSS评分差异无统计学意义(P=0.912),术后3、7、14 d的mNSS评分均降低(P<0.001);术后1、3、7、14 d,与模型组比较,干细胞+抑制剂组的mNSS评分差异均无统计学意义(P=0.988,P=0.730,P=0.912,P=0.465)。与干细胞组比较,干细胞+抑制剂组在术后1 d的mNSS评分差异无统计学意义(P=0.988),术后3、7、14 d的mNSS评分均增加(P=0.003,P=0.002,P<0.001)(表1)。
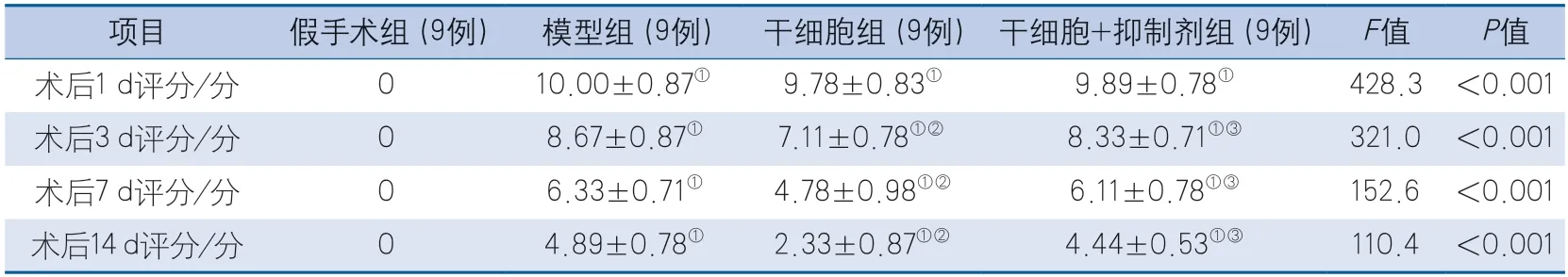
表1 各组大鼠术后不同时段神经功能缺损评分Table 1 Neurological deficit scores of rats in different periods after operation
2.2 各组大鼠脑梗死率比较 术后7、14 d,各组大鼠各时间点的脑梗死率的整体差异均具有统计学意义(P<0.001)。术后7、14 d,与假手术组比较,模型组、干细胞组及干细胞+抑制剂组大鼠的脑梗死率均增大(P<0.001);与模型组比较,干细胞组大鼠的脑梗死率均减小(P<0.001),干细胞+抑制剂组大鼠的脑梗死率均减小(P=0.001,P=0.008);与干细胞组比较,干细胞+抑制剂组大鼠的脑梗死率均增大(P<0.001)(图1,表2)。

图1 各组大鼠TTC染色结果Figure 1 TTC staining results of rats in each group

表2 各组大鼠脑梗死率比较Table 2 Comparison of the cerebral infarction rate of rats in each group
2.3 各组大鼠正常神经元数量比较 术后7、14 d,各组大鼠正常神经元数量的整体差异均具有统计学意义(P<0.001)。术后7、14 d,与假手术组比较,模型组、干细胞组及干细胞+抑制剂组大鼠的正常神经元数量均降低(P<0.001);与模型组比较,干细胞组大鼠的正常神经元数量均增加(P<0.001),干细胞+抑制剂组大鼠的正常神经元数量差异均无统计学意义(P=0.474,P=0.806);与干细胞组比较,干细胞+抑制剂组大鼠的正常神经元数量均降低(P=0.003,P=0.002)(图2,表3)。
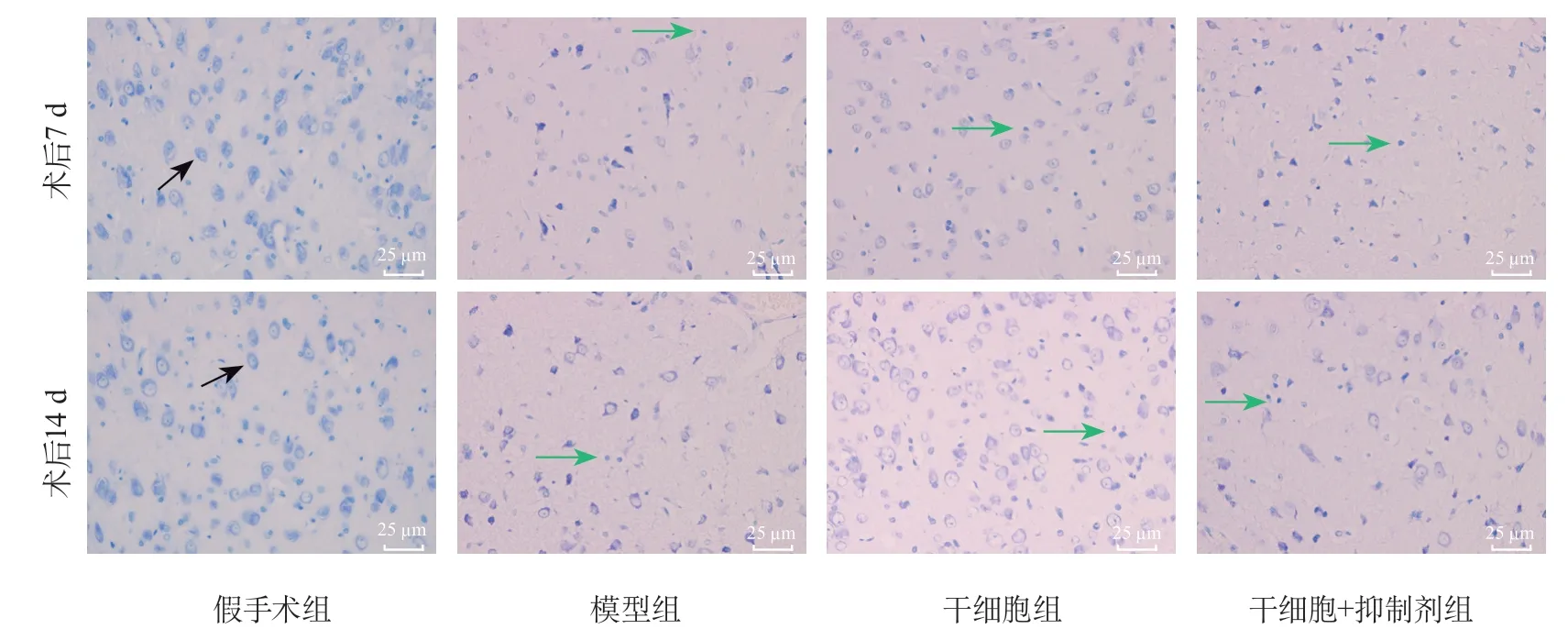
图2 各组大鼠脑组织尼氏染色结果Figure 2 Results of Nissl staining in brain tissue of rats in each group
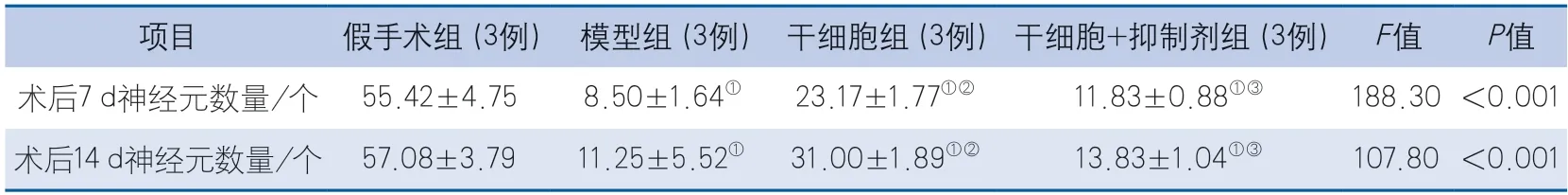
表3 各组大鼠正常神经元数量比较Table 3 Comparison of the number of normal neurons in each group
2.4 各组大鼠PDGFRβ+周细胞数 术后7、14 d,各组大鼠PDGFRβ+周细胞数的整体差异均具有统计学意义(P<0.001)。术后7、14 d,与假手术组比较,模型组、干细胞组及干细胞+抑制剂组大鼠PDGFRβ+周细胞数均增加(P<0.001);与模型组比较,干细胞组大鼠PDGFRβ+周细胞数均增加(P<0.001),干细胞+抑制剂组大鼠PDGFRβ+周细胞数均增加(P=0.022,P=0.01);与干细胞组比较,干细胞+抑制剂组大鼠PDGFRβ+周细胞数均降低(P=0.007,P<0.001)(图3,表4)。

图3 各组大鼠PDGFRβ+周细胞Figure 3 PDGFRβ+ pericytes of rats in each group
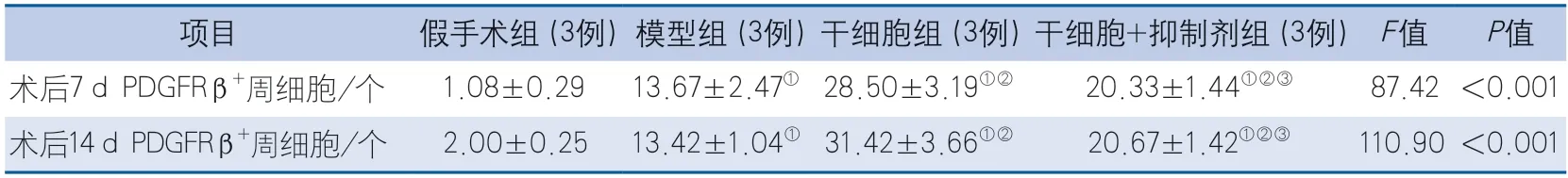
表4 各组大鼠PDGFRβ+周细胞数结果比较Table 4 Comparison of the number of PDGFRβ+ pericytes in each group
2.5 大鼠脑组织PI3K/Akt通路蛋白p-Akt、Akt的表达 术后7、14 d,各组大鼠脑组织p-Akt/Akt蛋白比值的整体差异均具有统计学意义(P<0.001)。术后7、14 d,与假手术组比较,模型组大鼠p-Akt/Akt均降低(P=0.002,P=0.002),干细胞组大鼠p-Akt/Akt差异均无统计学意义(P=0.326,P=0.820),干细胞+抑制剂组大鼠p-Akt/Akt均降低(P<0.001,P=0.002);与模型组比较,干细胞组大鼠p-Akt/Akt均增加(P=0.017,P=0.004),干细胞+抑制剂组大鼠p-Akt/Akt差异均无统计学意义(P=0.592,P>0.999);与干细胞组比较,干细胞+抑制剂组大鼠p-Akt/Akt均降低(P=0.003,P=0.005)(图4,表5)。

图4 各组大鼠脑组织中p-Akt、Akt蛋白表达Figure 4 Expression of p-Akt and Akt protein in brain tissue of rats in each group
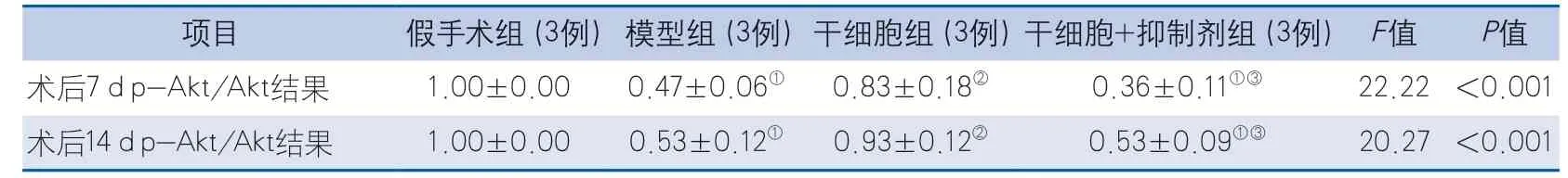
表5 各组大鼠p-Akt/Akt结果比较Table 5 Comparison of p-Akt/Akt results in each group
3 讨论
干细胞移植治疗IS的作用机制仍在继续研究中,目前认为可能的途径主要为:①替代受损的神经细胞和组织;②旁分泌功能作用,包括免疫调节、促血管生成、神经保护及神经营养功能等[13-14]。研究表明,通过尾静脉注射MSCs外泌体,可以促进脑缺血大鼠的神经血管重建和神经功能恢复[15]。在本研究中,尼氏染色、TTC染色及大鼠mNSS评分结果显示造模后,大鼠正常神经元细胞数明显减少,脑梗死率及神经功能缺损评分均明显增加;进行hUCBMSCs注射治疗后,大鼠正常神经元细胞数明显增加,脑梗死率及神经功能缺损评分均明显降低;而相比干细胞组,干细胞+抑制剂组大鼠正常神经元细胞数减少,脑梗死率及神经功能缺损评分均明显增加。由此说明,hUCBMSCs可以有效改善缺血再灌注损伤大鼠的神经细胞损伤,促进神经功能的恢复,但这些保护作用均被PI3K/Akt通路抑制剂LY294002所削弱。
PDGFRβ可以作为“活性周细胞”的标志物,其表达在脑缺血后的周细胞中被显著诱导。既往研究表明,脑缺血损伤后,梗死周围区域的周细胞中PDGFRβ表达随时间的变化而逐渐上调[16-17],脑周细胞中PDGFRβ的上调参与了周细胞向内皮管的迁移和募集,有利于BBB的维持和修复,对脑缺血后的神经保护发挥重要作用[18-19]。PI3K/Akt通路与IS密切相关,在中枢神经系统中高度表达。研究表明,缺血再灌注损伤大鼠模型中,PI3K/Akt通路的激活可减轻脑组织的损伤,促进神经功能恢复[20-21]。还有研究表明MSCs可激活PI3K/Akt通路,改善小鼠脊髓的缺血损伤。更重要的是,该通路的激活增强了内皮细胞和周细胞之间的相互作用,促进了周细胞向新生内皮管的募集和血管生成[10]。既往研究证明,在慢性下肢缺血模型中,抑制PI3K/Akt通路可减少侧支循环形成[22],PI3K抑制剂LY294002也会导致周细胞存活率降低[23]。也有研究证实,在大鼠脑出血模型中,激活PI3K/Akt通路可以促进周细胞的存活、增殖和募集,从而增加内皮细胞的周细胞覆盖,促进了神经功能的恢复[24]。本研究发现:相比模型组,干细胞组大鼠脑组织p-Akt/Akt及PDGFRβ+周细胞数明显升高;相比干细胞组,干细胞+抑制剂组大鼠脑组织p-Akt/Akt及PDGFRβ+周细胞数明显降低。由此可得,hUCBMSCs治疗大鼠脑缺血再灌注损伤过程中,可能通过增强Akt磷酸化,增加大鼠脑PDGFRβ+周细胞的存活及募集,减轻了神经元细胞的损伤和脑梗死面积,进而促进了神经功能的恢复。然而,这些保护作用被PI3K/Akt抑制剂LY294002所削弱,进一步说明hUCBMSCs通过激活PI3K/Akt信号通路发挥上述神经保护作用。
综上所述,本研究通过建立脑缺血再灌注损伤模型,给予hUCBMSCs治疗处理,减轻了神经元细胞的损伤和脑梗死面积,进而促进了神经功能的恢复,发挥脑保护作用。上述保护机制可能与激活PI3K/Akt信号通路从而促进周细胞的存活及募集有关。但本研究存在一定的不足,考虑到实验周期较长以及参照既往研究的实验设计,故并没有单独设立抑制剂组,这是后续研究需要关注的问题,本课题组在后续的研究中会进一步完善实验设计。另一方面,hUCBMSCs对脑缺血损伤的神经保护作用是否还有其他通路参与及其具体分子作用机制如何仍有待进一步研究,这也是本研究的局限性之一。
利益冲突所有作者均声明不存在利益冲突。
