血管性认知障碍的神经心理学和影像学表现研究进展
2023-12-04程安琪刘彩燕徐蔚海
程安琪,刘彩燕,徐蔚海
血管性认知障碍(vascular cognitive impairment,VCI)是脑血管病变及其危险因素相关的任何严重程度的认知障碍[1]。约44%的患者在卒中后2~6个月出现整体认知功能下降[2]。然而卒中后认知障碍只强调了认知障碍出现与卒中之间的时间关系,未考虑到VCI常多种病因混杂,其类型包括皮质下缺血性认知障碍、多发梗死性认知障碍和混合型认知障碍等,值得注意的是混合型认知障碍(脑血管病和神经变性病混合)比例可高达85%[3]。认知障碍患者虽然尚未出现卒中,但是有血管危险因素或脑血管受累者,也需要考虑血管性认知障碍,如心源性及颅内外动脉粥样硬化性血管狭窄造成的低灌注性认知障碍。神经心理学和影像学表现是VCI精准诊断、诊疗分级、疗效评估、进展预测的“金标准”[4]。本文将回顾神经心理学和影像学在VCI精准诊断和进展预测等临床应用方面的研究进展,除了卒中后认知障碍和皮质下缺血性血管性认知障碍外,本文还关注了低灌注性认知障碍和混合型认知障碍的研究进展。
1 血管性认知障碍的神经心理学
注意与处理速度、执行功能是VCI最常见的受损认知域,并在卒中后3~6个月的改善最大,而语言功能的损伤则没有改善的趋势[5-6]。注意与处理速度、语言功能的损害可能导致其他认知域的损害被高估[7]。卒中后的基线认知功能是长期认知轨迹的良好预测指标[8]。负面精神状态(包括抑郁、焦虑、压力知觉和疲劳)与主观认知功能损害相关,并独立于客观认知功能损害[9]。
一项纳入了170例颅内动脉粥样硬化性狭窄患者的研究发现,症状性和无症状性患者整体认知功能和语言功能低于健康对照组,这种损害独立于传统脑血管病危险因素、脑白质高信号和颞叶内侧萎缩[10]。混合型痴呆和阿尔茨海默病(Alzheimer’s disease,AD)均可检出延迟记忆和线索记忆功能障碍[11]。因此,对于无卒中发生但存在颅内外动脉狭窄的认知障碍患者,应在谨慎地借助影像学和生物标志物鉴别出混合型痴呆的AD病理成分后,确定颅内外动脉狭窄造成的低灌注性认知障碍对于认知障碍的贡献度,通过脑血管危险因素干预挽救VCI的“缺血半暗带”。
2 血管性认知障碍的影像学表现
影像学有助于明确血管性脑损害是否在认知障碍中占主导地位。VCI的影像学特征主要包括脑梗死、脑出血、脑白质损伤、脑萎缩、腔隙、微出血、占位性病变和动静脉畸形等(表1)[4]。常使用的核磁序列包括MRA、HRMRI、ASL、T1WI、T2WI、FLAIR、DWI、SWI、梯度回波(gradient echo,GRE)等。PET可示踪β淀粉样蛋白以排除AD病理改变,辅助诊断VCI[12]。其他影像技术,如钆增强MRI检测出的血脑屏障渗漏与VCI之间的关系、功能MRI检测出的海马血流量与VCI之间的关系等已被证实,但尚未在临床应用[13]。影像技术和影像诊断技术的进展将有助于VCI的机制研究、精准分型和进展预测。2.1 病灶损害 左角回和左基底节区是血管性认知障碍患者的关键梗死部位[14]。卒中累及关键部位(包含左额颞叶、右顶叶、左丘脑等)的卒中后认知障碍(post-stroke cognitive impairment,PSCI)发生率高达66%,然而累及小脑等部位的PSCI发生率仅约30%[15]。基于关键部位损害,病变-症状图谱(Meta VCI Map)联盟视觉评定量表可快速准确地预测PSCI风险[16]。左侧大脑中动脉流域梗死被认为与PSCI有关[17]。双侧丘脑前辐射、胼胝体辐射线枕部、左侧下额枕束被认为是脑白质病变的关键部位[18]。联合ASL和功能MRI发现,皮质下梗死认知障碍患者的左脑岛、左中央前回、右颞中回和右楔前叶的神经血管耦联受损更严重[19]。基于DWI识别出的以左前额叶皮质和左侧深部结构为中心的失连接模式,构建出大脑结构失连接指标,可用于预测PSCI及其严重程度[20]。尽管病变-症状并非一一对应,但是基于影像关键部位的视觉评分有助于快速进行整体认知、认知域的认知障碍评估和及时的认知康复干预。
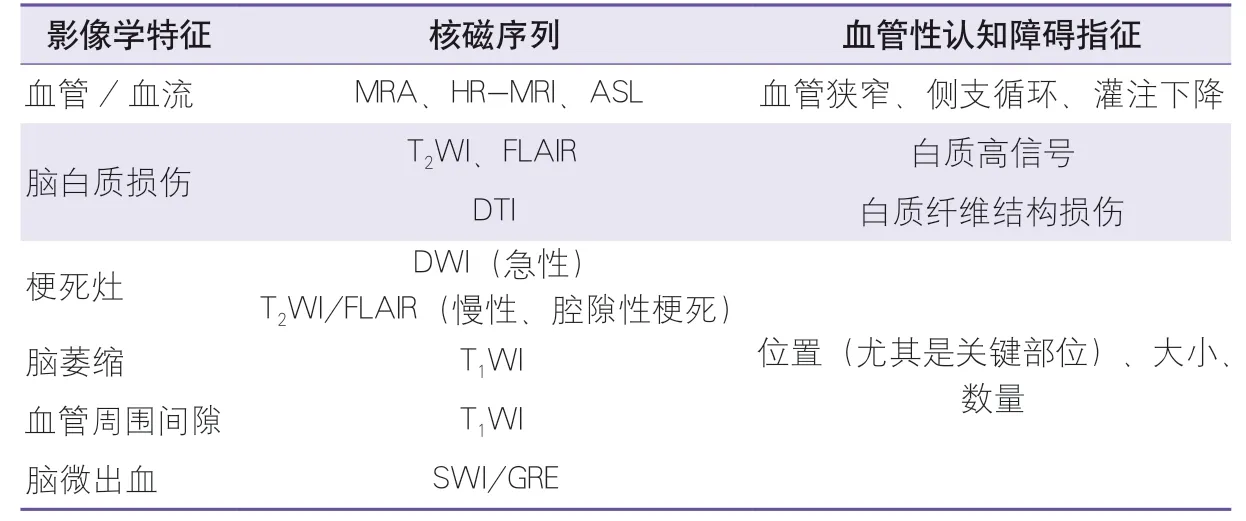
表1 血管性认知障碍的影像学表现Table 1 Imaging manifestations of vascular cognitive impairment
斑块位于大脑前动脉、斑块数目超过2个以及血管中重度狭窄等特征会增加无症状颅内动脉粥样硬化性狭窄发生VCI的风险[21]。通过血管造影评估无症状大脑中动脉狭窄患者的侧支循环情况,发现侧支循环不良患者的执行功能、注意与处理速度比侧支循环代偿功能中上的患者差[22]。在VCI发生之前ASL就可以检测出脑灌注下降[23]。
脑小血管病的影像学标准可参考脑小血管病神经影像国际标准更新版(standards for reporting vascular changes on neuroimaging,STRIVE-2)[24]。脑小血管病简易评分和修订评分预测血管性痴呆的ROC曲线的AUC分别为0.85和0.86[25]。研究发现,基线时总体脑小血管病负荷与第6个月和第12个月随访时较差的认知得分(包括整体认知和除记忆以外的认知域)和较高的mRS评分(mRS评分>1分)相关[26]。淀粉样脑血管病被认为是脑出血前认知障碍的独立危险因素[27]。脑白质病变负荷与认知功能下降程度相关[28-29],其持续进展与认知功能障碍发展相关[30],这种相关性可能是由颞叶萎缩介导的[31];分析脑白质病变负荷与认知和功能的关系除了定量,还应评估脑白质病变的位置(如脑室周围、皮质下)[32]。与无卒中对照相比,卒中患者同侧和对侧丘脑、纹状体和小脑束的白质范围更大,并与PSCI相关[33]。海马血管周围间隙与较差的语言推理能力相关[34],基底节血管周围间隙与较低的信息处理速度有关[35]。但也有研究认为是腔隙性梗死灶而不是血管周围间隙能预测VCI患者未来5年的认知下降程度[36]。血管簇征是新发现的重度脑小血管病的影像特征,与其他脑小血管病负荷征象呈正相关[37]。
综上,卒中后认知障碍和皮质下缺血性血管性痴呆的影像学的评分和模型已经成熟,然而低灌注性认知障碍和混合型认知障碍的影像学的评分和模型仍有待建立。
2.2 脑结构病变 弥散张量成像(diffusion tensor imaging,DTI)作为检测白质损伤的影像技术,与认知功能的关系比T2WI更密切[36]。辅助诊断方面,DTI参数与处理速度和执行能力关联最密切[38];除了常用的平均弥散率(mean diffusivity,MD)和各向异性分数(fraction anisotropy,FA)以外,近期发现骨架化平均弥散率峰宽与认知功能间也具有很高的测试可重复性[39]。在鉴别诊断方面,脑小血管病对弥散指标改变的贡献率远高于AD[40]。痴呆预测方面,基线MD可预测脑小血管病患者痴呆转化,结合DTI指标和传统MRI指标时ROC曲线的AUC可达0.872[41]。
脑血管疾病可导致罪犯血管流域脑组织萎缩,脑后循环供血区灌注与脑萎缩和白质高信号的严重程度及认知能力下降有关[42]。脑萎缩被认为是卒中后痴呆最有力的预测因素[43],尤其是海马萎缩[44]。
运用多模态MRI发现,即使患者大脑中动脉狭窄病变分布区血流灌注显著降低,静息态功能连接普遍减低,脑网络信息传递效率减低,仍能在平均2年的随访时间内保持正常的认知水平。这提示脑网络在脑血流改变后的调控避免了认知障碍的出现[45]。
人工智能和影像学的结合使VCI影像学获得了飞速发展。一项关于脑小血管病认知预测模型的研究显示,认知和功能结局的最强预测因子是白质高信号、灰质和海马体的体积[46]。结合多模态影像和人工智能建立的由皮质下梗死发展为VCI的诊断模型具有良好的准确性[47]。
因此,对于可疑或确诊的VCI患者,除了关注病灶相关序列以外,结构序列如DTI和T1WI也应得到重视。
3 讨论
VCI和AD两者常合并存在,称为混合型认知障碍。两者在认知障碍中的作用与权重单靠神经心理学和影像学尚难以作出明确的界定和量化,原因包括:①脑小血管病标志物白质高信号分布与β淀粉样蛋白负荷相关[48];②静息态功能MRI发现血管血流动力学或神经元活动引起的局部脑血波动可影响β淀粉样蛋白稳态[49]。但是VCI和AD的影像标志物并不存在时间相关性[50],这意味着VCI存在区别于AD的认知障碍机制。考虑到VCI的疗效和预后优于AD,明确混合型认知障碍的诊断标准将有利于混合型认知障碍的精准诊疗。
尽管脑储备在一定程度上补偿了脑损伤对认知功能的损害[51],神经心理学和影像学仍然是VCI诊疗和预测的“金标准”。目前研究已积累了丰富的“脑危险期”血管危险因素相关性VCI以及脑血管病变相关VCI的神经心理学和影像学临床证据,临床转化的实现将有助于VCI的精准诊断、诊疗分级、疗效评估、进展预测,并带来巨大的卫生经济收益。
利益冲突所有作者均声明不存在利益冲突。
