桃4CL基因家族鉴定及其在果实色泽发育和采后贮藏冷害中的表达分析
2023-12-03孔凡旺张志刚陈玉峰王长江郑亚琴
孔凡旺,张志刚,李 伟,陈玉峰,王长江,郑亚琴,徐 蒙,*
(1.临沂大学 农林科学学院, 山东 临沂 276000; 2.邹城市自然资源和规划局, 山东 济宁 273500)
4-香豆酸辅酶A连接酶(4-coumarate: CoA ligase, 4CL)作为苯丙氨酸代谢途径中的关键分支酶之一,催化甲氧基或羟基肉桂酸衍生物转化为相应的CoA硫酯[1-2]。4CL基因在1988年首次在欧芹(Petroselinumhortense)被克隆出来,随后4CL在更多物种中得到系统的鉴定和研究[3]。研究表明,不同4CL家族成员分别参与木质素、类黄酮等化合物的合成调控[4-7]。
桃(Prunus)风味独特,鲜甜多汁,果实中的花青素显著影响果实色泽和口感,是果实品质的重要影响因素。类黄酮,尤其花青素,因其强大的抗氧化与抗病虫害能力,也赋予果实较好的营养价值和抗逆能力[8]。桃果实在采后低温贮藏过程中易遭受冷害,表现为果肉絮败与木质化等,严重影响果实品质。4CL基因主要可分为两个亚家族,其中第一亚家族成员参与木质素合成,第二亚家族成员参与花青素等类黄酮物质生物合成。拟南芥(Arabidopsisthaliana)4CL1和4CL2参与木质素生物合成,4CL3参与类黄酮代谢[5]。丹参(Salviamiltiorrhiza)第一亚家族成员Sm4CL2主要参与木质素的合成,第二亚家族成员Sm4CL3参与类黄酮生物合成[9]。石榴(Punicagranatum)Pg4CL5参与木质素的合成,Pg4CL2参与类黄酮素的合成[4]。此外,第一亚家族4CL成员参与木质素合成在模式植物杨树(Populus)中被大量研究报道[10-12]。上述结果暗示,4CL在果实类黄酮合成和采后果肉冷害木质化调控中可能发挥重要功能。目前4CL在毛竹(Phyllostachyspubescens)[13]和梨树(Pyrusbretschneideri)[14]等越来越多的物种中引起关注,但桃中尚未得到系统的鉴定和研究。
本研究基于桃基因组数据库鉴定4CL基因家族成员,从基因家族进化树的角度分析桃4CL基因家族的结构与功能;以发育阶段的不同品种光核桃(Prunusmira)果实和采后贮藏的北京9号(Prunuspersica)桃果实为研究材料,结合转录组数据分析其在果实类黄酮合成及采后冷害调控中的功能。本工作不仅为研究桃果实发育过程中 4CL的作用机制提供理论依据,而且为研究桃采后低温贮藏过程中4CL的调控作用提供重要参考。
1 材料与方法
1.1 试验材料及处理
光核桃的桃果实采集自西藏自治区林芝市,野生和半野生的品种表现为不同果肉颜色。红肉和黄肉品种为野生种,白肉品种为半野生种。采集硬核期(花后60 d)、细胞膨大期(花后85 d)和成熟期(花后95 d)果肉组织进行转录组测序分析,相关转录组数据下载自NCBI SRA数据库(SRP174461)[26]。
采后贮藏试验所用材料为北京9号桃品种,采集自山东省临沂市蒙阴县。果实采收后,选择无机械伤、成熟度和大小一致的果实运往实验室进行 0 ℃和 LTC 处理。LTC处理具体方法参照Wang等[15],预贮藏调整为10 ℃,5 d。
1.2 4CL基因家族鉴定
在 NCBI 数据库(https://www.ncbi.nlm.nih.gov/genome/?term=peach)中下载桃基因组数据(assembly Prunus_persica_NCBIv2),使用TBtools软件Gff3 sequence extract插件提取基因序列,使用ORF prediction插件将DNA序列翻译成蛋白序列。所得蛋白序列与拟南芥和水稻进行BLAST (Expection value: 0.001),所得候选基因使用HEMMER SCAN (https://www.ebi.ac.uk/Tools/hmmer/search/hmmscan)再次确认。
1.3 4CL蛋白理化性质与基因进化树分析
4CL蛋白序列基本理化性质使用 Expasy在线网站(http://web.expasy.org/protparam/)分析。从 TAIR 数据库(https:www.arabidopsis.org/)下载拟南芥4CL蛋白质序列。拟南芥和桃4CL蛋白序列使用MEGA X软件进行聚类,使用在线软件EVOLVIEW (https://evolgenius.info//evolview-v2/#mytrees)进行可视化。
1.4 不同种类光核桃发育阶段的基因表达分析
黄肉、红肉和白肉品种光核桃转录组下载自NCBI SRA数据库[26],使用Trimmomatic软件去掉接头信息,以桃作为参考基因组利用Kalliso软件得到基因表达数据。
1.5 4CL启动子顺式作用元件分析
利用桃基因组提取4CL基因编码区起始密码子上游2 000 bp的启动子序列,通过PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子中的各类顺式作用元件,使用TBtools进行可视化。
1.6 4CL共线性和保守基序分析
共线性分析及其可视化使用TBtools 软件One Step MCScanX-Super Fast插件。使用MEME网站(https://meme-suite.org/meme/tools/meme)分析4CL基因保守基序,使用TBtools 软件Gene Structure View插件进行可视化。
1.7 4CL基因表达验证
基因表达验证所用材料为蒙阴蜜桃北京9号桃品种,使用全式金逆转录试剂盒进行cDNA合成。利用Primer3网站(http://primer3.ut.ee/)设计4CL和内参特异性引物后送往擎科生物有限公司合成(表1)。

表1 qRT-PCR基因表达引物序列
2 结果与分析
2.1 桃4CL基因家族成员鉴定与染色体分布
基于桃基因组数据库,鉴定到21个4CL家族成员,其中Pp4CL15和Pp4CL16、Pp4CL20和Pp4CL21为串联重复基因,分布在1号和8号染色体上。Pp4CL7和Pp4CL8、Pp4CL10和Pp4CL11分别为片段复制基因。1号染色体上包含数量最多的4CL,第2、3和4号染色体上4CL数量最少(图1)。大多数桃4CL蛋白氨基酸数量在550左右,其中Pp4CL15与Pp4CL16氨基酸数量最多,Pp4CL19 氨基酸数量最少。Pp4CL3、Pp4CL7、Pp4CL10-Pp4CL13、Pp4CL15、Pp4CL16与Pp4CL19蛋白不稳定系数大于40,处于不稳定状态(表2)。
2.2 桃4CL基因家族成员基因结构与蛋白保守基序
为进一步分析桃4CL的基因结构特征,基于桃基因组数据库基因注释信息,提取Pp4CL的内含子、外显子等信息,利用MEME在线软件分析4CL蛋白保守基序。结果表明,Pp4CL1-Pp4CL4和Pp4CL6-Pp4CL13包含数量最多的保守基序,序列上保守性最高,Pp4CL19-Pp4C21保守基序的数量最少;基序特征相似的4CL具有近似的内含子与外显子组成。除Pp4CL19-Pp4C21,其他桃4CL均至少含有包括基序1和基序4在内的4种以上保守基序(图2)。基序1由GELWVRG组成,基序4由SSGTTGLPKGV组成,均为AMP保守结构域(AMP-binding domain),为催化功能必要的结构域(图3)。
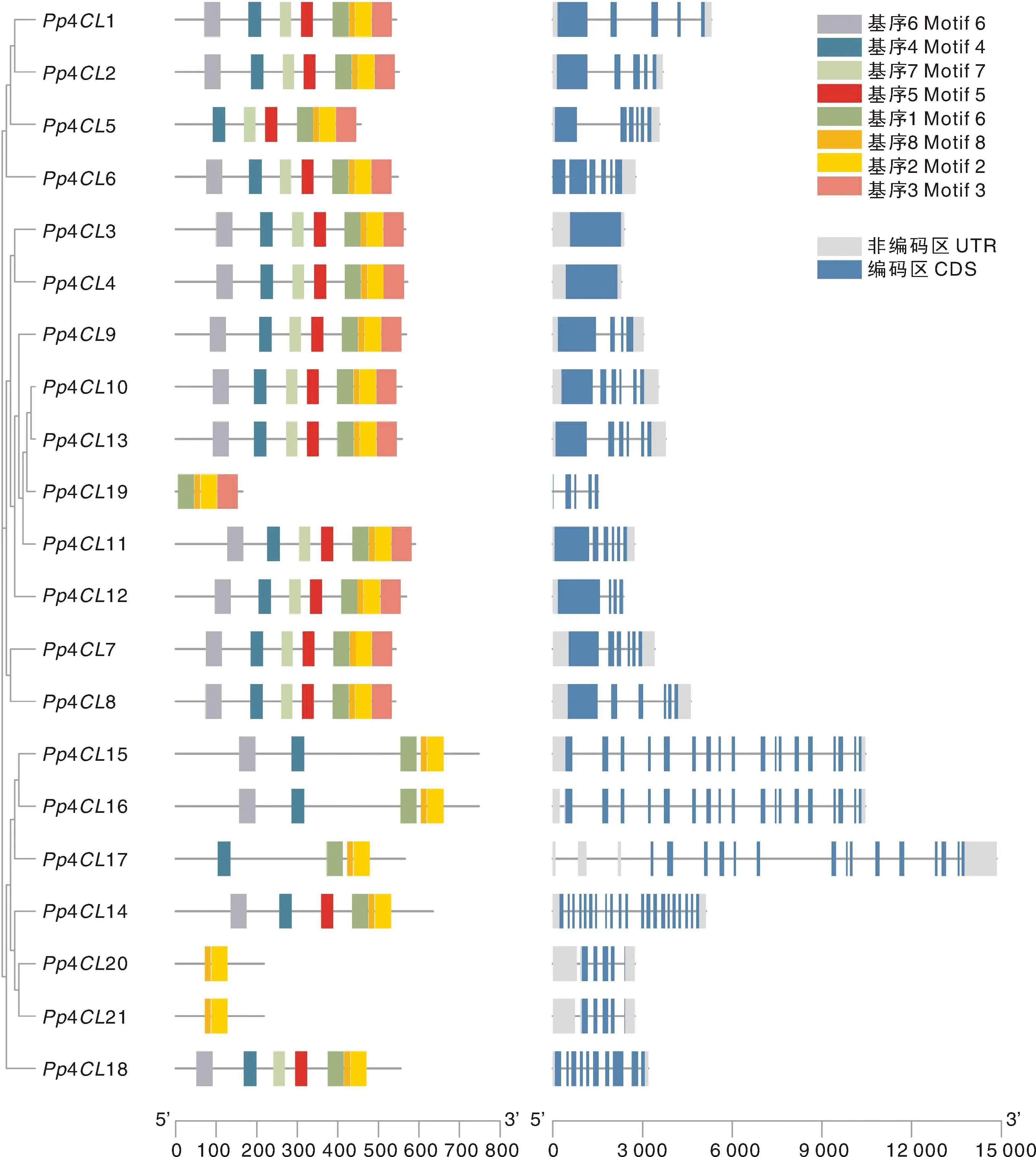
图2 桃4CL基因家族成员保守结构域分析与基因结构
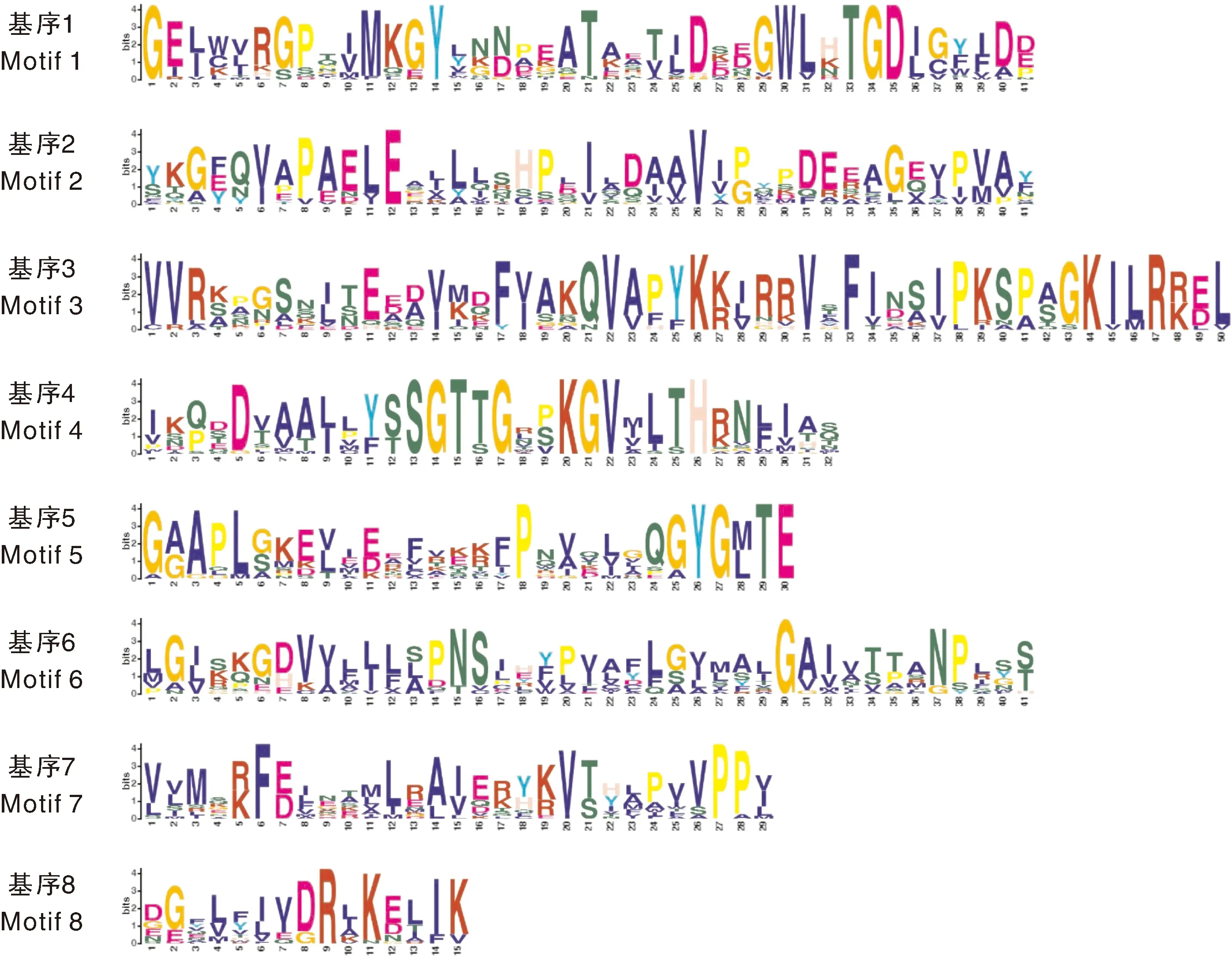
图3 桃4CL基因家族成员的保守基序
2.3 桃4CL基因家族成员启动子的顺式作用元件
Pp4CL启动子顺式作用元件分析结果表明,Pp4CL基因含有大量的非生物胁迫响应以及激素响应元件(图4)。Pp4CL2、Pp4CL3、Pp4CL8、Pp4CL13、Pp4CL17和Pp4CL19启动子上含有低温响应元件。除Pp4CL5、Pp4CL6、Pp4CL9、Pp4CL17,其余4CL均含有多个MeJA响应元件。19个Pp4CL基因含有大量厌氧诱导响应元件,尤其是Pp4CL9含有5个厌氧诱导响应元件。
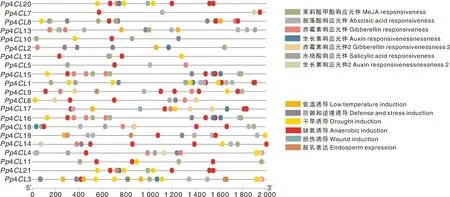
图4 桃4CL基因家族成员启动子的顺式作用元件
2.4 桃4CL基因家族成员与杨树和拟南芥共线性
由于4CL相关研究主要集中于模式植物杨树、拟南芥和水稻等物种,选择桃、杨树与拟南芥4CL基因家族成员进行共线性分析。结果表明,杨树与桃4CL有19对共线性基因,主要集中在桃第1、5号染色体上,拟南芥与桃4CL共有5对,主要集中在桃1号染色体上。其中Pp4CL5、Pp4CL6、Pp4CL10、Pp4CL11、Pp4CL13、Pp4CL15、Pp4CL16、Pp4CL17、Pp4CL18、Pp4CL19与杨树和拟南芥4CL均存在共线性(图5)。该结果暗示上述Pp4CL在遗传进化中更为保守,或具有重要功能。
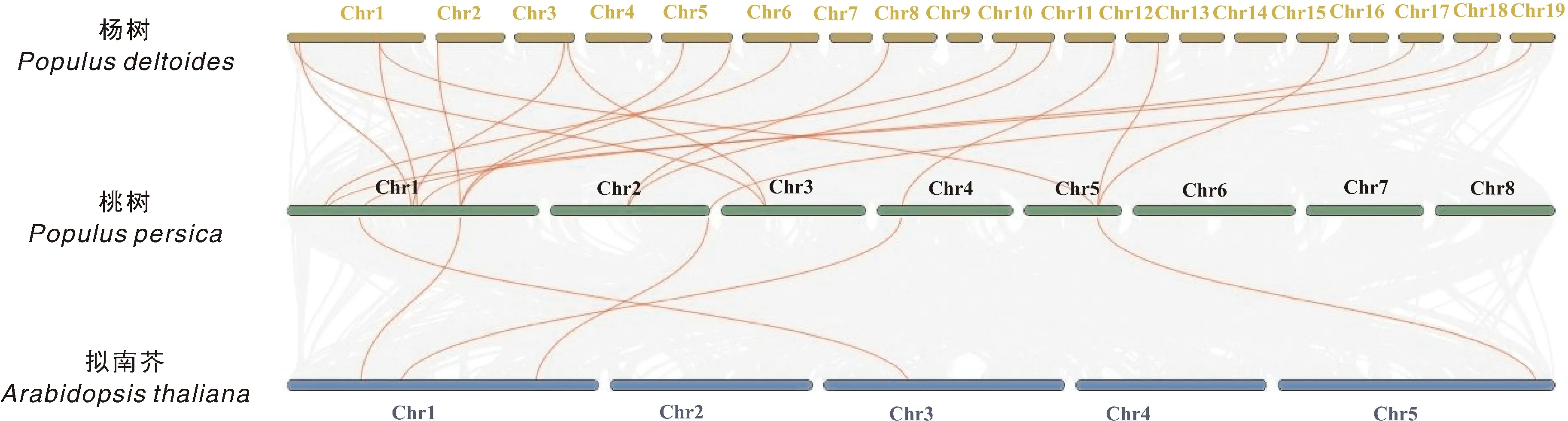
图5 桃、杨树和拟南芥4CL基因家族成员共线性分析
2.5 桃与其他物种4CL遗传进化
将桃与枇杷(Eriobotryajaponica)、杨树(Populus)、水稻(OryzasativaL.)、柳枝稷(Panicumvirgatum)、丹参(Salviamiltiorrhiza)和拟南芥(Arabidopsisthaliana)4CL基因家族成员进行遗传进化分析。结果表明,桃4CL家族成员可分为两类,Pp4CL1与Pp4CL2属于第一亚家族(Group1),Pp4CL3-Pp4CL21属于第二亚家族(Group2)。Pp4CL1与Sa4CL2、Pog4CL1、Egl4CL聚类在一起,Pp4CL2与Ej4CL1、Af4CL聚类在一起,Pp4CL5与At4CL3、Sm4CL3聚类在一起(图6)。
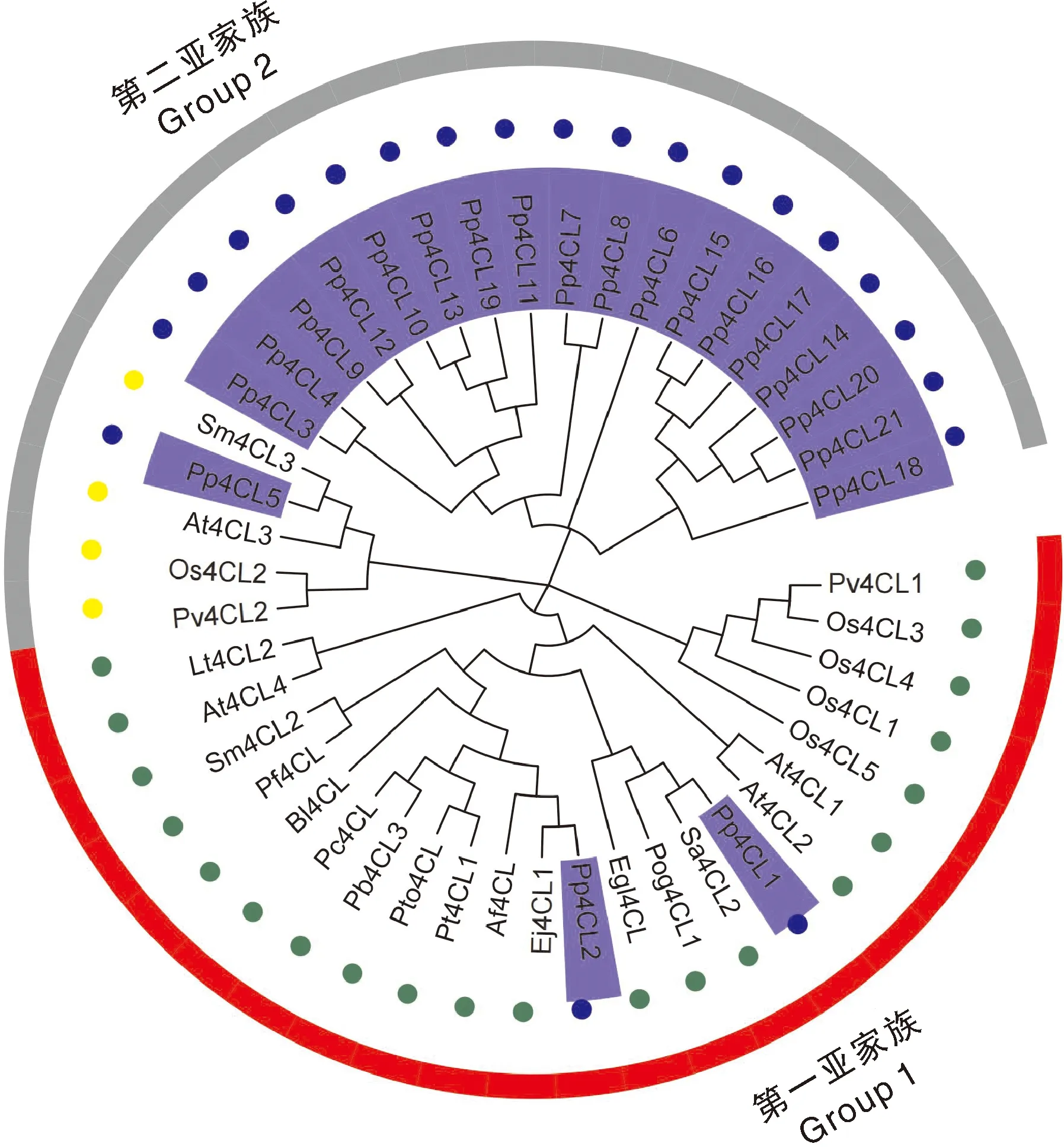
图6 桃4CL基因家族成员遗传进化分析
2.6 黄肉、白肉和红肉光核桃果实4CL基因家族成员发育阶段基因表达
光核桃为蔷薇科桃属植物,因其果核光滑得名,为桃子现存最古老的祖先。因其丰富的遗传多样性和多样的果肉颜色,在果实发育阶段的果实着色研究中具有一定价值。为明确4CL家族成员在桃果肉发育阶段中的潜在功能,对黄肉、白肉和红肉光核桃果实发育阶段的转录组数据进行4CL家族成员基因表达模式分析。如图7所示,随着果实生长发育,Pp4CL1、Pp4CL8、Pp4CL13在红肉果实中的基因表达总体呈上升趋势,表达量为红肉品种最高,黄肉和白肉品种较低;Pp4CL3、Pp4CL12、Pp4CL20、Pp4CL21在红肉果实发育阶段中的基因表达表现为先升高后降低,且总体在黄肉品种中的表达水平高于红肉品种,在白肉品种中表达始终维持在较低水平。
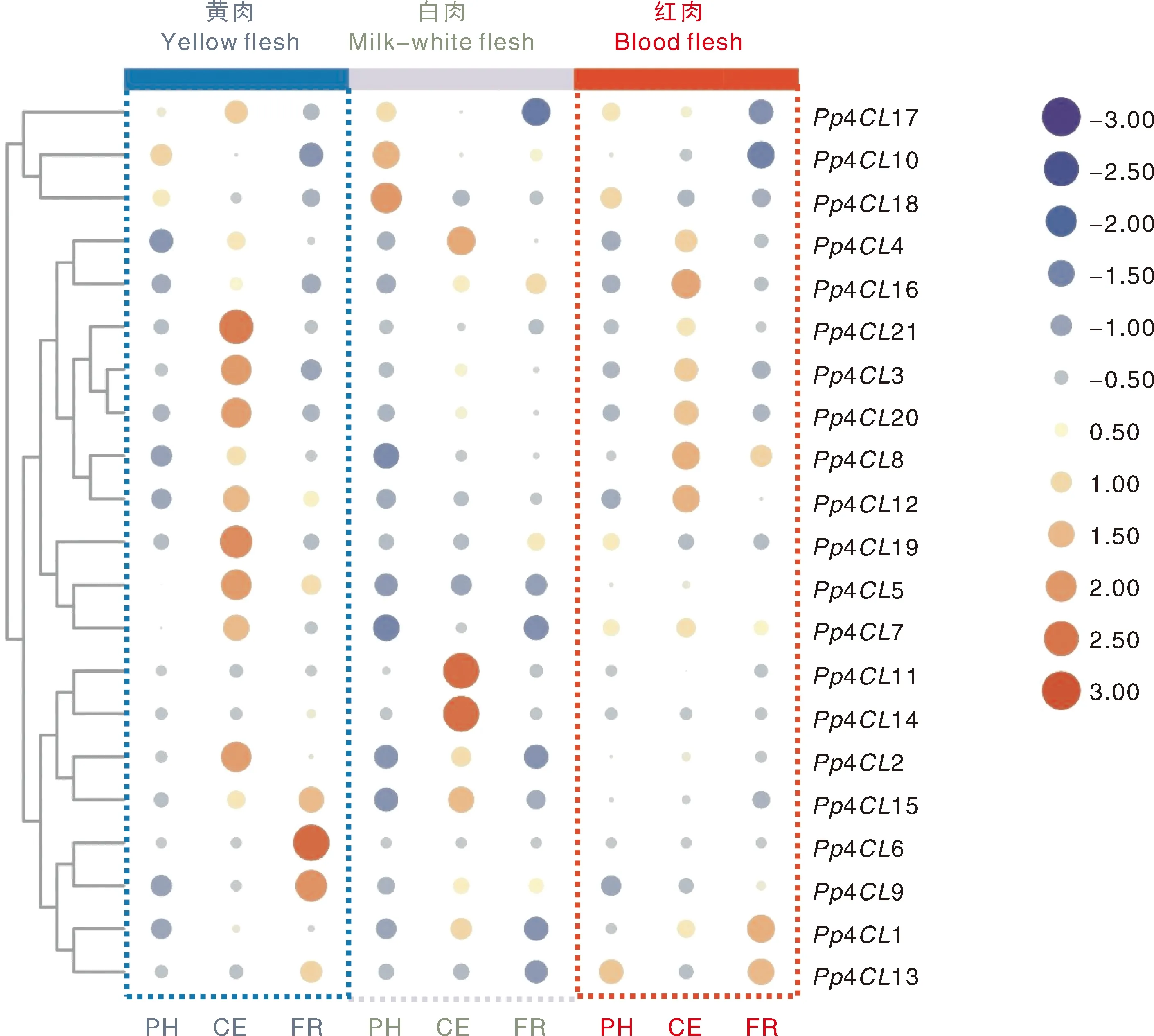
PH,硬核期;CE,细胞增大期;FR,果实成熟期。
2.7 桃4CL基因家族成员在采后低温和LTC处理中的表达
研究表明,桃果实采后低温贮藏易受冷害,LTC处理可以减缓冷害发生[11]。为明确桃4CL基因家族成员在采后低温和LTC处理中的潜在功能,结合桃采后低温贮藏转录组数据对其进行基因表达模式分析。如图8所示,Pp4CL1、Pp4CL5、Pp4CL8、Pp4CL10、Pp4CL12、Pp4CL13、Pp4CL14和Pp4CL20受低温诱导表达上调,Pp4CL2、Pp4CL3、Pp4CL7、Pp4CL11、Pp4CL15和Pp4CL17受低温诱导表达下调,Pp4CL2、Pp4CL3在果肉组织中不表达。与低温处理相比,LTC处理可进一步提高Pp4CL8、Pp4CL10、Pp4CL14基因表达水平。为了验证该转录组数据的可靠性,我们选择上述3个候选4CL进行实时荧光定量分析。如图9所示,RNA-Seq与qRT-PCR中Pp4CL8、Pp4CL10和Pp4CL14的表达趋势具有较强的一致性,表明该转录组的表达数据是可靠的。因此,我们推测桃果实采后低温贮藏过程中,Pp4CL8、Pp4CL10和Pp4CL14可响应LTC处理,通过促进类黄酮合成减缓桃果实采后冷害。
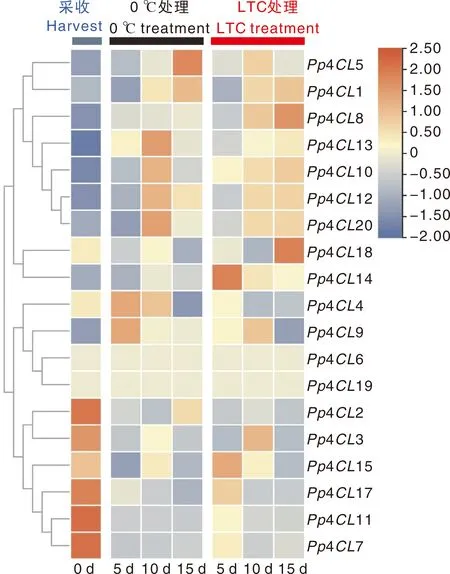
图8 4CL基因家族成员在采后低温和LTC处理中的表达模式
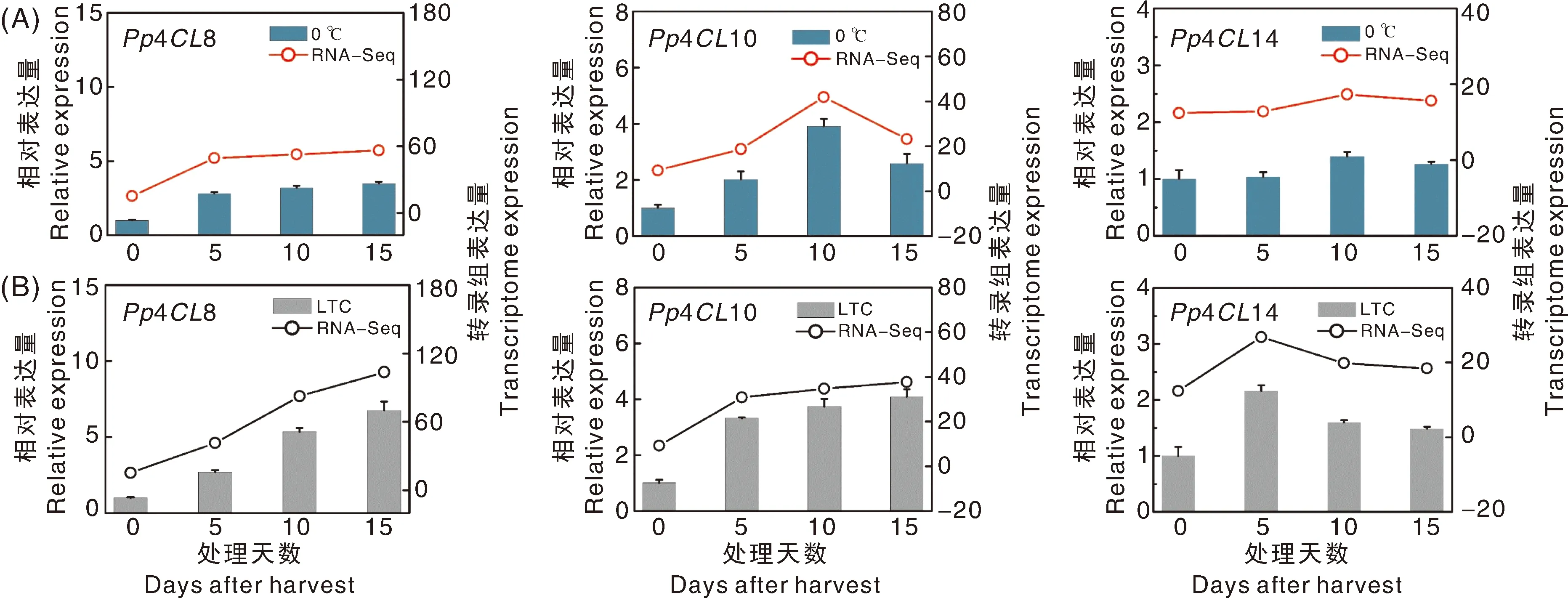
图9 qRT-PCR验证候选4CL基因在采后0 ℃(A)和LTC(B)处理中的相对表达水平
3 讨论
枇杷和竹笋等物种中的研究表明,植物遭受冷害诱导木质素沉积以提高植物抗逆能力[16-17]。周慧娟等[18]研究发现,桃果实采后低温易发生冷害,表现为果肉木质化和絮败化现象,严重影响果实品质。桃Pp4CL1和Pp4CL2分别与蓝桉Egl4CL和枇杷Ej4CL1聚类在一起。有研究表明,蓝桉Egl4CL在次生木质部组织的木质化中发挥功能[19-20],枇杷Ej4CL1在果实的冷害木质化中发挥功能[16]。我们的结果表明,低温诱导第一亚家族成员Pp4CL2表达上调,推测其可能通过加速果肉木质素积累,诱导果实发生冷害木质化。
果实色泽是影响桃商业价值的重要因素之一,一定程度上决定了顾客的选择和营养价值。桃果实色素积累主要与花青素和类胡萝卜素相关,红肉桃果实花青素含量最高;黄肉果实的花青素含量中等,其黄色主要与类胡萝卜素的积累相关;白肉果实中花青素与类胡萝卜素含量均较低而呈现乳白色[21-24]。红肉桃果实花青素主要为矢车菊素-3-葡萄糖苷及矢车菊素-3-芸香糖苷,白肉和黄肉品种仅在果皮近核部位有少量花青素[25]。Ying等[26]对不同果肉颜色的光核桃果肉转录组和代谢组联合分析发现,矢车菊素-3-芸香糖苷在红肉果实中的积累量远超黄肉和白肉品种;矢车菊素-3-葡萄糖苷在红肉桃品种中大量积累,而在白肉和黄肉桃品种中只能检测到极微量存在。对其基因表达分析发现,Pp4CL8、Pp4CL13基因在红肉品种中表达最高,黄肉和白肉桃品种中表达量较低。根据桃果实生长发育进程,可分为幼果膨大期、硬核期、果实迅速生长(细胞增大)与果实成熟期,不同桃品种花青素的积累差异主要在生长发育后期[27-28]。Pp4CL8、Pp4CL13在红肉光核桃细胞增大期和成熟期的表达水平明显高于硬核期,总体表达呈上升趋势。此外,第二亚家族Pp4CL5-Pp4CL21与类黄酮合成基因Os4CL2和At4CL3聚类在一起[5,29],表明其可能参与桃果实花青素等类黄酮合成。因此,推测Pp4CL8、Pp4CL13参与桃果实花青素等类黄酮的合成调控。
植物遭受冷害后诱导细胞内活性氧(ROS)大量积累和果肉褐变,引起脂质过氧化和DNA损伤[29-31]。类黄酮等抗氧化物质可通过清除过量ROS,从而减轻植物冷害症状[32]。研究表明,植物4CL广泛响应非生物胁迫参与类黄酮等生理进程调控[33-35]。桃4CL基因家族成员启动子中发现了大量的低温等非生物胁迫响应元件,推断其在桃果实抗冷害中起到一定的调控作用。第二亚家族成员Pp4CL8、Pp4CL10和Pp4CL14在低温处理后表达量上调,暗示上述基因可能通过加速类黄酮物质合成清除过量ROS。Wang等[15]研究表明,桃果实采后低温易发生冷害,LTC处理可减缓果实采后低温贮藏引起的冷害。LTC处理后Pp4CL8、Pp4CL10和Pp4CL14基因表达进一步上调,产生更多的抗氧化物质类黄酮,以提高对ROS的清除能力。前期研究表明,MeJA处理能够显著抑制枇杷、枸杞和桃等果实的冷害现象[36-38]。有趣的是,大部分桃4CL基因家族成员启动子上也均发现MeJA响应元件,该结果暗示4CL或也可响应MeJA处理通过调控类黄酮合成以减轻桃果实冷害。
综上,本研究对桃4CL基因家族成员进行了全基因组的鉴定,共鉴定到21个家族成员。不同品种光核桃的发育阶段4CL基因表达模式及其基因进化树分析表明,Pp4CL8和Pp4CL13可能参与桃果肉类黄酮合成。其在采后低温贮藏中的表达分析推测,Pp4CL2受采后低温诱导加速果肉冷害木质化,Pp4CL8、Pp4CL10和Pp4CL14可响应LTC处理加速类黄酮合成以减缓桃果实采后冷害。
