腹腔镜胰后入路脾脏切除术10例疗效分析
2023-12-03沙洪存郝龙戴珍珍洪晓明尹杰
沙洪存,郝龙,戴珍珍,洪晓明,尹杰
1.宁波市鄞州区第二医院 肝胆胰脾外科,浙江 宁波 315153;2.宁波大学附属人民医院 病理科,浙江宁波 315040
Delaitre和Maignien[1]于1991 年首次报道了腹腔镜脾脏切除术,随着腹腔镜技术和损伤控制理念的发展,全腹腔镜脾脏切除术(total laparoscopic splenectomy,TLS)已广泛应用于脾肿瘤、脾裂伤、脾脓肿等疾病的治疗,2008年欧洲内镜外科协会甚至将TLS作为需进行脾切除疾病治疗的金标准[2]。与传统手术相比,TLS具有微创、美观、恢复快等优势,但因脾蒂处存在宽大的血管及其各级属支,特别是门脉高压患者,脾周静脉扩张明显,易导致腹腔镜下难以控制的静脉出血,所以TLS的难点在于脾蒂的处理。笔者团队在前期大量的腹腔镜脾脏切除术的经验基础上,提出了改良的方法——腹腔镜胰腺后入路脾脏切除术,该法可以明显降低术中出血量和术后胰瘘的风险,现总结报道如下。
1 资料和方法
1.1 病例纳入与排除标准
纳入标准:(1)因各种病因引发的肝硬化性门静脉高压症、脾肿大伴脾功能亢进,且血小板数<50×109/L,肝功能为Child-Pugh A级或B级;(2)与脾脏相关的血液系统疾病经充分内科治疗后疗效不佳或无效,符合脾脏切除的手术指征;(3)脾脏恶性肿瘤,有较高破裂风险的脾良性肿瘤;(4)脾梗死继发脓肿形成;(5)心肺功能良好,可耐受微创手术。排除标准:(1)患者全身状况不能耐受手术,或伴有手术禁忌的相关疾病;(2)开腹脾脏切除术或非胰腺后入路的腹腔镜脾脏切除术;(3)脾外伤。
1.2 一般资料
本组共纳入宁波市鄞州区第二医院2019年3月至2022年7月间符合条件并实施腹腔镜胰后入路脾脏切除术的患者10 例,其中男4 例,女6 例;年龄44~80岁(中位数67岁)。本组患者中,慢性乙型肝炎后肝硬化、门静脉高压症脾功能亢进5例,其中3例有上消化道出血的病史;脾梗死伴脓肿形成1例;毛细胞白血病1例;脾血管瘤2例;脾恶性肿瘤1例。3 例患者ASA麻醉分级1 级;7 例患者合并高血压、糖尿病、肝硬化等基础性疾病,ASA麻醉分级2级。脾脏最大径11~23 cm(中位数13.5 cm),超过20 cm属于巨脾者2例。
1.3 手术方法
患者气管插管全身麻醉,气腹压13~15 mmHg(1 mmHg=0.133 kPa),仰卧“大”字位。术者立于患者右侧,一助位于左侧,扶镜助手站在患者两腿之间。采用五孔法,脐下置直径1.0 cm的Trocar,作为腹腔镜观察孔;右侧腹、右上腹分别置直径1.2 cm、0.5 cm的Trocar,右侧腹作为主操作孔;左侧腹、左上腹分别置1.2 cm、0.5 cm的Trocar。对于脾脏明显增大的病例,Trocar的位置适当向右侧偏移。30°腹腔镜经脐部观察孔进入腹腔,常规探查腹壁、腹腔及盆腔各器官。(1)离断胃结肠韧带:助手将胃大弯向头侧、大网膜向尾侧牵引,沿胃大弯血管弓外向左剪开胃结肠韧带,并游离至脾胃韧带,离断胃短血管。把胃捆扎悬吊在镰状韧带上,使得脾门和脾上极充分显露(图1)。如果患者肥胖,可以沿横结肠切除部分大网膜以增加显露。(2)游离胰腺体尾部的下缘:助手将横结肠及系膜牵向尾侧,游离脾结肠韧带,显露脾下极。主刀从胰腺下缘通过Toldts间隙向胰腺上缘游离,直至胰腺尾部与脾门完全悬空(图2),放置绕胰提拉带。(3)游离胰腺尾部与脾门间隙:从胰尾部后方贴脾包膜游离脾门与胰尾,并在脾门周围结扎数支远离脾门的脾血管分支,显露解剖胰尾部与脾脏关系,使脾蒂成一宽带血管束,用切割闭合器离断脾蒂,缝扎止血胰尾侧脾蒂断面渗血的血管。游离脾周韧带,把脾脏置入标本袋,在标本袋内剪开脾静脉排出脾内积血,使脾脏体积缩小,在脐部适当延长切口取出标本。如果标本体积巨大,良性的病变可以分段取出或钳碎取出。所有患者常规放置脾窝引流管。
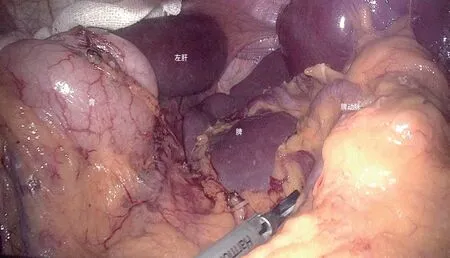
图1 胃悬吊后脾上极充分显露
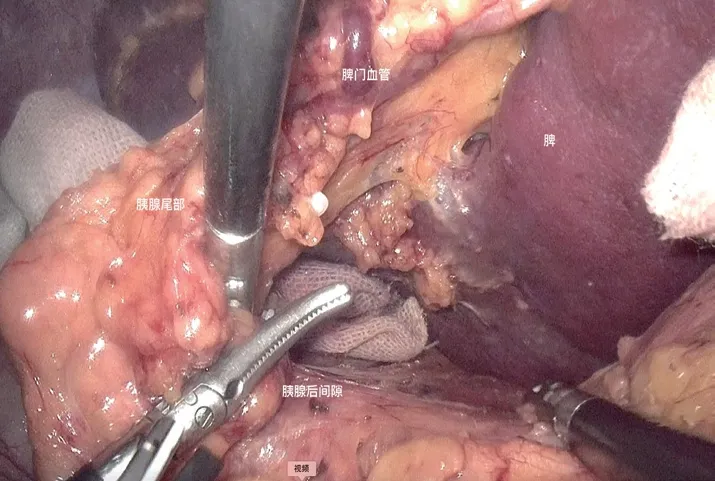
图2 胰腺尾部与脾门完全悬空
1.4 观察指标
术前检查:脾脏大小;术中情况:术中出血量,手术时间;术后情况:术后第1 天引流液淀粉酶量,术后并发症,术后住院时间。胰瘘定义为术后≥3 d,腹腔引流液淀粉酶值大于血清淀粉酶正常值上限的3倍。
1.5 随访
采用门诊和电话方式随访,患者定期复查血常规、腹部超声等,截止时间2022年9月。
2 结果
本组10例患者全部顺利施行腹腔镜胰后入路脾脏切除术,无中转开腹病例。其中3例行脾切除+断流手术,7例行脾切除手术;手术时间130~310 min(中位数190 min);术中出血量50~400 mL(中位数100 mL);无术中并发症发生,无中转开腹病例。术后第1天腹腔引流液淀粉酶值23~1 664 U/L(中位数197 U/L),到第3天淀粉酶水平基本恢复正常。腹腔镜胰后入路脾脏切除术后发生并发症2例,1例脾脏切除后出现乳糜漏,1例脾脏切除+门奇静脉断流术后出现门静脉血栓,均是肝硬化患者,均经保守治疗痊愈。无胰瘘发生。术后住院时间5~28 d(中位数8 d)。10例患者均获随访,随访2~41个月(中位时间25个月),均生存。
3 讨论
传统的腹腔镜脾脏切除术采用先结扎脾动脉、再游离脾周韧带来显露脾门,然后用一级或二级脾蒂法断脾蒂[3-4]。脾脏质地脆易损伤,脾门血管细密,位置深在,有胰腺尾部遮挡,腹腔镜下显露困难,难以形成有效牵张,出血不易控制。另外,传统的腹腔镜脾脏切除术也容易损伤胰腺尾部,导致术后胰漏及脾热的发生[5]。本组手术流程的设计基于胰腺体尾部肿瘤切除技术、脾脏切除技术以及对脾门解剖结构研究认识的积累,充分结合腹腔镜技术的特点,选取胰后间隙为手术入路。
胰腺后方的Toldts间隙是一个无血的间隙,易于游离,向左侧拓展可及脾门,向头侧拓展可及胰腺上缘。游离此间隙,非常容易显露胰腺尾部和脾门,这个操作过程几乎不会有术中的出血;胰腺尾部与脾门完全贯通后,放置的绕胰提拉带既有牵拉作用,又有出血时候的阻断作用,可以替代传统腹腔镜脾脏切除术脾动脉主干结扎的步骤。另外,手术流程的设计把游离脾肾韧带、脾膈韧带需要搬动脾脏的步骤放在离断脾蒂后,减少了术中脾脏破裂出血的可能性。本组病例术中出血量50~400 mL,出血量较常规方式的腹腔镜脾切除术要少[3,6]。由于充分游离了胰腺尾部与脾门的粘连,使得术中几乎没有损伤胰腺的可能,术后引流液量少,术后第1天引流液淀粉酶23~1 664 U/L,术后第3天基本恢复正常,没有胰漏发生。而且术后住院时间也比传统腹腔镜手术要短[6]。
腹腔镜脾脏切除术治疗巨脾仍存在较大的争议[2,7],主要原因在于巨脾会严重干扰手术视野,如果患者合并脾周曲张静脉更是增加了术中大出血的风险。国内外相关的学者们正在努力探索腹腔镜脾脏切除术治疗巨脾的临床效果[8-9]。本组病例中,5例脾功能亢进患者脾脏最大径13~23 cm,其中2例>20 cm,符合巨脾的标准,这2例患者均行脾切除+断流手术,术中穿刺孔的位置略向右侧偏移,增大的脾脏导致脾门右移,胰腺尾部往往紧贴在脾门的后方,术中需要细致游离胰腺尾部与脾门的间隙,充分暴露脾蒂后再用切割闭合器离断。5例患者术中出血量少,术后第3天引流液淀粉酶值回归正常,术后1例出现乳糜漏,1例出现门静脉血栓,保守治疗后痊愈,取得了较好的效果。
总之,腹腔镜胰后入路游离胰腺体尾部使脾门的位置变浅,更有利于手术的操作,可以降低脾脏切除手术的难度,减少术中出血量和胰腺尾部损伤风险。不强调预先结扎脾动脉,把脾周韧带的游离步骤放在断脾蒂后,可以减少术中出血的风险。腹腔镜胰后入路脾脏切除术是安全、可行的。本组病例数较少,结论有待更进一步的大样本临床研究。
