酪蛋白肽锌螯合物的制备及体外消化分析
2023-12-03周桂成王际辉
周桂成,肖 珊,王 波, ,王际辉,
(1.大连工业大学生物工程学院,辽宁大连 116034;2.东莞理工学院生命健康技术学院,广东东莞 523808)
锌在人体内起着维持机体免疫功能和正常生长发育的作用,同时也是1000 多种蛋白质结构和功能调节的辅因子[1]。由于人体内没有有效且可靠的锌存储位点,摄入足够的锌是维持体内锌平衡的关键[2]。机体获取锌的途径主要包括日常饮食摄入和口服锌补充剂两种形式。然而,膳食锌在人体的吸收效率较低,食物基质中的成分,例如植酸、多酚、皂苷和纤维素等在胃肠中与锌发生结合会形成难溶的复合物[3],阻碍锌的吸收和利用。同时,食物中的矿物质,如铁、钙、铜离子会竞争部分非特定金属离子转运体和载体蛋白,抑制机体对锌的吸收。因此,开发高效补锌剂对改善人体锌营养状况具有现实意义。目前,补锌剂主要分为无机锌盐、有机弱酸锌、氨基酸锌和以肽作为配体的补锌剂等四类。然而在实际应用中,无机盐补锌剂会改变食物的理化和感官性质,引起人体胃肠道不适[4];有机弱酸锌制备工艺复杂、且易与其他营养素发生拮抗,不宜长期摄入[5];氨基酸锌具有良好的稳定性,但其锌含量较低,较难满足机体日常需要。目前,以肽作为配体的补锌剂因其安全可靠、锌利用率高等优点,具有成为高效可靠锌补充剂的潜力[6]。
酪蛋白是乳中含量最高的蛋白质,同时也是生物活性多肽的重要来源[7-8]。酪蛋白肽能够与矿物质结合,促进微量元素在人体中的高效吸收。近年来,许多学者利用不同的食源性生物活性肽,如蛋清肽[9]、牡蛎肽[10]、南瓜种子肽[11]等,制备出稳定可溶的肽锌螯合物。然而,肽锌螯合物在人体内的消化和吸收是一个复杂的过程,不同的肽锌螯合物之间由于分子量[12]、电荷性质[13]、疏水性[11]、氨基酸组成等差异,其稳定性和生物利用率也不同。需要对更多来源的多肽进行开发,寻找更安全、高效和稳定的锌配体,满足人们日常对锌的需要。
实验室前期研究发现,利用碱性蛋白酶水解酪蛋白得到的多肽具备一定的锌螯合能力,但是其肽锌螯合物的胃肠消化稳定性较低。在此基础上,利用乳酸菌发酵对酶解法进行进一步补充[14],制备了更多潜在的、具备优异锌螯合特性和消化稳定性的多肽。本研究利用酪蛋白为原料,通过碱性蛋白酶酶解与乳酸菌发酵结合的方式获得具有高效锌螯合能力的多肽,与七水合硫酸锌反应制备肽锌螯合物,并对其结构进行表征;通过模拟体外消化,探讨酪蛋白肽锌螯合物在消化过程中的锌溶解性和抗氧化性的变化,对胃肠消化产物进行圆二色谱测定,分析肽锌螯合物在消化过程中的二级结构变化。为推动酪蛋白肽的利用与酪蛋白肽锌螯合物的开发提供理论支持。
1 材料与方法
1.1 材料与仪器
MRS 肉汤培养基 广东环凯微生物科技有限公司;酪蛋白 生物试剂级、七水合硫酸锌 分析纯,上海源叶生物科技有限公司;碱性蛋白酶(1:200000)北京索莱宝生物科技有限公司;4-(2-pyridylazo) resorcinol(PAR)、HEPES-KOH 缓冲液(pH7.9)、硼酸钠、十二烷基硫酸钠、邻苯二甲醛、1,1-二苯基-2-三硝基苯肼(DPPH)、谷胱甘肽(GSH)、4,4'-二(1H-1,2,4-三 唑-1-基)-1,1'-联 苯(TPTZ)均为分析纯,上海阿拉丁公司;胃蛋白酶P7000、胰液素P1750 美国Sigma 公司;血锌浓度试剂盒 南京建成科技有限公司;邻苯二甲醛、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)分析纯,上海麦克林生物科技有限公司;其他试剂均为分析纯;所有实验用水均为去离子水;植物乳杆菌(Lactobacillus plantarum) LPA 和LPB 是实验室先前从西兰花中筛选得到的两株具有高发酵能力的乳酸菌;Caco-2 细胞 中国科学院。
Chiracan V100 圆二色光谱仪 英国Applied Photophysics 公司;Nicolet IS50 显微红外光谱系统、Easy-nano 1200 色谱仪器、Q Exactive Plus 质谱仪器、EVOLUTION 220 紫外可见光谱仪 美国Thermo公司;F7100 荧光光谱仪 日本日立公司;Spark 多功能微孔板检测仪 瑞士Tecan 公司;EM-30 Plus超高分辨率扫描电镜 韩国Coxem 公司;ZS90 马尔文纳米激光粒度仪 英国马尔文帕纳科公司。
1.2 实验方法
1.2.1 菌种培养及锌螯合肽的制备 植物乳酸菌LPA 和LPB 在MRS 培养基上37 ℃连续培养(3 代×24 h)。6000×g 下离心5 min,使菌种悬浮在无菌盐水(0.9%)中。在20 mL 酪蛋白培养基(5%,w/v)中加入0.15%的碱性蛋白酶,酶解2 h,调节pH 至6.5,按3%的接种量(v/v)加入植物乳酸菌,在37 ℃条件下发酵12 h。然后,对不同的发酵条件进行优化,固定发酵条件为酶解pH7、碱性蛋白酶添加量0.15%,以不同发酵时间(6、8、10、12、14、16 h)分别进行酶解与发酵;固定发酵条件为酶解pH 为7、发酵时间为12 h 以不同碱性蛋白酶添加量(0、0.15%、0.30%、0.45%、0.60%、0.75%)分别进行酶解与发酵;固定发酵条件为发酵时间为12 h、0.30%碱性蛋白酶添加量,以不同初始的酶解pH(5、6、7、8、9、10)分别进行酶解与发酵。发酵产物用1 mol/L HCl调节pH 至4.6,在6000×g,4 ℃条件下离心10 min,取上清液,用1 mol/L NaOH 调节pH 至7.0,离心收集上清液冷冻干燥并储存在-80 ℃中备用。
1.2.2 锌螯合能力测定 根据Zhu 等[15]的方法,将1.2.1 中得到的发酵产物在40 mmol/L HEPESKOH 缓冲液(pH7.5)中重新溶解,与ZnSO4·7H2O(250 μmol/L)以49:1 的比例充分混合,在37 ℃水浴中反应10 min。然后加入200 μL 2 mmol/L 4-(2-pyridylazo)resorcinol(PAR),以HEPES-KOH 缓冲液为空白,在波长500 nm 下测定吸光值。锌螯合率计算公式为:
1.2.3 多肽含量的测定 多肽含量的测定参考Spellman 等[16]的方法,将100 mL 硼酸钠(0.1 mol/L)和10 mL 20%(w/v)十二烷基硫酸钠混合均匀,搅拌至沉淀消失。取160 mg 邻苯二甲醛溶于4 mL 乙醇,转移到上述溶液中。加入400 μL 巯基乙醇,用去离子水定容至200 mL。取200 μL 1.2.1 中得到的发酵产物与3 mL 邻苯二甲醛工作液充分混匀,室温下避光孵育2 min,测量340 nm 处的吸光值。取不同浓度的DL-丝氨酸绘制标准曲线,样品结果以每克样品的丝氨酸毫克当量表示。
1.2.4 肽锌螯合物的制备 10 mL 酪蛋白肽(10 mg/mL)与硫酸锌(锌螯合肽:硫酸锌质量比为1:1)混合,将反应混合物的pH 调节至6.0,50 ℃条件下反应1 h,随后将混合物转移到冰水浴中迅速冷却,加入无水乙醇(1:4,v/v)并静置,在8000 r/min 条件下离心10 min,收集沉淀冷冻干燥得到肽锌螯合物。
1.2.5 扫描电镜 取一定量的酪蛋白肽及肽锌螯合物粉末于感电胶上,进行喷金处理后,利用COXEM扫描电镜进行观察,其中,加速电压为3 kV,放大倍数为:×1.0 k。
1.2.6 红外光谱 使用Nicolet IS50 显微红外光谱系统,在4000~675 cm-1范围内对酪蛋白肽及肽锌螯合物冻干粉进行扫描,选择模式为透射模式,采用冷却后检测器进行检测。
1.2.7 Zeta 电位测定 将酪蛋白肽和肽锌螯合物溶于去离子水,配制成1 mg/mL 溶液,平衡120 s,采用马尔文激光粒度仪测定Zeta 电位。
1.2.8 荧光光谱 使用日立公司的F-7100 荧光分光光度计,对酪蛋白肽螯合锌离子后的荧光特性进行分析。在酪蛋白肽溶液(5 mg/mL)中加入不同浓度(1、2、4、6、8 和10 mmol/L)的硫酸锌溶液反应30 min。采用扫描模式,在激发波长为280 nm 和发射波长为300~500 nm 的条件下进行扫描。
1.2.9 抗氧化性测定
1.2.9.1 DPPH 自由基清除率 根据文献[17]报道的方法,取一定量酪蛋白肽及肽锌螯合物溶于去离子水,配制成不同浓度溶液(0.5、1.0、1.5、2.0、2.5 mg/mL),取2 mL 0.1 mmol/L DPPH 溶液与样品溶液充分混合,于517 nm 处测吸光值。以还原型谷胱甘肽作为阳性对照。取2 mL 95% 乙醇和2 mL 样品混合反应作为对照组,取2 mL 95%乙醇样品和2 mL DPPH 溶液混合反应作为空白组,对DPPH 自由基的清除率用以下公式计算:
1.2.9.2 ABTS+自由基清除率 根据文献[18]报道的方法,将ABTS 溶液(7 mmol/L)和过硫酸钾溶液(2.45 mmol/L)混合,在室温避光放置16 h,得到ABTS 母液。随后对ABTS 母液稀释,使其在734 nm处的吸光值为0.70±0.02。将0.5 mL 不同浓度(0.02、0.04、0.06、0.08 和0.10 mg/mL)的样品溶液和3 mL的ABTS 稀释液混合,在室温避光反应5 min。然后测量734 nm 处的吸光值。以还原型谷胱甘肽作为阳性对照,空白组用去离子水代替样品。ABTS+自由基清除率计算如下:
1.2.9.3 铁还原力的测定 根据文献[19]报道的方法,将30 mL TPTZ 溶液(10 mmol/L)与30 mL FeCl3溶液(20 mmol/L)充分混合,加入300 mL 醋酸盐缓冲液(0.1 mol/L,pH3.6)进行稀释得到TPTZ 工作液。将100 μL 不同浓度样品溶液(1.0、2.0、3.0、4.0、5.0 mg/mL)与 3 mL TPTZ 工作液在 37 ℃下混合30 min,在593 nm 处测量吸光值。以不同浓度Trolox 标准品制作标准曲线,以还原型谷胱甘肽作为阳性对照,结果表示为 Trolox 当量(mmol Trolox/L)。
1.2.10 模拟胃肠道消化 将肽锌螯合物、硫酸锌分别溶解于去离子水(1 mg/mL)中,调节pH 至2.0,37 ℃孵育5 min 后,按1:35(w/w)的酶底物比加入胃蛋白酶(≥250 units/mg solid)消化2 h。胃消化完成后,用饱和NaHCO3调pH 至6.8,1:25(w/w)加入胰酶(4×USP),继续用1 mol/L NaOH 调节至pH7.5后消化2 h。分别在体外消化0、15、30、60、120、135、150、180 和240 min 时取一定量样品,沸水浴10 min 灭酶后进行测试。抗氧化活性的测定按照1.2.9的方法进行。根据Xie 等[20]的方法计算抗氧化活性残留率,抗氧化活性残留率表示为:
1.2.11 锌溶解度测定 取等量不同消化时间的胃肠道消化液在8000×g 下离心10 min。收集上清液,根据血锌浓度试剂盒的方法测定锌含量。肽锌螯合物总锌含量测定,取50 mg 肽锌螯合物溶解在6 mol/L盐酸中,120 ℃消化4 h,真空干燥除去其中的盐酸,用去离子水定容到5 mL,利用血锌浓度试剂盒的方法测定锌含量。锌的溶解度计算如下:
1.2.12 圆二色光谱 酪蛋白肽及肽锌螯合物溶于去离子水(0.25 mg/mL)中,然后用圆二色谱仪(CD)在190~260 nm 之间进行扫描,使用以下仪器参数:带宽1.0 nm,扫描速度100 nm/min。每个获取的光谱代表平均三次连续扫描。采用CDNN 软件进行二级结构分析。
1.2.13 细胞毒性实验 根据文献[21]报道的方法,取1.2.10 中的消化样品溶于含10%血清的DMEM培养基中。待Caco-2 细胞融合度达到约80%后,弃去培养基,用PBS 洗涤Caco-2 细胞两次后利用胰酶进行消化得到细胞悬液。将细胞以2.5×104个/孔的密度接种于96 孔细胞培养板中,在37 ℃二氧化碳培养箱中孵育24 h 后弃去培养基,每孔分别加入200 µL 不同浓度酪蛋白肽和肽锌螯合物胃肠消化产物(0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45 和0.50 mg/mL),每个样品设置6 个平行孔。继续孵育24 h 后弃去样品,每孔加入100 µL 5 mg/mL MTT。孵育4 h 后弃去MTT,每孔加入200 µL 二甲基亚砜,细胞培养板低速摇动10 min。用酶标仪在570 nm 处测定吸光值。以含培养基而不含细胞组作为空白组,以等量含10%血清的DMEM 培养基代替样品组作为对照组,细胞存活率计算如下:
1.2.14 液相色谱串联质谱分析
1.2.1 4.1 样品准备 将1.2.4 中得到的酪蛋白肽与肽锌螯合物以1 mg/mL 浓度在去离子水中溶解并进行质谱检测。
1.2.1 4.2 液相色谱条件 分离柱:75 μm×200 mm(C18,1.9 μm 粒径,120 Å孔径);色谱分离时间:60 min,A:0.1% 甲酸水溶液,B:80%乙腈;流速:200 nL/min,
梯度洗脱梯度:在0~45 min 内,B:3%~32%;在45~55 min 内,B:32%~100%;在55~60 min 内,B:100%~100%。
1.2.1 4.3 质谱条件 扫描范围200~2000 Da;分辨率70000;最大离子注入时间100 ms;MS/MS 离子注入时间75 ms。
1.2.1 4.4 数据分析 使用ProteinDiscovery 2.4.0(美国Thermo Scientific 公司)进行数据分析。基于Uni-Prot 数据库,得到准确的多肽分子量和氨基酸序列。
1.3 数据处理
每组实验数据至少测定三次,计算平均值和误差值,并采用SPSS 26.0 软件进行显著性分析,用Origin 2018 软件作图。
2 结果与分析
2.1 发酵条件的优化
利用实验室筛选的两株具有高发酵能力的植物乳杆菌对酪蛋白进行发酵,结果如图1 所示,通过碱性蛋白酶预处理与植物乳杆菌发酵相结合的方式获取的酪蛋白肽对锌离子的螯合率分别为17.63%±0.83%和15.17%±0.81%,均高于其单菌发酵组(12.07%±0.53%和13.63%±0.13%)或单酶处理组(8.69%±0.53%)。碱性蛋白酶与植物乳杆菌LPA 共同作用制备的酪蛋白肽具有更优的锌螯合能力。在植物乳杆菌的作用下,酪蛋白更容易被水解释放出大量的生物活性肽[22];利用碱性蛋白酶预酶解,有利于缩短发酵的过程[23],减少发酵过程中被污染的可能性。因此,选择碱性蛋白酶与植物乳杆菌LPA 的发酵组合对后续发酵条件进行优化。

图1 不同制备条件对酪蛋白肽锌螯合率及多肽含量的影响Fig.1 Effect of different preparation conditions on zinc chelation rate and peptide content of casein peptides
如图1B 所示,随着发酵时间的增加,酪蛋白肽对锌的螯合率下降。发酵初始阶段,酪蛋白肽水解程度较低,较长的肽段可能更有利于锌离子的结合。在8~12 h 阶段酪蛋白肽的多肽含量和锌螯合能力逐渐增加,在12 h 时酪蛋白肽的锌螯合能力达到最高,为18.36%±0.55%。在这一阶段,多肽在微生物作用下释放出更多能结合Zn2+的活性基团。随着水解程度的增加,部分锌螯合位点被破坏,水解产物的锌螯合率逐渐降低[24]。对不同酶添加量下酪蛋白发酵产物进行分析,酶处理组多肽含量与锌螯合率均高于无酶组,酶的加入促进了锌螯合多肽的形成。在碱性蛋白酶的作用下,酪蛋白肽部分关键位点被暴露出来,无酶组中难以利用的部分变得可以利用[25]。在酶加入量为0.3%时,酪蛋白肽锌螯合率达到最高(25.16%±1.74%)。对不同酶解初始pH 下酪蛋白发酵产物进行分析,在酶解初始pH 为9 时,酪蛋白肽具有最高的锌螯合能力31.41%±0.97%。碱性条件有利于酪蛋白的酶解并为后续发酵阶段提供更多的水解产物[26],提高乳酸菌对酪蛋白的利用率。根据上述实验,确定最优的发酵组合为乳酸杆菌A 与碱性蛋白酶共同发酵,最佳的发酵条件为酶解pH9、碱性蛋白酶添加量为0.3%(w/v)、乳酸菌发酵时间为12 h 并以此作为后续制备酪蛋白肽的发酵条件。
2.2 肽锌螯合物结构表征
2.2.1 扫描电子显微镜 扫描电子显微镜(SEM)是观察多肽形貌特征的有效工具。图2A 和图2B 分别显示了酪蛋白肽和酪蛋白肽锌螯合物的表面形态。酪蛋白肽显示出表面光滑的片状,与锌螯合后呈粗糙疏松颗粒状结构,与Zhang 等[27]观察到的现象相似。肽锌螯合物在形成过程中,微观结构发生了变化,锌的存在破坏了多肽表面原本致密的结构,酪蛋白肽的空间构象发生改变并重新排列[11],形成更疏松的结构。同时,多肽氨基酸残基上部分亲水基团被Zn2+屏蔽[28],使多肽趋向于聚集状态。因此,锌离子的螯合显著改变了酪蛋白肽的微观结构。

图2 酪蛋白肽和肽锌螯合物SEM 图(×1.0 k)Fig.2 SEM images of casein peptide and peptide-zinc chelate(×1.0 k)
2.2.2 傅里叶变换红外光谱 酪蛋白肽在1400.66、1556.00、1648.41、2954.03 和3284.54 cm-1的红外范围内出现了红外峰,分别对应于蛋白质结构中的酰胺III、II、I 和酰胺B 和A 带。如图3 所示,Zn2+加入后,多肽的红外光谱发生了显著变化。肽锌螯合物的NH 带出现在3254.50 cm-1处,可能是Zn2+的加入引起-NH 伸缩振动和氢键的取代[28]。在2939.29 cm-1处有一个肽锌螯合物-CH2基团的伸缩振动。在添加Zn2+之后,酪蛋白肽1648.41 和1556.00 cm-1处的峰移至较低的频率(1641.04 和1535.59 cm-1),表明Zn2+与NH 发生了结合[29]。在1400.66 cm-1处观察到酰胺III 带的变化,这是由C-N 伸缩振动、NH 变形和-CH2基团的振动形成的[27,30]。肽锌螯合物在978.30 cm-1处的峰消失,Zn2+的作用可能会导致一些较弱的吸收带被屏蔽[15]。推测酪蛋白肽主要通过多肽键上的羧基氧、羟基氧、氨基参与Zn2+的配位形成多肽锌螯合物。Zn2+与酪蛋白肽螯合并引起多肽结构的改变。

图3 酪蛋白肽和肽锌螯合物FTIR 图Fig.3 FIRT diagram of casein peptide and peptide-zinc chelate
2.2.3 Zeta 电位分析 酪蛋白肽和肽锌螯合物的Zeta 电位如图4 所示。Zeta 电位是反映分散体系中粒子的表面电荷状态的重要指标。酪蛋白肽的Zeta 电位为-12.76±0.46 mV,在与锌离子螯合后,肽锌螯合物的Zeta 电位为-6.84±0.67 mV,发生了极显著变化(P<0.001),Zn2+的加入导致了酪蛋白肽Zeta电位值上升。
2.2.4 荧光光谱分析 如图5 所示,当荧光激发波长为280 nm 时,观察到酪蛋白肽在356 nm 处出现吸收峰,随着Zn2+浓度的增加(1、2、4、6、8、10 mmol/L),酪蛋白肽荧光吸收峰强度逐渐降低且当Zn2+浓度超过4 mmol/L 时,荧光猝灭幅度减弱。在引入Zn2+后,多肽的空间结构发生折叠[31],导致荧光强度下降。同时,随着Zn2+浓度增加,酪蛋白肽的荧光猝灭幅度逐渐减弱。这可能是在螯合过程中,酪蛋白肽对Zn2+的螯合逐渐达到饱和[32],酪蛋白肽的结构变化减缓。因此,Zn2+能与酪蛋白肽上的活性基团进行结合并形成可溶性肽锌螯合物。同时,酪蛋白肽的Zn2+结合位点是有限的。

图5 不同浓度的Zn2+肽锌螯合物的荧光光谱图Fig.5 Fluorescence spectra of peptide-zinc chelate at different concentrations of Zn2+
2.2.5 肽锌螯合物体外抗氧化性 多肽的金属结合活性与抗氧化能力相关[33],与金属离子结合后,多肽的抗氧化活性降低。本研究通过测定DPPH 的自由基清除能力、ABTS+自由基清除能力和铁离子还原能力,全面系统地对肽锌螯合物的抗氧化活性进行评价。如图6A 所示,酪蛋白肽对DPPH 自由基的清除能力表现出明显的剂量效应,在浓度为2.5 mg/mL时增加到69.51%±0.82%。同一浓度下肽锌螯合物的DPPH 自由基的清除能力为45.55%±0.66%。在与锌螯合后,酪蛋白肽仍然保留着一定的抗氧化能力。

图6 酪蛋白肽和肽锌螯合物抗氧化性测定Fig.6 Determination of antioxidant properties of casein peptide and peptide-zinc chelate
同时,酪蛋白肽和肽锌螯合物都显示出ABTS+自由基清除能力。如图6B 所示,在0.02~0.10 mg/mL浓度范围内随着浓度的增加,酪蛋白肽和肽锌螯合物的ABTS+自由基清除能力逐渐提高,且在0.10 mg/mL时酪蛋白肽对ABTS+自由基清除能力达到57.90%±0.78%,肽锌螯合物对ABTS+自由基清除能力则为21.68%±1.64%。对其铁离子还原能力进行对比,在浓度为5 mg/mL 时,酪蛋白肽和肽锌螯合物的铁离子还原能力分别为0.256±0.003 μmol Trolox/mL 和0.10±0.005 μmol Trolox/mL。相同浓度条件下,酪蛋白肽具有更好的抗氧化活性,锌的加入导致多肽发生聚集,在一定程度上阻碍了多肽的活性部位,肽锌螯合物的抗氧化活性降低。
2.3 肽锌螯合物体外模拟消化
对体外模拟消化过程中肽锌螯合物锌的溶解度及其抗氧化活性残留率进行研究。结果如图7 所示。在胃消化阶段,肽锌螯合物与硫酸锌的溶解度都在85%以上。进入肠道消化阶段后,两者溶解度出现了极显著(P<0.001)差异,硫酸锌的溶解度下降至2.67%±1.50%,这可能是肠消化阶段偏弱碱性的pH环境导致Zn2+解离并形成沉淀[34]。而肽锌螯合物锌溶解度在120 min 时仍然在54.25%±1.20%,并随着消化的进行最终稳定在43.06%±2.15%。对于肠吸收而言,大多数矿物质的生物利用率主要取决于它的溶解度。以肽作为配体的锌补充剂,有利于维持锌在胃肠道消化中的溶解度[35]。在本研究中,利用碱性蛋白酶与植物乳杆菌LPA 共同作用制备酪蛋白肽,其肽锌螯合物在胃肠道消化阶段具有很好的溶解性,这对于人体肠道对锌的吸收是有利的。

图7 消化过程中肽锌螯合物和硫酸锌中锌离子溶解率(A)和酪蛋白肽锌螯合物抗氧化活性残留率(B)Fig.7 Rate of zinc dissolution of peptide-zinc chelate and zinc sulfate during digestion (A) and remaining ratios of antioxidant activity of casein peptide-zinc chelate (B)
如图7B 所示,在消化过程中,酪蛋白肽和肽锌螯合物的抗氧化活性逐渐增强。酪蛋白肽的ABTS+自由基清除能力在胃消化阶段增加了26.19%±1.68%,在肠消化阶段增加了69.05%±6.23%;DPPH 自由基清除能力在胃消化阶段时增加5.35%±3.58%,肠消化阶段时增加21.34%±4.53%,而肽锌螯合物的DPPH自由基清除能力和ABTS+自由基清除能力在胃消化阶段时分别增加了11.72%±2.95%和39.25%±3.24%,在肠消化阶段则增加了26.19%±3.30%和71.96%±7.06%。在胃蛋白酶和胰酶作用下,酪蛋白肽会进一步被水解为更小的片段,抗氧化活性也随之改变[36]。消化过程中肽锌螯合物的抗氧化能力极显著提高(P<0.001),这可能与肽锌螯合物结构的变化相关,胃肠消化环境有利于其抗氧化能力的重新释放。
然而,酪蛋白肽和肽锌螯合物的铁还原力在消化过程中有所下降,在胃消化阶段酪蛋白肽铁还原力抗氧化活性残留率为82.76%±1.49%,低于肽锌螯合物的铁还原力抗氧化活性残留率(89.70%±2.69%)。在肠消化阶段,两者的铁还原力抗氧化活性残留率分别下降了43.95%±0.59%和36.26%±2.80%。这可能是胃肠消化过程中部分疏水性氨基酸失去活性,导致酪蛋白肽和肽锌螯合物的铁还原力下降[27]。
2.4 肽锌螯合物二级结构分析
对Zn2+螯合前后多肽的圆二特性变化进行分析,研究酪蛋白肽与锌螯合过程中二级结构的变化[37]。结果如图8 所示,酪蛋白肽和肽锌螯合物在198 nm处均出现最小值。与锌螯合后,肽锌螯合物的圆二光谱峰减弱。通过CDNN 软件对肽锌螯合物二级结构进行分析,计算出酪蛋白肽的α-螺旋、β-转角、β-折叠和无规则卷曲含量分别为5.6%、19.5%、39.9%和34.2%,在螯合后分别变为5.9%、18.1%、46.3%和31.5%。结果表明,在Zn2+作用下部分β-转角与无规则卷曲转化为β-折叠。Zn2+的加入有利于诱导肽锌螯合物折叠结构的形成。在消化过程中,酪蛋白肽和肽锌螯合物的二级结构发生了变化。简单来说,酪蛋白肽和肽锌螯合物的β-转角与无规则卷曲结构减少,β-转角结构在消化结束后分别降低了2.1%和0.9%,这可能与β-转角在消化过程中的降解有关[36]。在胃消化阶段,肽锌螯合物的无规则卷曲结构减少,无规则卷曲的变化幅度(1.1%)小于酪蛋白肽无规则卷曲的幅度(2.7%),酪蛋白肽和肽锌螯合物的β-折叠的含量分别增加到46.4%和49.2%。受胃消化环境的影响,H+与Zn2+会竞争给电子基,导致肽锌螯合物中的锌发生部分解离[37],然而本研究中多肽有序的结构却被保留了下来。在肠道消化阶段,β-折叠结构含量增加,说明消化过程中肽锌螯合物结构变得更加致密有序。与酪蛋白肽相比,肽锌螯合物在胃肠道消化过程中的二级结构变化幅度较小,Zn2+的加入在一定程度上维持了在消化过程中多肽的二级结构。
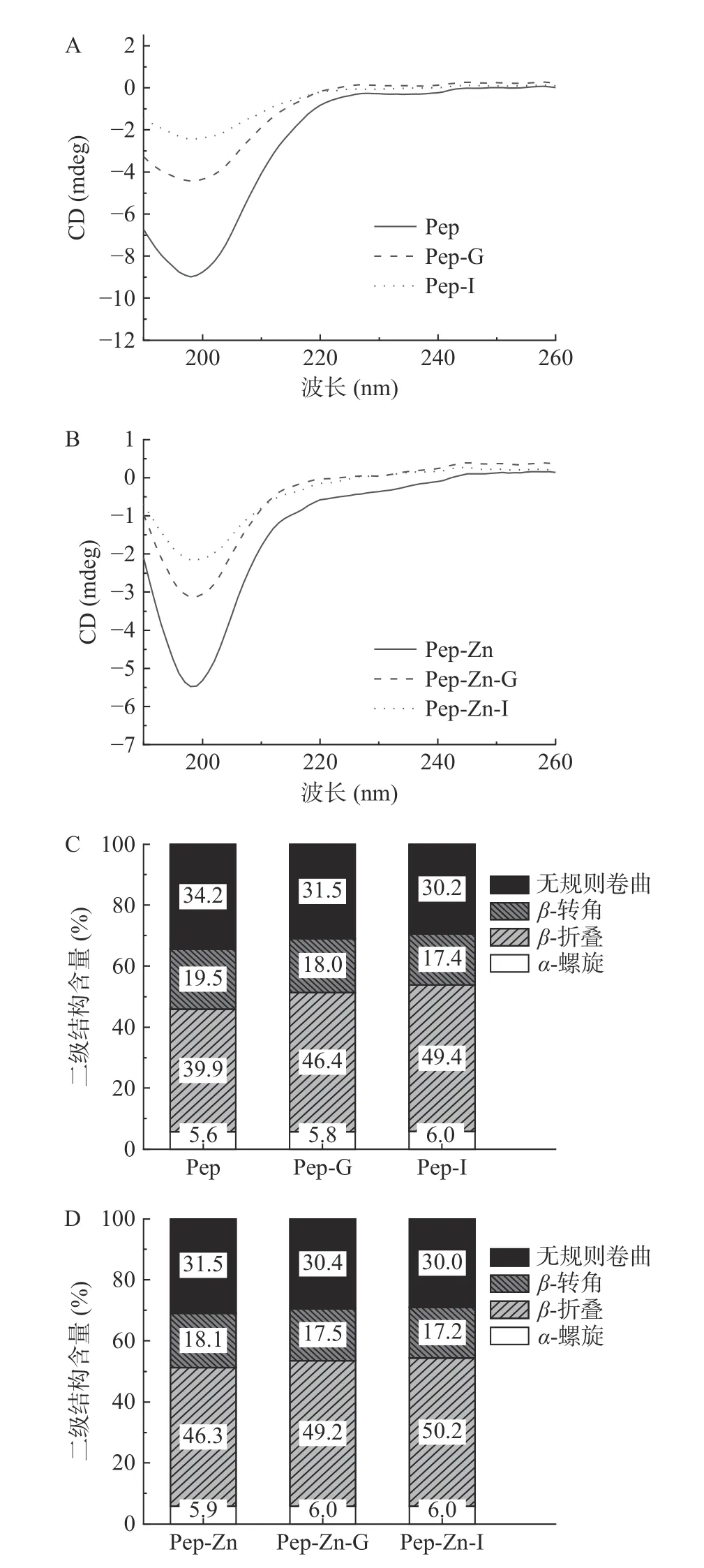
图8 酪蛋白肽和肽锌螯合物圆二色谱Fig.8 Circular dichroism of casein peptide and peptide zinc chelate
2.5 酪蛋白肽及肽锌螯合物消化产物细胞毒性实验
如图9 所示,在0.05~0.50 mg/mL 范围内,酪蛋白肽胃肠消化产物对Caco-2 细胞的生长具有促进作用。肽锌螯合物胃肠消化产物在低浓度时对细胞有增殖活性,在浓度为0.05 mg/mL 时,细胞存活率为130.02%±3.42%;当浓度超过0.4 mg/mL 后,Caco-2细胞活力降低,在0.5 mg/mL 时仅为40.91%±1.05%。倒置显微镜下对Caco-2 细胞进行观察(图10),当肽锌螯合物胃肠消化产物达到一定浓度后,细胞形态发生改变,细胞数目减少。许多研究表明,锌与细胞的凋亡相关[38],当外源锌环境发生改变时,细胞氧化应激也会发生改变、生长受到抑制[39]。

图9 不同浓度的酪蛋白肽和肽锌螯合物胃肠消化产物对Caco-2 细胞存活率的影响Fig.9 Effects of casein peptides gastrointestinal digestion and zinc-peptide chelates gastrointestinal digestion products at different concentrations on the viability of Caco-2 cells
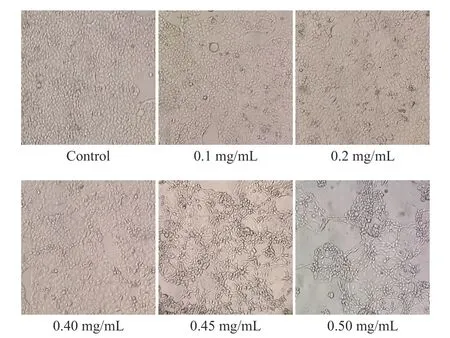
图10 不同浓度肽锌螯合物胃肠消化产物对Caco-2 细胞的影响Fig.10 Effects of zinc-peptide chelates gastrointestinal digestion products with different concentration on Caco-2 cells
2.6 锌螯合肽的鉴定
利用质谱对酪蛋白水解物和肽锌螯合物进行鉴定,鉴定出来自牛源的多肽分别为15 种和13 种,氨基酸序列如表1 所示,鉴定得到的肽分子量均小于3000 Da。有研究报道[40],低分子量肽(<3000 Da)和高分子量肽(>10000 Da)的金属螯合能力相对较高。此外,也有研究表明,Zn2+与食源性多肽C 端羧基、N 端氨基、羰基、酰胺键以及氨基酸Asp、Glu、Cys 和His 等通过共价键或静电作用进行螯合物[41],Gln 和Lys 是促进金属螯合的重要部位。Ser 的侧链羟基被认为在多肽锌的螯合中起着重要的作用[42],Cys 的巯基,Lys 的羧酸基、多肽亚氨基(NH)和羰基(C=O)可以参与锌的配位[43]。Glu 残基的侧链羧酸基也是锌结合的重要位点[11]。本研究中鉴定的多肽序列中包含许多能对锌螯合起重要贡献的氨基酸。

表1 酪蛋白水解物和肽锌螯合物的多肽序列Table 1 Sequences of peptides identified by casein hydrolysate and peptide-zinc chelates
另一方面,部分氨基酸对锌的螯合能力较弱,但是在肽锌螯合物的稳定性、溶解性和空间构象等方面具有重要作用,需要进一步确定其对肽锌螯合物在胃肠道内的消化稳定性及经肠道吸收后肽锌螯合物生物利用率的贡献。后续工作将对鉴定出来的多肽序列进行筛选,探究肽锌螯合物在消化过程中的稳定性和跨小肠吸收机制。
3 结论
本研究利用碱性蛋白酶对酪蛋白进行预处理,通过乳酸菌发酵获得锌螯合多肽并与硫酸锌反应制备肽锌螯合物,获得多肽的锌螯合率为31.41%±0.97%。酪蛋白肽中的羧基氧、羟基氧、氨基参与了Zn2+的配位。在模拟胃肠消化过程中,肽锌螯合物的抗氧化能力随消化时间延长逐渐升高,其中锌离子溶解性优于硫酸锌。随着消化过程进行,肽锌螯合物变得更为有序,Zn2+在一定程度上维持了酪蛋白肽的二级结构。然而,当浓度达到0.4 mg/mL 以上时,肽锌螯合物会改变细胞形态,影响细胞增殖并表现出一定的细胞毒性。研究结果为高效安全的酪蛋白肽锌补充剂的制备和应用提供了一定的科学依据。
