Zn对凡纳滨对虾生长和肌肉中相关基因表达的影响
2023-12-02邹永烽赵永鹏梁植郭慧
邹永烽 赵永鹏 梁植 郭慧

摘要:为探究水体不同浓度Zn对凡纳滨对虾(Litopenaeus vannamei)的存活率、增重率及特定生长率的影响及锌转运蛋白3、11、铜锌超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、溶菌酶、toll1样受体、金属硫蛋白、热休克蛋白70、己糖激酶、异柠檬酸脱氢酶和肌肉生长抑制素在肌肉组织中的表达差异。设定0、0.01、0.1和1 mg/L 4个Zn浓度,对凡纳滨对虾进行30 d的胁迫试验。结果表明:浓度0.01、0.1 mg/L的Zn对凡纳滨对虾的存活率、特定生长率及增重率无显著影响(P>0.05),1 mg/L的Zn显著降低了凡纳滨对虾的存活率、特定生长率及增重率(P<0.05)。凡纳滨对虾肌肉中的12种基因的mRNA相对表达量在Zn浓度高于0.1 mg/L时发生极显著变化(P<0.01)。结果表明,Zn胁迫对凡纳滨对虾的存活率、特定生长率、增重率和肌肉中有关基因的相对表达具有显著影响。
关键词:Zn胁迫;凡纳滨对虾(Litopenaeus vannamei);肌肉组织;基因表达
Zn是水环境中最普遍存在的重金属,作为生命必需的微量元素之一,Zn在生命活动的多个方面都发挥着至关重要的作用[1]。水生生物对水中的Zn通常比哺乳动物更敏感,鱼类和甲壳类动物对Zn的敏感度是哺乳动物的10~100倍[2]。近年来水体重金属污染日趋严重,在水生生物体内重金属离子极易积累,达到一定浓度时具有毒性,会严重抑制水生生物的生长发育[3]。凡纳滨对虾(Litopenaeus vannamei)自引入我国以来,迅速遍布全国,成为我国最主要的水产养殖品种之一[4]。凡纳滨对虾因其底栖生活习性和特殊的生理生化特征,使其体内容易富集重金属,对环境胁迫具有很高的敏感性[5]。当前Zn对凡纳滨对虾的影响的研究主要集中在对虾营养以及生长性能和免疫等方面[6-8]。肌肉是对虾机体的主要组成部分,占其体重的60%以上,肌肉生长发育程度是决定对虾生长快慢、体形大小和生长性状优劣的主要因素[9]。当肌肉组织受损后,其酶活力或者基因表达的变化可以一定程度上反应出肌肉自身的损伤程度[10]。而Zn胁迫对凡纳滨对虾肌肉有关基因表达的研究报道罕见,因此本试验研究了养殖水体中不同浓度Zn胁迫30 d后对凡纳滨对虾生长指标的影响以及对其肌肉有关基因表达的情况,以期为凡纳滨对虾的安全养殖和Zn在凡纳滨对虾的肌肉的毒性积累和毒性机制提供参考。
1材料与方法
1.1试验动物
凡纳滨对虾购自广东省湛江市。在广东海洋大学生物研究基地进行养殖。试验期间,光周期为12L∶12D,水质参数保持在溶解氧7.00~8.00 mg/L,水温25.0~28.0 ℃,盐度28‰~30‰,pH 值7.9~8.0。每日2次,分别于9:00和16:00按其体重1%的比例投喂商业饲料。在整个试验过程中,每天对虾进行三次监测,记录虾的死亡率和异常数据。
1.2Zn胁迫试验
采用ZnSO4-7H2O配置所需要的胁迫溶液。设置3个Zn胁迫组 (0.01、0.1和1 mg/L) 和1个空白对照组,每组设置5个重复。每天用相应浓度的Zn溶液替换50%的培养水,保持浓度稳定。
1.3试验取样
Zn胁迫30 d后,在取样前禁食24 h。每组采集5份肌肉样品,将其置于2 mL的收集管中,以液氮保存,直至进行生化检测。所有的操作均在冰上进行。
1.4生长指标计算
生长性能计算公式如下:
SR=100×(N1/N0);
WGR=100×[(Wt-W0)/W0];
SGR=100×[(LnWt-LnW0)/T]。
式中:SR为存活率, %;N1为试验结束后存活的虾尾数;N0:试验前虾的初始尾数;WGR为增重率, %;SGR为特定生长率, %/d;W0为虾初重,g;Wt为虾末重,g;T为试验天数,d 。
1.5基因相对表达量分析
按照TriQuick Reagent总RNA提取试剂盒说明书进行组织中RNA提取。
cDNA的合成按照Vazyme公司的HiScript III RT SuperMix for qPCR (+gDNA wiper) 试剂盒说明书进行。
引物设计所需的序列均在美国国家生物技术信息中心数据库中进行搜索获取,引物设计通过Primer Primer 5.0软件或参考前人试验中的引物。具体序列见表1。
实时荧光定量PCR (RT-qPCR) 使用Vazyme公司的ChamQ Universal SYBR qPCR Master Mix試剂盒,按说明书进行。按下列程序进行荧光定量PCR扩增:94 ℃预变性5 min;95 ℃变性5 s,55 ℃退火15 s,72 ℃延伸20 s,40个循环;95 ℃10 s,65 ℃1 min,97 ℃ 1 s;72 ℃10 min。
1.6数据处理
所得基因数据使用LightCycler 480 Software relwase 1.5.0软件进行处理,用β-actin作为内参基因,结合β-actin和目的基因在Ct值方面进行计算,运用2-ΔΔct法来计算目的基因mRNA的相对表达量并分析变化原因。使用Excel 2016对存活率、增重率、特定增长率和基因的mRNA表达量数据进行分析和作图,计算结果采用平均值±标准差 (mean ± S. D. ) 表示,采用SPSS Statistics 22 软件进行单因素方差分析,采用LSD法进行组间多重比较,显著性水平设为0.05。
2结果与分析
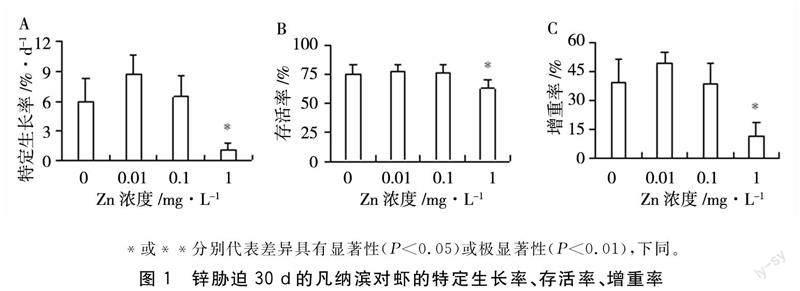
2.1Zn胁迫下凡纳滨对虾的生长性能和存活率
Zn胁迫对凡纳滨对虾的生长性能和存活率的影响如图1所示。随着Zn浓度增加,增重率、特定生长率和存活率的变化呈先增后减的趋势,在Zn浓度为0.01 mg/L处理组有最大值,分别是49.25%、8.74%/d、78.3%。增重率、特定生长率和存活率在Zn浓度为1 mg/L时有最小值,分别是11.95%、1.09%/d、62.9%,均显著低于对照组(P<0.05)。
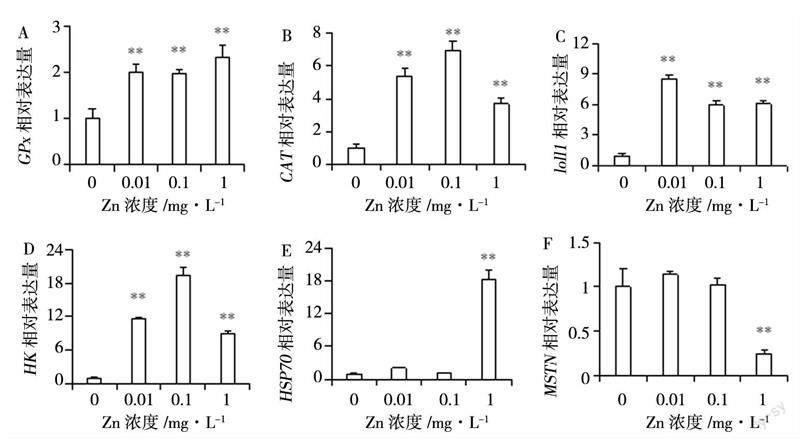
2.2Zn胁迫下凡纳滨对虾肌肉组织相关基因的相对表达水平
Zn胁迫对凡纳滨对虾肌肉组织相关基因的影响如图2所示。与对照组相比,GPx、CAT、toll1、HK的mRNA相对表达量在0.01、0.1、1 mg/L浓度组时均极显著上调(P<0.01),见图2A、图2B、图2C、图2D;HSP70、MSTN的mRNA相对表达量在0.01、0.1 mg/L浓度组变化不显著(P>0.05),在1 mg/L组HSP70极显著上调(P<0.01)而MSTN極显著下降(P<0.01),见图2E、图2F;ZIP3和ZIP11的mRNA相对表达量随着Zn浓度增加呈上升趋势,在0.01 mg/L组ZIP3无显著变化(P>0.05)而ZIP11显著上调(P<0.05),在0.1 mg/L组均显著上调(P<0.05),在1 mg/L组均极显著上调(P<0.01),见图2G、图2H;LZM和MT的mRNA相对表达量随着浓度上升呈先增后减的趋势,从0.01 mg/L组开始上升(P<0.01)都在0.1 mg/L组达到最大值(P<0.01),在1 mg/L组LZM稍微下降(P<0.05)而MT回归正常水平(P>0.05),见图2I、图2J;Cu-Zn SOD的mRNA相对表量在0.01 mg/L组显著上调(P<0.05),在0.1、1 mg/L组极显著上调(P<0.05),见图2K;IDH的mRNA相对表达量在0.01 mg/L组极显著上调(P<0.01),在1 mg/L组极显著下降(P<0.01),在0.1 mg/L组无显著变化(P>0.05),见图2L。
3讨论
3.1Zn胁迫下凡纳滨对虾的存活率和生长情况
Zn是生命活动的重要微量元素,具有催化和调节功能,在营养物质代谢过程中发挥重要作用,也是纠正免疫应答功能的关键元素[11]。有报道指出,水产动物除了能从饲料获得微量元素外,还可从水环境吸收矿物质[12]。本试验发现,在水体Zn浓度低于0.1 mg/L时,凡纳滨对虾的存活率没有受到显著的影响,且在Zn浓度0.01 mg/L时凡纳滨对虾的生长指标最好。吴贤汉等[13]认为微量的金属元素对生物无毒害作用,且能促进生长。本试验的结果进一步验证了该观点。1 mg/L组的凡纳滨对虾的存活率最低(62.9%),表明水体中1mg/L的Zn可能会对凡纳滨对虾的生理功能造成影响进而降低存活率。许多研究均表明Zn超过1 mg/L会对动物机体造成影响。Liang等[14]发现在Zn处理组为1 mg/L,凡纳滨对虾的成活率和生长性能显著降低;郑琰晶等[15]发现,在Zn浓度为1 mg/L时,对脊尾白虾胁迫96 h的毒性实验得出其死亡率约为43%。1 mg/L的Zn浓度远高于我国渔业水质标准[16](GB 11607-89)的限定(Zn≤0.1 mg/L),因此Zn更容易在体内富集,阻碍机体正常生理功能运转,导致凡纳滨对虾的存活率随着培养时间延长而降低。
3.2Zn胁迫下凡纳滨对虾的肌肉相关基因的表达
重金属在凡纳滨对虾体内的含量增加会引起肌肉损伤,影响生长发育和食用性质。进入肌肉的Zn水平的调控机制主要包括金属的转运、储存和解毒等[17]。本研究中,凡纳滨对虾在3种Zn浓度(0.01、0.1、1 mg/L)中胁迫30 d,肌肉中有关Zn转运、储存的基因(ZIP3、ZIP11)的mRNA相对表达量上调,这和时博[18]探究饲料中Zn对凡纳滨对虾生长和营养代谢的研究结果类似。此外本试验通过对比ZIP3和ZIP11的相对表达水平变化,发现ZIP3相对表达水平在Zn浓度为0.01 mg/L时显著升高,而ZIP11在0.1 mg/L时才有显著上调迹象。这可能跟调节酶活性和ZIP蛋白在细胞中的位置不同有关[19]。
铜锌超氧化物歧化酶(Superoxide Dismutase,Cu-Zn SOD)在响应氧化应激的抗氧化防御途径中发挥着重要作用,抗氧化作用可以防止自由基的形成,从而减少细胞损伤和炎症反应等[18]。过氧化氢酶(catalase,CAT)是一种高度保守的酶,它能打破H2O2形成两个水分子和一个氧分子,从而减少毒性作用,并维持细胞氧化还原平衡[20]。谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)在细胞防御和减少自由基等方面发挥着重要作用,是生物抗氧化防御系统的关键[21]。本试验中,Cu-Zn SOD、CAT和GPx的表达水平在三个处理组中均显著性提高,这和陈天赐[22]的研究结果类似。活性氧(ROS)是生物正常代谢和异型生物质暴露的产物,在正常生理条件下细胞会启动酶抗氧化剂和非酶抗氧化剂以避免ROS造成的氧化损伤[23]。Cu-Zn SOD和GPx的表达水平和所处环境中的Zn浓度呈正相关。可能在较高Zn浓度下ROS含量增加,为了维持细胞内氧化与抗氧化的动态平衡,需要更多Cu-Zn SOD和GPx抑制过量ROS。在Zn1 mg/L时CAT相对表达量比在0.1 mg/L少,可能是持续的Zn胁迫导致ROS含量过量破坏细胞的正常功能,引起基因表达水平的下降。这表明,基因表达对Zn胁迫具有特异性,对虾肌肉组织通过不同基因的表达产生不同的抗氧化应答,从而减小Zn对机体的损伤。
溶菌酶(Lysozyme)是体液免疫系统的关键组成部分[24],有研究表明凡纳滨对虾摄食含锌的饲料显著提高溶菌酶的表达量和活性[18],这和本试验结果类似,表明适量的Zn可以刺激凡纳滨对虾提升免疫应答水平。
金属硫蛋白(metallothioneins,MTs)是一种结合金属离子的蛋白質,它对Zn有着很高的亲和力,参与重金属解毒过程,是维持金属含量动态平衡、参与重金属解毒的关键酶之一,在减轻重金属对生物体的毒害方面起重要作用[25]。研究表明,重金属胁迫可以显著提高日本囊对虾MT基因的表达水平[26]。本研究中,凡纳滨对虾MT表达水平在Zn浓度0.01 mg/L和0.1 mg/L时显著升高,表明MT参与抵抗Zn胁迫的免疫防御。此外,MT是细胞凋亡的抑制因子,有研究表明抑制MT基因的表达可以增强凋亡基因P53的表达水平[27]。本试验中,MT在1 mg/L组显著下调,在该浓度下凡纳滨对虾的存活率最低(62.9 %),进一步验证了MT是细胞凋亡的负调控因子。
热休克蛋白(Heat shock proteins,HSPs)又称应激蛋白或热应激蛋白,是有机体受到热刺激及其他环境、生理或病理胁迫时大量表达的一类保守型蛋白[28]。有研究显示,水体中施用芽孢杆菌可提高凡纳滨对虾肌肉HSP70的mRNA表达量[29]。本试验发现HSP70应对Zn胁迫的响应敏感性较低,在Zn浓度为1 mg/L时才显著上调。有研究指出HSP70在胁迫后期显著升高,相比于HSP60较不敏感[30],这和本试验中得到的结果相似,推测HSP70可能在高浓度的Zn胁迫中起重要作用。
己糖激酶(hexokinase,HK),是糖酵解途径中的重要酶类之一[31],异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)是三羧酸循环重要的酶类之一[32]。本试验中,HK和IDH在0.01 mg/L的Zn胁迫下表达量显著提高,这可能是一种代偿性表达,在受到Zn胁迫下免疫系统诱导免疫蛋白大量合成,消耗大量能量,为保持机体稳定的能量供应,从而进一步增强葡萄糖的分解,同时提高己糖激酶的相对表达水平。在1 mg/L胁迫下可能因为胁迫压力过大,导致细胞缩水损坏,三羧酸循环的反应历程遭到破坏引起IDH相对表达水平下降。
肌肉生长抑制素(MSTN)可显著抑制肌肉增生,负向调控肌纤维生长,该基因在非骨骼肌生长发育中发挥着重要的生理功能调节作用[33]。在本试验中,凡纳滨对虾MSTN在对虾肌肉中表达水平较高,表明MSTN在对虾肌肉的生长发育中起重要作用。MSTN在1 mg/L组中,表达水平显著下降,这与斑节对虾的研究近似[34],表明1 mg/L的Zn可能对肌肉造成较大的损伤,机体通过降低MSTN的表达从而促进肌纤维的生长并修复肌肉。
4结论
本研究表明,Zn浓度1 mg/L会对凡纳滨对虾特定生长率、存活率和增重率造成显著影响。Zn胁迫会使凡纳滨对虾相关转运、抗氧化、应激和代谢基因的相对表达水平显著升高,对Zn胁迫做出应答,从而保护机体,这展现出凡纳滨对虾肌肉组织相关基因应对Zn胁迫具有多种应答机制和特异性表达。本研究可为凡纳滨对虾的养殖和Zn在凡纳滨对虾的肌肉的毒性积累和毒性机制的探究提供参考。
参考文献:
[1] JIANG Y,ZHANG S,FENG S,et al.Genome wide identification,phylogeny and expression of zinc transporter genes in common carp[J].PLoS One,2014,9(12):e116043.
[2] FRSTNER U,PROSI F. Heavy metal pollution in freshwater ecosystems[M].Biological aspects of freshwater pollution.Pergamon,1979:129-161.
[3] 郭永灿,周青山,谢锦云,等.底泥中重金属对水生生物的影响Ⅰ.铅的不同形态对鱼类的毒性[J].水生生物学报,1991(3):234-241+293.
[4] LI F,XIANG J.Recent advances in researches on the innate immunity of shrimp in China[J].Developmental & Comparative Immunology,2013,39(1-2):11-26.
[5] OLOLADE I A,LAJIDE L,OLUMEKUN V O,et al.Influence of diffuse and chronic metal pollution in water and sediments on edible seafoods within Ondo oil-polluted coastal region,Nigeria[J].Journal of Environmental Science and Health,Part A,2011,46(8):898-908.
[6] 李日美.低鱼粉饲料添加肌醇、锌对凡纳滨对虾和珍珠龙胆石斑鱼的营养生理效应研究[D].湛江:广东海洋大学,2019.
[7] 何树青,李日美,杨奇慧,等.锌对凡纳滨对虾生长、非特异性免疫指标、抗病力及肠道菌群结构的影响[J].水产学报,2021,45(10):1726-1739.
[8] 张海涛,陈效儒,董晓慧,等.5种锌源对凡纳滨对虾生长、生化和免疫指标的影响[J].水产科学,2017,36(1):15-21.
[9] 杨春玲,陈慧芳,彭敏,等.凡纳滨对虾转录组测序分析及肌肉生长发育相关基因的筛选[J].南方农业学报,2021,52(9):2319-2328.
[10] 吴坚.金属对海洋生物的比较组织病理学影响[J].海洋环境科学,1990(2):104.
[11] SONG Z,JIANG W,LIU Y,et al.Dietary zinc deficiency reduced growth performance,intestinal immune and physical barrier functions related to NF-κB,TOR, Nrf2,JNK and MLCK signaling pathway of young grass carp (Ctenopharyngodon idella)[J].Fish & Shellfish Immunology,2017,66:497.
[12] 麥康森.水产动物营养与饲料学[M].北京:中国农业出版社.2011:87-88.
[13] 吴贤汉,张士璀,王峰,等.青岛文昌鱼的实验室培育──饵料和沙对幼虫成活的影响[J].海洋与湖沼,1995(S1):3.
[14] LIANG Z,CHEN T,YANG F,et al.Toxicity of chronic waterborne zinc exposure in the hepatopancreas of white shrimp Litopenaeus vannamei[J].Chemosphere,2022,309:136553.
[15] 郑琰晶,魏社林,吴进孝,等.Cu2+、Zn2+、SDS、DBS对脊尾白虾的毒性试验[J].热带海洋学报,2006,25(5):87-90.
[16] 国家环境保护局.渔业水质标准:GB 11607-1989[S].北京:中国标准出版社,1989:1-2.
[17] KIM J H,RHEE J S,LEE J S,et al.Effect of cadmium exposure on expression of antioxidant gene transcripts in the river pufferfish,Takifugu obscurus (Tetraodontiformes) [J].Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp,2010,152(4):473-479.
[18] 时博.饲料中锌、铬、铜对凡纳滨对虾生长和营养物质代谢的影响及其调控机制研究[D].宁波:宁波大学,2021.
[19] KIM K Y,LEE S Y,CHO Y S,et al.Molecular characterization and mRNA expression during metal exposure and thermal stress of copper/zinc-and manganese-superoxide dismutases in disk abalone,Haliotis discus discus[J].Fish & shellfish immunology,2007,23(5):1043-1059.
[20] AROCKIARAJ J,EASWVARAN S,VANARAJA P,et al.Molecular cloning, characterization and gene expression of an antioxidant enzyme catalase(MrCat) from Macrobrachium rosenbergii[J].Fish & Shellfish Immunology,2012,32(5):670-682.
[21] GUO H,MIAO Y,XIAN J,et al.Expression profile of antioxidant enzymes in muscular tissue from freshwater prawn Macrobrachium rosenbergii exposed to an elevated level of copper[J].Bulletin of Environmental Contamination and Toxicology,2015,95(4):447-451.
[22] 陈天赐.吡啶硫酮铜对凡纳滨对虾(Litopenaeus vannamei)的急性毒性效应研究[D].湛江:广东海洋大学,2022.
[23] SUN N,LIU M,JIANG G,et al.Toxic mechanism of pyrene to catalase and protective effects of vitamin C:Studies at the molecular and cell levels[J].International Journal of Biological Macromolecules:Structure, Function and Interactions,2021,171(1):225-233.
[24] QIN Z,BABU V S,WAN Q,et al.Transcriptome analysis of Pacific white shrimp (Litopenaeus vannamei) challenged by Vibrio parahaemolyticus reveals unique immune-related genes[J].Fish & shellfish immunology,2018,77:164-174.
[25] 彭金霞,房振峰,韦嫔媛,等.凡纳滨对虾MT基因序列及其在卵巢发育和低温胁迫中的表达分析[J].水生生物学报,2013,37(4):678-683.
[26] REN X,WANG X,LIU P,et al.Bioaccumulation and physiological responses in juvenile Marsupenaeus japonicus exposed to cadmium[J].Aquatic Toxicology,2019,214:105255.
[27] SHIMODA R,ACHANZAR W E,QU W,et al.Metallothionein is a potential negative regulator of apoptosis[J].Toxicological Sciences,2003,73(2):294-300.
[28] 史進选.斑节对虾三种热休克蛋白基因在不同环境胁迫下的表达及功能分析[D].上海:上海海洋大学,2016.
[29] 曹煜成,文国樑,张华军,等.地衣芽孢杆菌对凡纳滨对虾Toll和HSP70基因表达的影响[J].中国微生态学杂志,2013,25(8):882-886.
[30] 李玲,吴方舟,梁金荣,等.Cd对凡纳滨对虾血细胞活性氧含量(ROS)、细胞凋亡率及应激反应基因表达的影响[J].中国水产科学,2021,28(2):167-175.
[31] ALLERT S,ERNEST I,POLISZCAK A,et al.Molecular cloning and analysis of two tandemly linked genes for pyruvate kinase of Trypanosoma brucei[J].Eur J Biochem,1991,200:19-27.
[32] EL-MANSI M,COZZONE A J,SHILOACH J,et al.Control of carbon flux through enzymes of central and intermediary metabolism during growth of Escherichia coli on acetate[J].Current opinion in microbiology,2006,9(2):173-179.
[33] COVI J A,KIM H W,MYKLES D L.Expression of alternatively spliced transcripts for a myostatin-like protein in the blackback land crab,Gecarcinus lateralis[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2008,150(4):423-430.
[34] DE SANTIS C,WADE N M,JERRY D R,et al.Growing backwards:an inverted role for the shrimp ortholog of vertebrate myostatin and GDF11[J].Journal of Experimental Biology,2011,214(16):2671-2677.
Effects of Zn on growth and related gene expression in
muscle of Litopenaeus vannamei
ZOU Yongfeng, ZHAO Yongpeng, LIANG Zhi, GUO Hui
( Zhanjiang Key Laboratory of Marine Ecology and Aquaculture Environment,
College of Aquaculture, Guangdong Ocean University, Zhanjiang 524088,China)
Abstract:In order to investigate the effects of different concentrations of zinc on survival, weight gain and specific growth rate of Litopenaeus Vannamei, and the expression of zinc transporter genes 3,11(ZIP3, ZIP11) , Superoxide Dismutase Superoxide Dismutase (Cu-Zn SOD) , Catalase Glutathione Peroxidase (GPx) , Lysozyme (LZM) , toll1-like receptors, Metallothioneins (MT) , Heat shock proteins (HSP70) , Hexokinase (HK) , Isocitrate Dehydrogenase (IDH) and Myostain (MSTN) in muscle,the stress experiment of L. vannamei was carried out at the concentrations of 0.0.01,0.1 and 1 mg/L Zn for 30 days. The results showed as follows: Zn concentrations of 0.01 and 0.1 mg/L had no significant effects on the survival rate, specific growth rate and weight gain rate of L. vannamei (P>0.05), while Zn concentrations of 1 mg/L significantly decreased the survival rate, specific growth rate and weight gain rate of L. vannamei (P<0.05). The mRNA relative expression levels of 12 genes in muscle of L. vannamei significantly changed when Zn concentration was higher than 0.1 mg/L (P<0.01). The results showed that Zn stress had significant effects on survival rate, specific growth rate, weight gain rate and relative expression of related genes in muscle of L. vannamei.
Key words:Zn stress; Litopenaeus vannamei; muscle tissue; gene expression
(收稿日期:2023-09-26)
