几种环境因子对IHHNV在凡纳滨对虾体内增殖的影响
2023-12-02张丽马文婷姚洪旺李娜包海岩
张丽 马文婷 姚洪旺 李娜 包海岩
摘要:为阐明在凡纳滨对虾(Litopenaeus vannamei)养殖过程中影响传染性皮下及造血组织坏死病毒(IHHNV)增殖的关键因子,在实验室条件下,研究了温度、盐度、氨氮、亚硝酸盐氮等环境因子变化对凡纳滨对虾体内IHHNV增殖的影响。结果显示:在同样条件下,水温25 ℃和30 ℃凡纳滨对虾体内IHHNV病毒数具有明显差异,且在30℃时最大;2.5‰、10.0‰、20.0‰三个盐度梯度IHHNV增殖组间差异显著,且增殖速度与盐度呈正相关;在氨氮0.05、3.00、7.00 mg/L三个浓度梯度下,IHHNV在凡纳滨对虾体内增殖数量的变化未表现出线性关系,但氨氮0.05 mg/L浓度组凡纳滨对虾体内病毒数明显低于3.00、7.00 mg/L浓度组;在亚硝酸盐氮0.05、5.00、10.00 mg/L三个浓度梯度下,IHHNV在凡纳滨对虾体内增殖数的变化组间差异不显著。
关键词:凡纳滨对虾(Litopenaeus vannamei);环境因子;传染性皮下及造血组织坏死病毒(IHHNV);增殖
随着凡纳滨对虾(Litopenaeus vannamei)养殖业的迅猛发展,养殖疾病逐年增多,造成了极大的经济损失。环境因子作为养虾池塘生态系统的主要部分,对对虾病毒病的暴发起着重要作用。环境因子超出对虾的适应范围就会成为胁迫因子,这种胁迫既影响生物体也影响病原体。养殖环境涉及的胁迫因子包括水质理化因子(温度、盐度、pH、溶解氧、环境污染物等)、生物因子(媒介生物等)。近年来环境胁迫因子对养殖生物的生理病理影响受到越来越多国内外科研工作者的重視。已有研究表明:疾病暴发主要是宿主、环境和病原体三者经过复杂的相互作用的结果,在一定环境条件下,宿主与其携带的病原体可以共存,当某些环境条件发生了大的变化,可能会导致疾病的暴发。黄灿华等[1]对养虾水体环境因子变化与对虾病毒病之间的关系进行了实验分析,结果表明某些环境因子(如高盐、低溶氧)的变化能明显诱发对虾发病死亡。
对虾被病毒感染后是否发病是多种因素相互作用、相互影响的结果。包括机体自身的抗病力水平、病原微生物以及环境条件等[2]。徐丽美等[3]通过研究发现了每毫克组织含103个病毒粒子可作为疾病暴发的危险临界数值。本试验研究了部分环境因子变化对传染性皮下及造血组织坏死病毒(IHHNV)在对虾体内增殖的影响,在室内条件下,模拟自然养殖环境,研究温度、盐度、氨氮、亚硝酸盐氮等环境因子变化对凡纳滨对虾体内IHHNV增殖的影响,分析不同影响因子对IHHNV在对虾体内增殖的影响力大小,以期阐明在对虾养殖过程中影响IHHNV在对虾体内增殖情况的关键因子,为综合防治IHHN的发生提供科学依据。
1材料与方法
1.1材料
1.1.1供试阳性组织阳性组织取自天津地区某发病养殖场池塘采集样品,试验用阳性凡纳滨对虾经PCR方法进行多种病毒检测,根据检测结果取传染性皮下及造血组织坏死病毒(IHHNV)阳性,而白斑综合征病毒(WSSV)、致急性肝胰腺坏死细菌(VPAHPND)、偷死野田村病毒(CMNV)、虾肝肠胞虫(EHP)均阴性的样品用于制备攻毒实验用病毒粗提液。
1.1.2病毒粗提液病毒提取方式参照孔杰等[4]和吴昊等[5]的方法进行,于超净台内无菌条件下取感染IHHNV的凡纳滨对虾的鳃丝,加入三倍体积TNM缓冲液[5] (配方:Tril-HCl 20 mmol/L;NaCl 100 mmol/L;MgCl 5 mmol/L,121 ℃高压灭菌15 min),冰浴匀浆,匀浆液4 ℃、13 000 rpm/min离心10 min;离心后取上清液再4 ℃、13 000 rpm/min离心5 min,分装到1.5 mL离心管中,-80 ℃冰箱中保存备用。每管分别取1 μL用RT-PCR测量IHHNV的浓度。
1.1.3试验用凡纳滨对虾试验凡纳滨对虾取自天津滨海新区某对虾养殖厂,体长10 cm左右,平均体重约15 g。经检测,白斑综合征病毒(WSSV)、致急性肝胰腺坏死细菌(VPAHPND)、偷死野田村病毒(CMNV)、传染性皮下及造血组织坏死病毒(IHHNV)、虾肝肠胞虫( EHP)均为阴性,暂养3 d,无死亡。
1.1.4试验场地、设备试验池为长方体玻璃缸,每个缸水体约80 L,具备循环水养殖系统,每个组设置3个平行,每个平行养殖对虾20尾。试验用水为自来水兑卤水调节盐度。水温25 ℃,盐度2‰,氨氮0.01 mg/L,亚硝酸盐氮0.01 mg/L,pH值 7.6~8.6,暂养3 d。
1.2方法
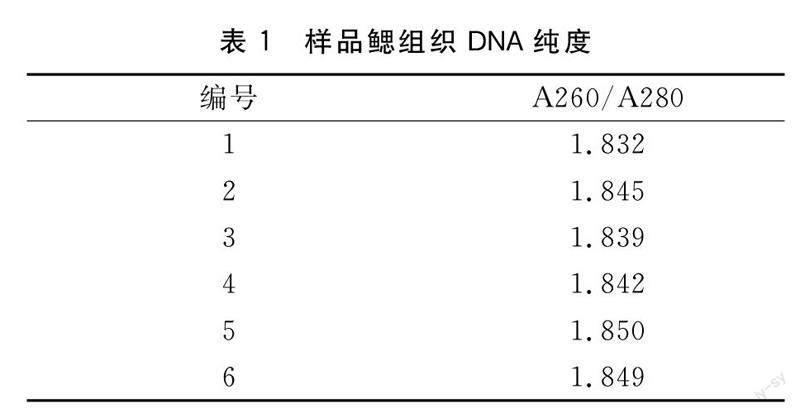
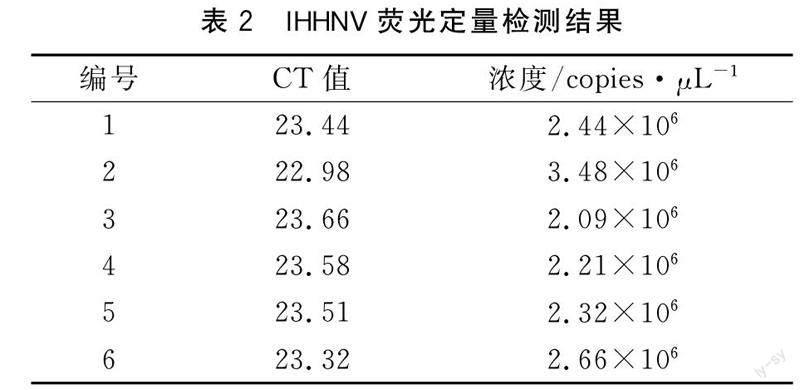
1.2.1阳性样品病毒浓度测定随机取6管病毒粗提液,用天根生化科技(北京)有限公司生产的血液/细胞/组织基因组DNA提取试剂盒,分别提取对虾鳃组织DNA并测定所提取的DNA的A260/A280 比值和IHHNV的浓度。
1.2.2人工感染预试验
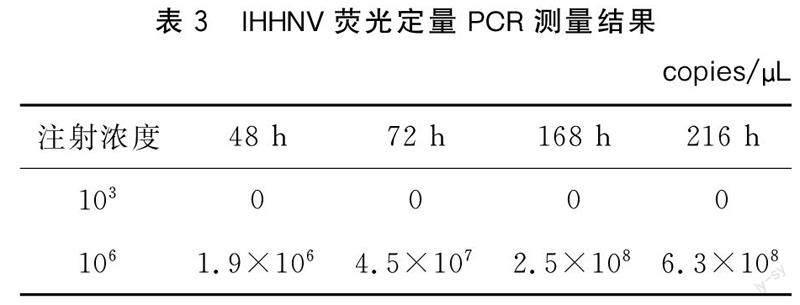
设病毒粗提液106、103copies/μL两个梯度,采用注射感染,每个梯度注射20尾虾,设1组平行试验组。从对虾倒数第2腹节侧面连接处的浅层肌肉进行注射,每尾注射量为10 μL,对照组注射TNM缓冲液。在注射后48 h、72 h、168 h、216 h取样,样品暂存于-20 ℃冰箱中。用DNA提取试剂盒提取对虾鳃组织DNA,用RT-PCR方法检测IHHNV浓度。
本试验选择肌肉注射,可以严格控制进入对虾体内病毒的数量,便于后期对虾体内病毒量的测定和分析。本次试验结果显示病毒浓度为103 copies/μL时注射后48 h、72 h、168 h、216 h鳃组织中未检测到IHHNV;而病毒浓度为106 copies/μL注射后,从48 h到168 h病毒浓度呈增长趋势;从168 h到216 h,病毒浓度趋于缓慢增长趋势,故后期试验病毒的注射浓度选定为106 copies/μL,检测时间≤168 h。
1.2.3病毒检验方法取对虾鳃组织10 mg提取DNA,得到100 μL的DNA模板,采用荧光定量PCR方法进行检测。
1.2.4不同环境因子对IHHNV在感染对虾体内增殖的影响
暂养后,采用人工感染预试验的方法,肌肉注射感染IHHNV。试验中观察记录对虾发病及死亡数,根据实际情况设定取样起始时间点,每隔24 h取2~3尾虾鳃组织,-20 ℃冷冻保存,用于病毒检测。人工感染后每天投喂1次人工配合饲料,换水20%~50%,排出残饵和粪便,试验过程中24 h充气,保证溶解氧浓度。
温度变化试验时,将三组试验水体通过自动控温系统,把温度分别控制在(19±1)℃、(25±1)℃、(30±1)℃,在96 h、120 h、144 h、168 h、192 h取样;盐度变化试验时,将三组试验水体通过添加卤水,将盐度调节到2.5‰±1‰、10.0‰±1‰、20.0‰±1‰,在96 h、120 h、144 h、168 h取样;氨氮浓度变化试验时,氨氮浓度用氯化铵调节使浓度分别为 0.05、3.00、7.00 mg/L,为保持氨氮的浓度,每天换水50%左右,在72 h、 96 h、120 h、144 h、168 h取样;进行亚硝酸盐浓度变化试验时,亚硝酸盐浓度用亚硝酸钠调节使浓度分别为0.05、5.00、10.00 mg/L,为保持硝酸盐氮的浓度,每天换水50%左右,在72 h、 96 h、120 h取样。
2结果
2.1阳性样品病毒浓度测定
测定提取对虾鳃组织DNA的A260/A280 比值,均在1.8~2.0之间,结果见表1。用RT-PCR方法测量IHHNV的浓度,结果见表2。
2.2IHHNV的人工感染试验
浓度为103、106 copies/μL病毒粗提液攻毒试验后不同时间体内病毒含量测定结果见表3。
2.3温度变化试验
表4为攻毒后三个温度组对虾在96~192 h内五次取样并进行病毒浓度测定的结果。通过SPSS软件进行双因素方差分析,结果显示病毒增殖总量在温度组20 ℃、25 ℃、30 ℃组间P<0.05,说明不同水温组病毒增殖数量有显著差异。通过表4可以看出,在30 ℃时病毒增殖数量高于20 ℃和25 ℃。而在同一组内,96~192 h对虾体内IHHNV拷贝数呈增长趋势。
2.4盐度变化试验
表5为攻毒后不同盐度组对虾在96~168 h内四次取样并进行病毒浓度测定的结果。通过SPSS软件进行双因素方差分析显示,不同盐度组间P<0.05,差异显著。说明在不同盐度组病毒增殖数量有显著差异。不同盐度组Pearson(皮尔逊)相关性系数为0.651,且显著性水平小于0.05,说明IHHNV在凡纳滨对虾体内增殖的速度与盐度呈正相关,即在盐度2.5‰~20.0‰范围内,凡纳滨对虾体内IHHNV增殖速度随着盐度的升高而提高。
2.5氨氮变化试验
表6为攻毒后不同氨氮浓度组对虾在72~168 h内五次取样并进行病毒浓度测定的结果。
通过SPSS软件进行双因素方差分析,结果显示不同氨氮组间P>0.05,说明在不同氨氮浓度组病毒增殖数量差异不显著。不同氨氮组Pearson(皮尔逊)相关性系数为0.274,说明IHHNV在凡纳滨对虾体内增殖的数量与水体中氨氮的浓度相关性低。
2.6亚硝酸盐氮变化试验
表7为攻毒后不同氨氮浓度组对虾在72~120 h内三次取样并进行病毒浓度测定的结果。通过SPSS软件进行双因素方差分析,结果显示不同氨氮组间P>0.05,说明在不同氨氮浓度组病毒增殖数量差异不显著。不同氨氮组Pearson(皮尔逊)相关性系数为 -0.218,说明IHHNV在凡纳滨对虾体内增殖的数量与水体中亚硝酸盐氮浓度相关性低。
3分析與讨论
3.1病毒粗提液制备
阳性样品在病毒粗提过程采取13 000 rpm离心10 min,消除细菌的影响。对凡纳滨对虾进行WSSV、IHHNV、EHP、CMNV、VPAHPND五种病原PCR检测,保证试验用凡纳滨对虾阳性样品只携带IHHNV,确保感染后病毒的单一性。病毒提取过程中均在冰水中操作,确保病毒的活性。对粗提后的病毒,进行荧光定量PCR的检测,确定病毒浓度,再用不同浓度的病毒进行人工感染预试验,确定人工感染浓度,以证明粗提液的感染性。本试验病毒粗提液的方法参考吴昊等[5]病毒提取的方法,并根据试验需求进行适当调整。本试验人工感染预试验结果满足试验要求,故病毒未进行再次提纯,直接用于攻毒试验。
3.2对虾的IHHNV人工感染技术
本试验采用了肌肉注射方法进行攻毒试验,而未采用投喂病料、病毒浸泡等方法,虽然投喂感染更接近自然状况,但与注射感染相比较,由于个体摄食行为差异,摄入的病毒量不同,因而后期试验研究时可比性较差。注射感染的可控性强,能够准确记录每尾虾个体中攻入的病毒剂量,更准确地对比病毒在不同对虾个体中数量的变化。
3.3不同环境因子对IHHNV在感染对虾体内增殖的影响
3.3.1温度对IHHNV在感染对虾体内增殖的影响温度是养殖环境中重要的环境因子,对虾的新陈代谢、抗病力、生长、发育及进食等都会受到影响,李侃等[6]对白斑病毒进行研究,结果显示病毒在温度为21~30 ℃之间增殖最快,而当温度低于20 ℃或超过30 ℃时,病毒的增殖速度受到部分抑制。Du H等[7]发现虾体内病毒携带量在(10±1)℃条件下明显低于(24±1)℃条件下。Dee Montgomery-Brock等[8]研究发现高水温可以抑制凡纳滨对虾体内 IHHNV 的增殖。柴超[9]研究了23.87~26.8 ℃范围内温度对IHHNV复制的影响,研究结果表明温度增高可以增加IHHNV 的复制。本试验结果显示,在同一时间点,对虾体内病毒增殖数量在水温25 ℃和30 ℃具有明显差异。在同一时间采集样品组织中IHHNV拷贝数在30 ℃时最大,与柴超的研究结果具有一致性,但本试验时间设定范围较大,如果想要得到更加细致的结果,需要增加多个温度点开展进一步的研究。
3.3.2盐度对IHHNV在感染对虾体内增殖的影响Bray等[10]发现高盐度和IHHN病毒感染之间有明显的相互作用。柴超[9]也发现盐度与 IHHNV 拷贝数具有低相关性。管越强[2]研究发现盐度可显著影响虾类的免疫反应,超出适盐范围免疫反应下降。本试验研究了2.5‰、10.0‰、20.0‰三个盐度梯度内对虾体内IHHNV增殖的数量变化,结果表明IHHNV在凡纳滨对虾体内增殖的速度与盐度呈正相关,即在盐度2.5‰~20.0‰范围内,凡纳滨对虾体内IHHNV增殖速度随着盐度的升高而提高。
3.3.3氨氮对IHHNV在感染对虾体内增殖的影响氨氮是对虾养殖池塘中最主要的无机污染物,张辉[11]以日本囊对虾(Marsupenaeus japonicus)为实验动物开展研究,发现经氨氮胁迫处理后的对虾感染WSSV后,体内病毒复制水平明显高于未处理组。郝晨光[12]通过研究发现在氨氮胁迫下,氨氮浓度越高,协迫时间越长,实验组克氏原螯虾鳃丝内WSSV增殖越快。向赟[13]研究氨氮浓度突变对携带WSSV对虾的影响,发现浓度 0.05 mg/L感染组病毒含量明显低于1.25 mg/L和3 mg/L感染组,对于携带WSSV的对虾,不同氨氮浓度突变都给对虾体内WSSV增殖提供机会。本试验根据孙国铭等[14]关于氨氮和亚硝酸氮对凡纳滨对虾的毒性研究的结果,研究了在0.05、3.00、7.00 mg/L三个氨氮浓度梯度下,IHHNV在凡纳滨对虾体内病毒增殖数量的变化,结果是差异不显著。Pearson相关性显示氨氮浓度变化与IHHNV在凡纳滨对虾体内病毒增殖数量不相关。但本试验结果显示氨氮浓度0.05 mg/L浓度组对虾体内病毒数量明显低于3.00、7.00 mg/L浓度组。本试验结果显示氨氮浓度与对虾体内病毒数量未表现出具体的线性关系,可能与养殖试验过程中氨氮浓度不稳定有关。本试验使用氯化铵调节氨氮,但发现氨氮调整到所需浓度后第二天会下降到起始浓度的一半以上,为了保证氨氮浓度的稳定,采用换水50%的方法,但氨氮还是不能一直保证稳定在试验浓度,这或许是造成三个浓度结果不显著的一个原因。后续研究可考虑用其他方法保证氨氮浓度的稳定。
3.3.4亚硝酸盐氮对IHHNV在感染对虾体内增殖的影响管越强[2]研究发现,亚硝酸盐氮对凡纳滨对虾抗病力相关因子有显著影响。本试验根据孙国铭等[14]有关氨氮和亚硝酸氮对凡纳滨对虾的毒性研究结果,研究了在 0.05、5.00、10.00 mg/L三个亚硝酸氮浓度梯度下,IHHNV在凡纳滨对虾体内病毒增殖数量的变化,结果差异不显著。这可能与为维持亚硝酸盐氮浓度进行大量换水,对虾造成应激有关。而且本试验只进行了120 h,如果再开展类似试验,应在稳定试验水体亚硝酸盐氮浓度的同時增加观察周期,以获得更有说服力的数据。
参考文献:
[1] 黄灿华,石正丽,张建红,等.养虾水体环境因子变化与对虾病毒病之间的关系[J].中山大学学报(自然科学版),2000(S1):159-163.
[2] 管越强.主要环境因子对养殖对虾抗病力及白斑综合症发生的影响[D].青岛:中国科学院研究生院(海洋研究所),2003.
[3] 徐丽美,杨丰.利用定量PCR方法研究对虾白斑杆状病毒感染与发病的关系[J].高技术通讯,2001(12):9-11.
[4] 孔杰,石拓,刘萍,等.中国对虾一种C型杆状病毒的纯化技术及形态特征研究[J].海洋与湖沼,1997(3):233-237.
[5] 吴昊,徐丽美,杨丰.对虾传染性皮下及造血组织坏死病毒(福建株)基因组的克隆[J].台湾海峡,2008,100(2):147-151.
[6] 李侃,罗淑娅,徐丽美.温度影响对虾白斑综合症病毒增殖机制的研究[J].应用海洋学学报,2013,32(1):61-66.
[7] DU H H,DAI W,HAN X Y,et al.Effect of low water temperature on viral replication of white spot syndrome virus in Procambarus clarkii[J].Aquaculture,2008,277(3-4):149-151.
[8] MONTGOMERY-BROCK D,TACON A G J,POULOS B,et al.Reduced replication of infectious hypodermal and hematopoietic necrosis virus (IHHNV) in Litopenaeus vannamei held in warm water[J].Aquaculture,2007,265(1-4):41-48.
[9] 柴超.养殖凡纳滨对虾传染性皮下及造血组织坏死病毒(IHHNV)的感染率及其基因组学研究[D].上海:上海海洋大学,2014.
[10] BRAY W A,周光正.盐度对万氏对虾生长和存活的影响及IHHN病毒和盐度相互关系的观察[J].国外水产,1995,79(1):16-20.
[11] 张辉.氨氮胁迫诱导热休克因子1促进对虾白斑综合征病毒感染[D].济南:山东大学,2023.
[12] 郝晨光.三种环境因子对克氏原螯虾体内WSSV增殖的影响[D].秦皇岛:河北农业大学,2020.
[13] 向赟.环境因子和弧菌对白斑综合症病毒(WSSV)在凡纳滨对虾体内增殖的影响[D].湛江:广东海洋大学,2014.
[14] 孙国铭,汤建华,仲霞铭.氨氮和亚硝酸氮对南美白对虾的毒性研究[J].水产养殖,2002(1):22-24.Effects of several environmental factors on IHHNV
proliferation in Litopenaeus Vannamei
ZHANG Li MA Wenting YAO Hongwang LI Na1, BAO Haiyan
(1.Tianjin Animal Disease Prevention and Control Center,Tianjin 300402,China;
2. BeiliZigu Village, Huangzhuang Town, Baodi District, Tianjin 301800,China)
Abstract:In order to elucidate the key factors that affect the proliferation of IHHNV during the cultivation of Litopenaeus vannamei,the effects of environmental factors such as temperature, salinity, ammonia nitrogen and nitrite nitrogen on the proliferation of IHHNV in Litopenaeus vannamei were investigated under laboratory conditions.The experimental results showed that under the same conditions, there were significant differences in the number of IHHNV viruses in the body of Litopenaeus vannamei at water temperatures of 25 ℃ and 30 ℃. And the maximum number of viruses was in the temperature group of 30 ℃; For the salinity gradient experiments of 2.5, 10.0, and 20.0, there were significant differences between the IHHNV proliferation groups, and the proliferation rate was positively correlated with salinity; Under three concentration gradients of 0.05 mg/L, 3.00 mg/L, and 7.00 mg/L of ammonia nitrogen, there was no linear relationship between the changes in virus proliferation quantity of IHHNV in Litopenaeus vannamei. However, the number of virus in the body of Litopenaeus vannamei with an ammonia nitrogen concentration of 0.05 mg/L was significantly lower than that of the 3.00 mg/L and 7.00 mg/L concentration groups; At three concentration gradients of 0.05 mg/L, 5.00 mg/L, and 10.00 mg/L for nitrite nitrogen, there was no significant difference in the number of virus proliferation in Litopenaeus vannamei between groups.
Key words:Litopenaeus vannamei;environmental factor;IHHNV;proliferation
(收稿日期:2023-09-08)
