中缝背核5羟色胺能神经环路在慢性痛及焦虑共病中的研究进展
2023-12-01黄文烨孟凡成钱正一陈桢熹黄芷桐武胜昔白占涛延安大学生命科学学院多肽资源药物研究中心陕西省区域生物资源保育与利用工程技术研究中心陕西延安76099空军军医大学基础医学院神经生物学教研室陕西西安7003
崔 玥,黄文烨,孟凡成,薛 茜,钱正一,陈桢熹,黄芷桐,武胜昔,白占涛,徐 晖 (延安大学生命科学学院多肽资源药物研究中心,陕西省区域生物资源保育与利用工程技术研究中心,陕西 延安 76099;空军军医大学基础医学院神经生物学教研室,陕西 西安 7003)
中缝背核(dorsal raphe nucleus,DRN)位于中脑导水管腹侧,呈扇形,分布着谷氨酸、多巴胺、γ-氨基丁酸(gamma-aminobutyric acid,GABA)以及5-羟色胺(5-hydroxytryptamine,5-HT)能神经元,其中5-HT能神经元约占2/3,主要位于腹部以及腹外侧区域,参与调控多种功能状态,如疼痛、焦虑、奖赏、 睡眠-觉醒、感觉与运动功能[1-4]。在疼痛的下行调节中,脊髓5-HT能系统能够缓解疼痛也可以加剧疼痛敏感性,激活侧巨细胞旁的5-HT投射会缓解热刺激痛,激活后脑内侧的5-HT投射则会加剧机械痛[5]。在许多大脑区域,如皮层、丘脑、杏仁核等,都能够接受DRN 5-HT投射,参与慢性疼痛的中枢调节[6-7],并且投射至不同的部位、作用于不同5-HT受体分别发挥痛觉过敏和镇痛的作用。5-HT神经元调节功能障碍还与一系列人类精神疾病有关,包括焦虑和抑郁等[8]。在动物研究中,5-HT能系统在调节焦虑中的功能同样不一致,即使同一脑区,激活不同部位不同神经元也会产生不同的效应[9-11],如中央杏仁核(central nucleus of the amygdala,CeA)的投射神经元在厌恶刺激下促进焦虑样行为,而到前脑的5-HT神经元则促进积极的应对行为[6]。众所周知,在临床实践中,慢性痛与焦虑症相互作用,它们之间存在密切联系[12]。大量研究结果显示慢性痛小鼠会出现焦虑样行为[13-14]。神经成像研究表明,几个不同大脑区域的5-HT系统参与慢性痛和焦虑样行为的产生和维持,但是各脑区的作用和联系尚不能确定。我们将主要围绕慢性痛和焦虑共病中DRN 5-HT能系统的神经环路和突触可塑性的神经机制进行综述。
1 慢性痛和焦虑共病中DRN 5-HT能系统的变化
DRN是脑内5-HT能神经元最为集中的核团,除了5-HT能神经元还存在GABA、谷氨酸、多巴胺(dopamine,DA)能神经元[15]。DRN和相邻近的腹外侧中脑导水管周围灰质(ventrolateral periaqueductal gray,vlPAG)共同参与了疼痛调节。DRN的DA和GABA能神经元通过作用于DRN和vlPAG内部以及下游神经通路,介导镇痛作用。激活DRN DA和GABA神经元诱导镇痛作用,对焦虑样行为没有影响[16]。DRN中5-HT能神经元的不同功能亚群具有不同作用。
1.1 慢性痛状态DRN 5-HT系统的变化
疼痛定义为一种与实际或潜在的组织损伤相关或与之类似的不愉快的感觉和情感体验[17]。脊髓背角脑干下行投射释放的5-HT在痛觉控制中至关重要,然而对于脊髓上行的5-HT系统是否以及如何影响大脑功能活动来参与慢性痛知之甚少。大脑中的5-HT能机制最初被认为与镇痛效应密切相关,大量临床和实验研究表明,5-HT能系统的调节作用现在被认为只是以一种辅助的方式在抗抑郁镇痛中发挥作用[18]。5-HT能神经元作为下行痛觉系统调节中主要神经元,其发挥易化或者抑制痛觉传递的效应与作用的受体亚型密切相关。5-HT1A、5-HT1B、5-HT2A、5-HT3以及5-HT7受体在外周主要介导镇痛作用[19],在神经病理性痛状态下,脊髓5-HT活动下降,5-HT1A能够缓解神经病理性痛[20];在中枢神经中,抑制前额叶皮层的5-HT2A能够降低坐骨神经损伤模型之后的机械触诱发痛[21],敲除眶腹外侧皮层的5-HT2A会加剧坐骨神经慢性压迫损伤模型(chronic constriction injury of the sciatic nerve,CCI)小鼠的痛觉过敏[22]。因此,由于受体亚型、疼痛类型以及持续时间的不同,5-HT受体对疼痛具有易化和抑制双向调控作用,机体的最终疼痛反应取决于各个通路的平衡。
1.2 焦虑共病中DRN 5-HT能经元和5-HT系统的变化
慢性痛会引起焦虑,反过来这种焦虑也会加剧疼痛[23]。杏仁核及其相关网络在生理焦虑中起着关键作用,而前扣带皮层及其相关网络参与了慢性痛引发的病理焦虑[24]。关于焦虑症的神经生物学的假设还有5-HT神经递质系统的功能障碍。焦虑状态下,5-HT系统活动减弱,5-HT水平下降[25];在神经病理性痛中,焦虑症状明显,血清中5-HT水平升高;在炎性疼痛模型中,焦虑样行为明显,皮层区域5-HT水平降低[26],同样地,CCI模型动物表现出明显焦虑样行为,且海马CA1区域5-HT水平明显降低[26]。焦虑症和慢性痛状态都可以通过使用影响5-HT系统的药物来治疗。临床研究表明,大麻二酚(cannabidiol,CBD)作为大麻的主要非成瘾性成分,与5-HT1A受体相互作用,可能具有镇痛和抗焦虑作用。低剂量CBD的重复治疗主要通过辣椒素受体激活诱导镇痛,通过5-HT1A受体激活减少焦虑样行为,并在神经病理性痛条件下挽救受损的5-HT神经传递[27]。
2 慢性痛和焦虑共病中DRN 5-HT神经环路机制
位于DRN的5-HT能神经元有吻侧投射分布至大脑皮质,边缘前脑结构(海马、杏仁核),基底神经节,许多下丘脑核以及丘脑区域。上行5-HT能系统在情绪行为和下丘脑功能调节中起到重要作用,下行5-HT能神经元对疼痛至关重要。
2.1 DRN传入神经通路
DRN主要接收来自于边缘系统、同侧小脑、导水管周围灰质和脊髓等部位的传入纤维,经缰核脚间束、前脑内侧束联系隔区、下丘脑视前区、额叶皮质的外侧缰核及脑桥中央皮质,参与了睡眠、觉醒、意识活动,并对躯体运动与感觉有一定的调节(表1)。
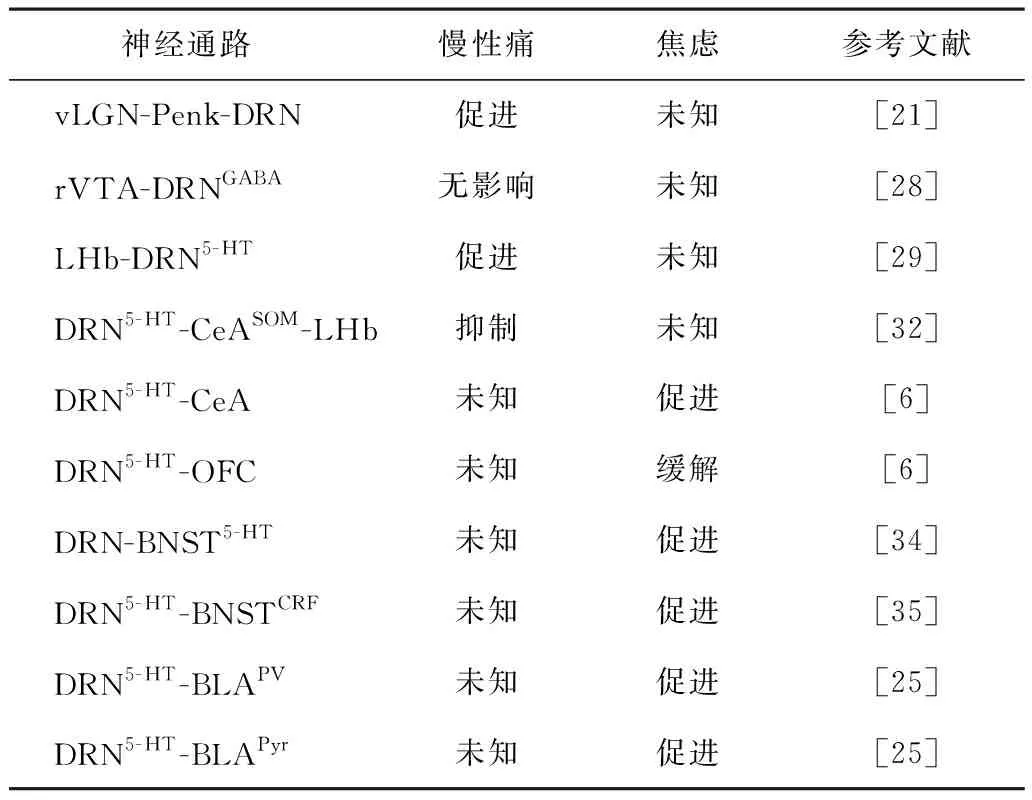
表1 慢性痛及焦虑共病中DRN 5-HT神经通路的可塑性变化
通常认为绿光能够缓解疼痛。研究发现,通过视网膜视锥/视杆细胞-腹外侧膝状核-前脑啡肽-DRN信号通路,全视野暴露绿光可缓解慢性痛小鼠的相关疼痛,产生明显的镇痛效果[21],也为疼痛干预通路机制提供了线索。
DRN和腹侧被盖区(ventral tegmental area,VTA)作为脑中参与调节情感、认知、记忆以及运动等功能的两个重要的核团,存在两条平行的抑制性神经通路。尾端腹侧被盖区到DRN的5-HT能神经元,头端腹侧被盖区(rostral ventral tegmental area,rVTA)到DRN的抑制性GABA能神经元。rVTA-DRNGABA特异性地参与吗啡成瘾,激活它可以显著降低对吗啡的耐受和成瘾,但不影响吗啡的镇痛效果[28]。
外侧僵核(lateral habenula,LHb)被认为是反奖励系统的中心。LHb的主要输出为DRN和中缝中核、中脑导水管周围灰质、VTA,其中DRN在下行疼痛调节中起着关键作用。在术后28 d出现严重抑郁样行为的CCI模型大鼠中,发现LHb神经元活动增加。通过化学损伤LHb,可以增加DRN中的5-HT功能,增加CCI模型大鼠的疼痛阈值,改善抑郁样行为[29]。LHb-DRN回路可能对与疼痛相关的焦虑也很重要。
2.2 DRN传出神经通路
DRN与前脑的大部分区域都有轴突连接[30]。在神经病理性痛状态下,神经损伤后,DRN 5-HT神经元的活动增强,这与在内侧前额叶皮质中进行微透析分析测量到的5-HT水平的升高相一致[31](表1)。
CeA和LHb的5-HT能投射在慢性痛调节和焦虑抑郁症中发挥重要作用。人类功能磁共振成像结果显示,在患有慢性痛的抑郁症患者中,DRN和CeA之间的功能连接显著降低,但在无抑郁的慢性痛患者中则没有。该研究还发现,DRN5-HT-CeASOM环路的活动在疼痛状态下降低,而DRN5-HT-CeASOM-LHb环路的激活可以逆转神经损伤引起的疼痛阈值的降低[32]。这也为疼痛的进一步治疗提供了希望。此外,CeA还代表了具有不同功能的不同细胞群,投射到CeA的5-HT能神经元在厌恶刺激下促进焦虑样行为,而投射到前脑的5-HT能神经元则促进积极的应对行为[6]。
与病理性焦虑和适应性焦虑有关的终纹床核(bed nucleus of the stria terminalis,BNST),其神经元之间存在异质性[33]。投射至BNST的5-HT对高架十字迷宫、足电击和第一次社会互动反应更多,这说明DRN-BNST的5-HT能够促进焦虑样行为[34]。而且DRN的5-HT能神经元还激活了BNST中的促肾上腺皮质激素释放因子(corticotropin-releasing factor,CRF)神经元亚群,并增强了恐惧和焦虑。BNST的CRF阳性神经元通过5-HT2C受体接受来自DRN的5-HT能神经元投射,并通过抑制抗焦虑的腹侧终纹床核(ventral bed nucleus of the stria terminalis,vBNST)-外侧下丘脑通路和腹侧终纹床核-腹侧被盖区通路,刺激DRN5-HT-BNSTCRF通路,从而增强焦虑样行为[35]。光刺激vBNST的谷氨酸能投射(vBNSTGlu)对VTA导致厌恶和焦虑样行为,而刺激vBNST的GABA能投射(vBNSTGABA)对VTA产生奖赏和抗焦虑行为[36]。
焦虑样行为包括对明亮空间的回避行为和社交回避[37]。最近的一项研究通过神经元亚群特异性揭示了DRN-基底外侧杏仁核(basolateral amygdala,BLA)存在两条不同的神经元投射通路,DRN中表达囊泡谷氨酸转运3(vesicular glutamate transporter type 3,vGluT3)阳性的5-HT能神经元-BLA的小清蛋白(parvalbumin,PV)神经元(DRNvGluT3∩5-HT-BLAPV)和DRNvGluT3∩5-HT-BLA的锥体神经元(pyramidal,Pyr)BLAPyr,并对小鼠的社会接触和焦虑样行为存在不同的调节作用。DRN5-HT∩vGluT3-BLAPV的激活通过BLA中5-HT末端的GABAB受体抑制5-HT的释放,诱导社交回避和对明亮空间的回避。DRN5-HT∩vGluT3-BLA通过不同的5-HT受体,以不同的方式抑制BLA的Pyr,通过5-HT1A受体直接抑制5-HTR1A的BLAPyr,通过5-HT1B受体抑制5-HTR1A的BLAPyr的谷氨酸传入[25]。这些信息突出了神经元分群和神经投射的特异性在调节单独的焦虑相关行为中的功能意义。
3 总结与展望
综上所述,近年来的研究进展表明,DRN 5-HT系统涉及疼痛信息和情感信息的传递。特别是在疼痛感知与传递过程中,能够将伤害性刺激经脊髓背角及上行神经通路传递至脊髓以上节段,经丘脑传递至大脑皮层,对感觉和焦虑情绪做出反应。DRN 5-HT能与脑内多个与疼痛和情绪相关脑区有复杂的投射系统,并富含多种神经递质,在疼痛与焦虑共病的调节中发挥了重要作用。5-HT作为一种重要的递质,其下行疼痛抑制途径中5-HT活性降低,促进敏化,焦虑样行为明显。虽然这些研究极大地提高了我们对DRN 5-HT神经元的生理和行为功能的理解,但仍存在许多问题。
越来越多的研究表明,即使在同一个大脑区域,也存在着功能的多样性和不同的连通性。两个分别位于皮层投射和皮层下投射的亚群,其5-HT神经元均能被奖赏信号激活,但是皮层投射群会被惩罚信号抑制,编码应对行为,而皮层下投射群则被惩罚信号激活,促进焦虑样行为[6]。在单个神经元水平上,单个DRN 5-HT神经元如何处理慢性痛与焦虑共病尚不清楚。空间转录组学研究整合了单个神经元的转录组谱和投射模式,将有助于进一步解决DRN 5-HT神经元之间的异质性。
未来将神经元亚群和投射特异性靶向与在体单细胞记录结合起来的研究也可能提供新的见解。DRN 5-HT神经元参与慢性痛及焦虑共病的分子和回路机制在很大程度上尚不清楚。最后,进一步分析DRN 5-HT神经元及其传出和传入通路的分子图谱,可能为开发未来干预慢性痛及抗焦虑的药物策略提供机会。
致谢:神经生物学教研室刘莹莹教授参与文章的讨论,并提出了宝贵的建议。
