慢性束缚应激对小鼠海马PD-1/PD-L1表达水平及炎症反应和氧化应激信号通路的影响
2023-12-01石青青马欣旭王艺霖陈海霞王化宁
石青青,刘 玲,马欣旭,张 甜,王艺霖,陈海霞,王化宁
(空军军医大学:1西京医院心身科,2基础医学院神经生物学教研室,陕西 西安 710032)
焦虑症是最常见的精神障碍之一[1],其症状范围广泛,多与其他精神疾病共病[2]。然而,其潜在的病理生理机制仍有待进一步探讨。目前越来越多的研究将炎症和氧化应激与焦虑症联系起来,被认为是导致焦虑症的重要机制[3-4]。海马是调节情绪的重要脑区之一,且与焦虑症的发病机制有关[5]。研究显示,焦虑模型小鼠海马的神经胶质细胞激活、促炎细胞因子释放和氧化应激水平升高[6-8]。程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)及其配体(programmed cell death ligand 1,PD-L1)在生理免疫稳态中起到核心作用,包括调节炎症反应和氧化还原平衡[9-10]。然而,其在焦虑症中的作用尚不明确。因此,本研究利用慢性束缚应激(chronic restraint stress,CRS)焦虑模型小鼠,观察PD-1/PD-L1在CRS小鼠海马中的表达水平变化以及对炎症和氧化应激相关指标的改变,为进一步揭示焦虑症的潜在分子机制提供新思路和理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄大小的清洁级雄性C57BL/6小鼠由空军军医大学实验动物中心提供。整个实验过程符合关于哺乳动物的饲养及使用规定,并获空军军医大学实验动物福利与伦理委员会批准(许可证号:KY201930030)。
1.1.2 主要试剂和仪器 低温高速离心机(Micro17/Micro17R,赛默飞世尔科技公司,美国);电泳仪(基础型电源164-5050,伯乐生命医学产品有限公司,美国);电转仪(半干转印槽170-3940,伯乐生命医学产品有限公司,美国);全自动化学曝光分析系统(COMPLEX 2000,南京巴傲得生物科技有限公司,中国);正置荧光显微镜(MF23-M,广州市明美光电技术有限公司,中国);超声破碎仪(Scientz-ⅡD,宁波新芝生物科技股份有限公司,中国);无水甲醇(67-56-1,天津市永大化学试剂有限公司,中国);超敏发光液(4AW011-200,北京四正柏生物科技有限公司,中国)。
1.2 方法
1.2.1 实验分组及步骤 24只雄性C57BL/6小鼠用聚丙烯PP材质的白色、不透明鼠笼进行饲养,在清洁级的动物房环境下适应性饲养小鼠1周。动物房的温度控制在22 ℃,湿度控制在55%,照明和黑暗每隔12 h进行交替循环。适应1周之后将实验小鼠随机分为正常组和模型组,每组12只。正常组不进行干预,模型组进行CRS刺激,每日束缚2 h(9∶00~11∶00),连续14 d,实验期间正常组小鼠正常进食和饮水,模型组小鼠造模期间禁食,禁水。造模开始后,每隔3 d记录小鼠的体质量变化,造模结束后24 h进行旷场和高架十字迷宫行为学实验,评估小鼠的焦虑样行为。行为学实验结束后,用异氟醚麻醉小鼠取出海马组织用于后续实验。
1.2.2 CRS模型构建 提前将50 mL的离心管烫出气孔平均分散于管壁,离心管盖子中间也烫出气孔,孔眼大小和小鼠尾巴粗细一致,用于后续造模的束缚管。造模开始前,确保束缚管的数量是足够的,造模开始后,将一只小鼠轻轻拿到干净的空笼子中,安抚并引导小鼠进束缚管,不可用暴力将小鼠推进束缚管。小鼠进去后,盖上离心管盖子,小鼠尾巴穿过盖子中心的小孔,模型组的每只小鼠按此方法进行束缚。束缚结束后,用纸巾擦拭干净小鼠身上的粪便和尿液,放回原笼中正常饲养,束缚管和盖子先用清水清洗干净,再泡在750 mL/L乙醇中15 min,放置在通风处晾干,下次使用。
1.2.3 旷场实验 旷场实验又称为敞箱实验,是评估实验小鼠自发活动能力、探索行为和紧张焦虑情绪的一种行为学测试。整个实验测试过程由摄像头进行录像和电脑控制,实验装置是由4个大小(50 cm×50 cm×100 cm)、形状一样的箱子组成,实验开始前先将实验小鼠提前放置在行为学实验室适应30 min,在此期间设置好电脑程序。开始实验时,将小鼠放置在箱子的中心,按下电脑开始键进行行为跟追、记录,每只小鼠实验10 min。一轮测试结束后,用乙醇擦拭箱底及箱体,防止对下一轮实验小鼠造成气味影响,导致实验误差。然后对跟踪视频进行数据分析,观察指标包括运动速度、运动距离、运动时间等。
1.2.4 高架十字迷宫实验 高架十字迷宫是评价实验小鼠焦虑状态的测评方法。实验装置由开臂和闭臂组成,各两条,大小为宽5 cm×长35 cm×高15 cm,迷宫离地面50 cm左右,实验全程由摄像头和电脑进行监控操作。实验开始前,将实验小鼠提前置于行为学实验室适应30 min,期间调试电脑程序。开始时将小鼠放置在开臂与闭臂交叉的中心位置,按下电脑开始键进行行为跟追录像,每只小鼠追踪记录10 min,实验结束后换下一只小鼠,每换一只小鼠都要用乙醇擦拭干净臂底和臂体,避免气味影响下只小鼠的实验结果。最后对实验视频进行分析、整理,统计实验指标包括进入开臂的次数、时间、百分比等。
1.2.5 蛋白免疫印迹 蛋白免疫印迹实验是把电泳分离的蛋白质转移到固体基质上,然后利用抗原-抗体反应检测特异性表达的蛋白分子的技术。实验步骤为:①凝胶配制:先配分离胶,根据所选用的分离胶浓度按量在烧杯混匀,倒入胶板中,大概4.5~5.0 mL,中间不能有气泡,甲醇或者750 mL/L乙醇压线后静置20~25 min;倒掉甲醇或者750 mL/L乙醇后,按量配制浓缩胶加在凝好的分离胶上,立刻插上梳子,静置20~25 min。②加样:将提前提取好的小鼠海马蛋白样品,按照定量的结果每孔上样量为20~30 μg,加样的顺序先正常组后模型组。③电泳:按照负极对负极,正极对正极,打开直流稳压电源,先调至80 V,待样品跑至分离胶与浓缩胶的分界线时,将电压改为120 V,溴酚蓝跑至底部1 cm处停止。④半干式转膜:用尺子将聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)裁剪成8 cm×6 cm大小,泡在甲醇中激活30 s左右,后将激活的PVDF膜、凝胶、厚滤纸按照厚滤纸(略大)-PVDF膜-凝胶-厚滤纸(略小)的顺序平铺在半干转盒子里,用滚轮按压赶走气泡,盖上盖子后装在半干转仪上进行电转,1.0 A恒流电转25 min。⑤封闭:将电转好的PVDF膜置于50 g/L脱脂奶粉(2.5 g的脱脂奶粉,50 mL的1×TBST溶液)的孵育盒中,室温下在水平摇床上孵育1.5~2.0 h。⑥一抗:封闭后的PVDF膜用1×TBST洗3次,每次10 min,洗涤期间用一抗稀释液配制要检测的目的蛋白对应的一抗PD-1(Abcam,1∶1 000,英国)、PD-L1(Abcam,1∶1 000,英国)、IL-1Ra(Abcam,1∶2 000,英国)、NF-κB(Abcam,1∶1 000,英国)、IL-1β(Abcam,1∶1 000,英国)、Nrf2(Proteintech,1∶500,美国)、Keap1(Proteintech,1∶2 000,美国)、HO-1(Abcam,1∶1 000,英国)和β-actin(Abcam,1∶5 000,英国),将不同大小分子量的目的条带与对应的一抗在4 ℃水平摇床上孵育12 h以上。⑦二抗:次日,将一抗回收,用1×TBST洗涤未被结合的一抗和杂质,洗3次,每次10 min,期间用1×TBST配制一抗所对应的二抗(兔二抗,Biorbyt,1∶10 000,英国),条带洗涤结束后与相应的二抗进行孵育,室温下在摇床上孵育1.5~2.0 h。⑧显影:二抗孵育结束用1×TBST洗3次,每次10 min,洗涤结束后配制显影液(A液∶B液=1∶1),条带正面朝上放在发光仪的载物台上均匀滴加显影液进行发光。⑨数据处理:曝出的条带用ImageJ软件进行量化分析,用GraphPad Prism软件进行数据处理。
1.2.6 免疫荧光染色 海马组织经糖水梯度脱水后,切成14 μm的薄片。将片子放在暗盒中室温静置30 min,用PBS清洗3次,每次8 min。清洗结束后,浸泡在抗原修复液中5 min,加入2 mL/L PBST,室温静置20 min后进行细胞打孔,室温下用10 g/L BSA封闭1.5 h。封闭结束后,PBS清洗片子3次,每次10 min,分别加入50 μL的一抗PD-L1(Abcam,1∶50,英国)和一抗PD-1(Abcam,1∶50,英国),4 ℃孵育过夜。次日,倒掉一抗,清洗片子3次,每次10 min,加入荧光兔二抗(Invitrogen,A32731,美国)室温孵育2 h。倒掉二抗,清洗片子3次,每次10 min,加入DAPI(Merck,D9542-1MG,美国)室温孵育10 min,清洗3次,每次6 min。封片,荧光显微镜下观察图片并拍照、分析。
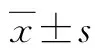
2 结果
2.1 CRS对小鼠体质量变化的影响
焦虑会导致体质量发生改变,从造模第1日开始,每隔3 d记录下两组实验小鼠的体质量变化,最后1 d造模结束24 h后测最后一次体质量。记录下的体质量结果显示,造模开始后正常小鼠的体质量缓慢增加,模型组小鼠的体质量则呈下降趋势,第0、3、6日两组小鼠的体质量变化无显著性差异,从造模第9日开始,相比正常组,第9、12、15日模型组小鼠的体质量与正常组相比出现显著性的下降(P<0.05,P<0.01,图1)。结果显示,CRS诱导的焦虑模型会导致小鼠体质量发生改变,使小鼠体质量减轻。
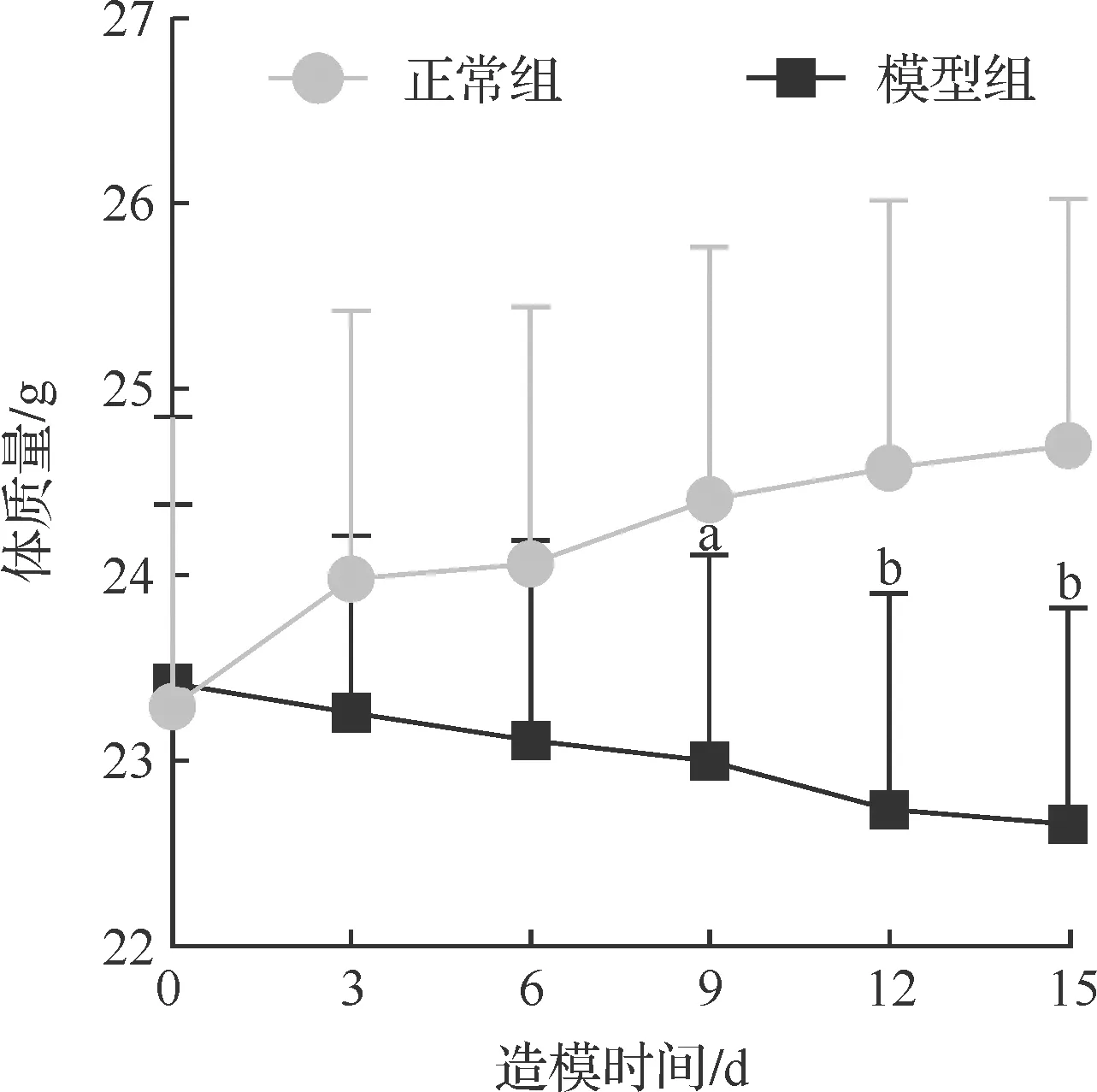
n=12;aP<0.05,bP<0.01 vs 正常组。图1 造模开始后两组小鼠体质量变化折线图
2.2 CRS对小鼠焦虑样行为的影响
旷场实验结果显示,与正常组小鼠相比,模型组小鼠在旷场中心停留的时间以及在中心区域活动的距离显著减少(P<0.01,P<0.05),去中心区域探索的次数也减少了,但无显著性差异,两组小鼠在旷场活动的总距离无太大变化(表1)。结果说明,CRS诱导的焦虑样模型小鼠,其自发活动能力及探索行为下降,提示出现了紧张焦虑的情绪。
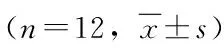
表1 两组小鼠旷场实验结果的比较
高架十字迷宫是比较经典的用来评估实验动物焦虑状态的实验,该实验结果显示,与正常组小鼠相比较,模型组小鼠在开臂的时间显著减少(P<0.01),进入开臂的次数以及在开臂探索的距离均显著减少(P<0.01),在开臂和闭臂总的运动距离也减少了,但无差异性变化(表2)。该结果以及旷场实验的结果表明,CRS诱导的焦虑样模型是成功的,使小鼠产生了焦虑样行为表现。
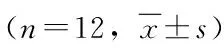
表2 两组小鼠高架十字迷宫实验结果的比较
2.3 CRS小鼠海马区相关炎症指标的变化
为了探究炎症反应在小鼠脑中的表达变化,行为学实验结束之后,收集海马组织,利用Western blotting技术观察相关炎症指标在两组小鼠海马中的表达水平。实验结果显示,与正常组相比,模型组PD-1和PD-L1的表达水平显著下调(P<0.01),NF-κB表达上调(P<0.01);与正常组相比,模型组抗炎细胞因子IL-1Ra降低,相反,促炎细胞因子IL-1β上升,但无显著性变化(图2)。结果表明,在焦虑小鼠海马中PD-1/PD-L1的表达水平发生了改变,且相关炎症分子也发生了变化,提示焦虑可能会触发某一炎症信号,导致炎症反应。
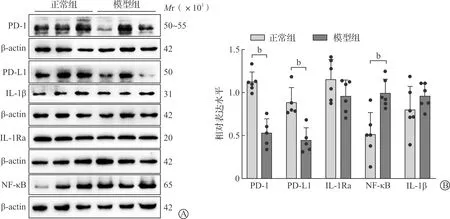
A:5个炎症指标的免疫印迹条带图;B:免疫印迹条带的灰度值分析结果统计(n=6;bP<0.01)。图2 两组小鼠海马区相关炎症指标的表达水平
2.4 CRS小鼠海马齿状回(dentate gyrus,DG)区PD-1/PD-L1阳性细胞的表达变化
进一步,我们利用免疫荧光直接观察了小鼠海马DG区PD-L1和PD-1阳性细胞的表达情况。荧光结果显示,与正常组小鼠相比,模型组小鼠的PD-L1和PD-1阳性细胞较少(图3A、C)。进一步定量结果显示,与正常组相比,模型组小鼠的PD-L1和PD-1阳性细胞数量显著降低(图3B、D,P<0.05)。该结果与PD-L1和PD-1的蛋白表达结果相一致,说明焦虑会导致小鼠脑内PD-L1和PD-1的表达改变。
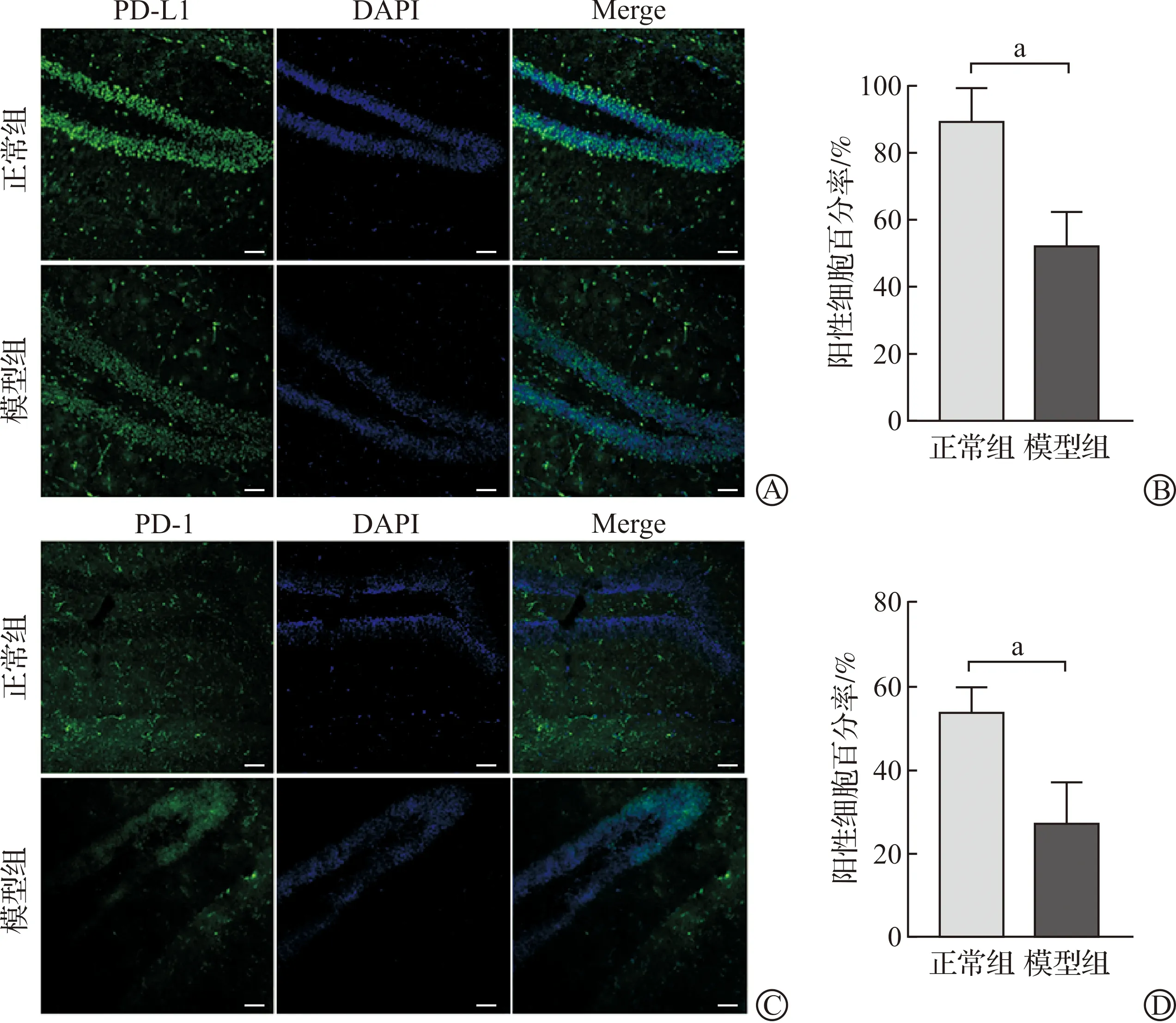
A:PD-L1的免疫荧光图片;B:PD-L1的阳性细胞定量分析;C:PD-1的免疫荧光图片;D:PD-1的阳性细胞定量分析。DG:海马齿状回。n=3;aP<0.05,标尺为100 μm。图3 两组小鼠海马DG区PD-L1和PD-1阳性细胞的表达
2.5 CRS小鼠海马区氧化应激通路相关指标的变化
紧接着,同样用Western blotting技术检测了CRS小鼠海马区氧化应激通路Nrf2/Keap1/HO-1的蛋白分子表达变化。结果显示,与正常组相比较,模型组Nrf2、Keap1和HO-1的蛋白表达水平均显著降低(P<0.05,P<0.01,图4)。结果说明,CRS会导致氧化应激发生,提示焦虑除了会激活炎症反应还会导致氧化还原失衡。
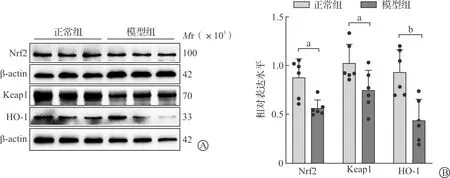
A:3个氧化应激指标的免疫印迹条带图;B:免疫印迹条带的灰度值分析结果统计(n=6;aP<0.05,bP<0.01)。图4 两组小鼠海马区氧化应激通路相关蛋白分子的表达水平
3 讨论
据报道,超过30%的成人和青少年在他们的一生当中出现过焦虑症状,25%~80%入院接受手术的患者经历过术前焦虑,焦虑所带来的负面情绪和状态已严重影响人们的生活质量[11]。CRS动物模型常用于探索慢性应激引起的焦虑的发病机制和病理生理学[12]。有文献显示,小鼠束缚应激14 d,每日6 h,可导致小鼠出现明显的焦虑样行为[13]。另有文献表明,每日束缚应激2 h,连续21 d,可导致小鼠产生焦虑和抑郁样行为[14]。通过文献,本实验每日给予小鼠束缚应激14 d,每日2 h,行为学结果显著。与正常组小鼠相比,模型组小鼠去中心探索的次数、在中心区域停留的时间以及在中心活动的距离显著下降,并且模型组小鼠在高架十字迷宫实验中去开臂的次数、在开臂停留的时间和在开臂运动的距离也减少了。行为学结果表明,给予小鼠束缚应激一段时间,可导致小鼠出现焦虑样行为。此外,我们在14 d的束缚应激期间还记录了小鼠每隔3 d的体质量变化,结果发现,模型组小鼠的体质量相比正常组是下降的,且造模第9日开始后模型组与正常组小鼠体质量出现显著性的差异,该结果与焦虑引起体质量减轻的报道是一致的[15-16]。
海马是哺乳动物大脑中维持新神经元生成的区域之一,成人海马神经发生与学习和记忆以及情绪调节有关[17]。然而,成人海马神经发生非常容易受到应激的影响[18],因此,成人海马神经发生的改变与应激引起的心理障碍如焦虑症、抑郁症和恐慌症等密切相关[19]。研究表明,腹侧海马(ventral hippocampus,vHPC)参与调节焦虑样行为[11]。一项研究利用光遗传学或药物刺激vHPC区域发现vHPC双侧受损会增加小鼠的焦虑样行为[20]。根据已有文献报道,海马是研究焦虑的关键且重要的区域之一,尤其是海马的DG区域与神经炎症有密切的联系[8,21-22]。越来越多的证据表明,应激会增加炎症,而炎症是许多疾病的关键介质[23-24]。在慢性应激下,小胶质细胞会释放促炎细胞因子IL-1β,从而加剧应激动物的焦虑样行为,而细胞因子IL-1β被抑制后则可以逆转小鼠的焦虑样行为[25-26],此外,IL-1Ra是IL-1β的天然抑制剂,给予焦虑小鼠IL-1Ra治疗,同样可以减少IL-1β的表达水平[26]。与该报道一致,我们的Western blotting结果显示,CRS之后,小鼠海马中的IL-1Ra与IL-1β的蛋白表达水平趋势相反,无显著性变化的原因可能是小鼠组内差异较大。除此之外,NF-κB是介导炎症反应的主要转录因子之一,活化的NF-κB易位进入细胞核后,会触发更多促炎细胞因子如IL-1β、TNF-α等的表达[27]。研究表明,束缚应激可以上调皮层中的NF-κB水平并增加前额叶皮层和海马中的JNK和p38 MAPK的表达。我们的结果显示,模型组小鼠海马中NF-κB的表达水平显著高于正常组,说明焦虑会激活NF-κB活性,进一步触发炎症信号,从而加剧焦虑样行为。PD-1/PD-L1两者是受体与配体的关系,主要在肿瘤微环境内免疫耐受的诱导和维持中发挥着重要的作用,PD-1及其配体PD-L1或PD-L2负责癌症中T细胞的活化、增殖和细胞毒性分泌,从而降低抗肿瘤免疫反应[28]。PD-L1在小胶质细胞和星形胶质细胞中均有表达,可由各种促炎细胞因子如IFN-γ、TNF-α、VEGF和IL-10诱导,也可由TLR、IRF1、STAT1、STAT3诱导,且PD-1/PD-L1抑制通路在小胶质细胞的炎症反应中发挥作用[29-30],但目前人们对PD-1/PD-L1在焦虑症患者或在焦虑模型小鼠中的表达变化以及炎症反应的潜在机制尚无报道。而本实验通过Western blotting验证发现PD-1/PD-L1在应激小鼠中的表达是下调的,进一步又通过免疫荧光直接观察了PD-1/PD-L1在海马DG区的阳性细胞数量,与蛋白表达结果一致。此结果对后续探讨PD-1/PD-L1在焦虑疾病中的分子机制有着非常重要的作用,后续实验我们将进一步明确PD-1/PD-L1在焦虑样小鼠中可能的分子机制。
氧化应激常常伴随炎症反应发生,两者均是焦虑等精神疾病的典型病理特征[31]。一项动物实验结果表明,CRS会诱导氧化应激,并显著改变大脑中促氧化剂和抗氧化因子之间的平衡[32]。Nrf2/Keap1/HO-1信号通路是重要的抗氧化通路,参与调节氧化系统和抗氧化系统之间的平衡[32]。当氧化应激被激活时,Nrf2与Keap1解离,并进一步转移到细胞核,启动抗氧化蛋白HO-1的转录,并抑制NF-κB的活性[33-34]。我们的结果显示,与正常组小鼠相比,CRS之后的小鼠海马中Nrf2、Keap1和HO-1的蛋白表达水平显著降低,而NF-κB的表达水平显著升高。该结果进一步证实,在焦虑模型小鼠中出现了氧化与还原的失衡,激活了氧化应激信号通路。
综上所述,CRS诱导会引起小鼠的体质量减轻,使小鼠产生焦虑样行为,还会触发炎症反应和氧化应激信号通路。此外,我们还观察到PD-1/PD-L1在焦虑小鼠海马中下调这一现象。本研究为研究焦虑症的分子病理机制提供了新思路和理论基础。后续我们将会通过药物干预、基因干预等手段进一步探索PD-1/PD-L1在焦虑模型小鼠脑中的作用及其与炎症和氧化应激通路关系的可能分子机制。
