基于网络药理学和实验验证研究高良姜素乳膏抗白癜风的作用机制
2023-12-01祖力皮卡尔吾斯曼张数数李治建霍仕霞
祖力皮卡尔·吾斯曼 张数数 闫 明 李治建 霍仕霞
1.新疆医科大学药学院,新疆乌鲁木齐 830011;2.新疆维吾尔自治区维吾尔药物研究所,新疆乌鲁木齐 830049;3.新疆维吾尔自治区维吾尔医医院,新疆乌鲁木齐 830049
白癜风是一种常见的黑素细胞缺失导致皮肤出现色素脱失斑的色素障碍性皮肤病,患病率为0.5%~2.0%,其病因尚未确定[1]。目前临床上治疗白癜风的方法有手术、光疗[2]、外用激素[3]、口服免疫抑制剂[4]及抗氧化剂[5]等,虽然有一定的效果,但也有一定的副作用。高良姜素(Galangin,GA)是从高良姜的根部提取的一种天然黄酮(3,5,7-三羟基黄酮),具有抗肿瘤[6]、抗氧化[7]和抗感染[8]活性。本课题组前期研究发现,GA具有促进黑色素合成的作用[9]。本研究运用网络药理学[10-11]及分子对接等分析方法,对GA 乳膏抗白癜风作用机制进行研究,以期为白癜风治疗药物的开发及临床应用提供参考。
1 材料与方法
1.1 网络药理学
1.1.1 作用靶点的筛选 运用Swiss Target Prediction 数据库,获取其吸收、分布、代谢、排泄和毒性水平,并结合中药系统药理学数据库与分析平台的中药动学参数筛选标准对GA 靶点进行筛选。
1.1.2 构建白癜风疾病靶点数据库 利用TTD、OMIM、DrugBank 数据库,以“vitiligo”为关键词,检索与白癜风相关的基因,构建白癜风疾病靶点数据库。
1.1.3 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建 用R 语言进行维恩图映射交集处理药物和疾病靶点,将药物和疾病靶点输入String平台(https://cn.string-db.org/),通过Cytoscape 3.7.1 寻找核心靶点,构建药物-疾病靶点PPI 网络。
1.1.4 基因富集分析 为了阐明GA 治疗白癜风的作用,将得到的核心靶标进行GO 富集分析和KEGG 信号通路富集分析。
1.1.5 分子对接 借助ZINC 数据库(http://zinc.docking.org/)下载GA 的3D 结构,作为对接配体。采用Auto Tools 对核心靶点晶体结构蛋白进行预处理,作为分子对接的受体。以配体和受体使用Autodock Vina 1.2进行对接,最后取优势构象进行分析,对接结果中Vina 分值≤-4.5,说明关键靶点与化合物的结合能力较好[12]。
1.2 动物实验材料
1.2.1 实验动物 选取60 只4 周龄SPF 级雄性C57 BL/6 小鼠,体重(21±3)g,购自湖南精达实验动物有限公司。实验动物生产许可证编号:SCXK(湘)2019-0004。本实验经新疆医科大学动物伦理委员会批准(IACUC-20211118-03),动物接收后饲养在屏障系统内,适应性喂养1 周,每笼5 只,自由进食、进水。
1.2.2 主要试剂与仪器1%GA 乳膏(20190910),规格为20 g/支,淡黄色膏体,由新疆维吾尔自治区维吾尔药物研究所提供。1%8-甲氧补骨脂素(8-methoxypsoralen,8-MOP)(重庆华邦制药股份有限公司,M861678);10%H2O2溶液(河南标准物质研发中心,MY15480)。酶联免疫吸附试验试剂盒购自上海酶联生物技术有限公司,包括内皮素-1(endothelin-1,ET-1)(210620),白细胞介素-18(interleukin-18,IL-18)(210715),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(210723)。BCA 蛋白定量试剂盒(WB0028)、TBST(WB0043)均购自天德瑞生物科技有限公司。Trizol(美国Thermo,15596026);ET-1 一抗(美国Abcam,ab2786);TNF-α一抗(北京博奥森生物技术有限公司,bs-2081);二抗HPR goat anti-mouse IgG(美国Sigma,SA00001-1);mRNA 逆转录试剂盒(北京康为世纪有限公司,CW 2569)。引物均由上海生工公司合成。ET-1 引物序列:正向引物为5’-GAAGTTGACGCACAACCGAG-3’,反向引物为5’-CTCTGCCCGTCTGAACAAGA-3’;IL-18引物序列:正向引物为5’-TCAGCTGGGAAAACTCAGGA-3’,反向引物为5’-AGCTAATGTGACGCACTGGG-3’;TNF-α 引物序列:正向引物为5’-AGCACAGAAAGCATGATCCG-3’,反向引物为5’-CACCCCGAAGTTCAGTAGACA-3’。实时荧光定量PCR 仪(美国Thermo,PIKOREAL96);台式低速离心机(湖南湘仪实验室仪器开发有限公司,L-420)。
1.2.3 药物的制备 制备低(1%)、中(2%)、高(4%)剂量GA 乳膏,在原有乳膏的基础上提高GA 含量,称取各辅料,将所需的油相及水相分别放入不同的烧杯,在85℃的水浴中融化并均匀化。将油相慢慢倒入水相中,以600 r/min 的速度搅拌5 min,冷却至室温,浓缩后得到不同剂量的GA 乳膏。
1.3 动物实验方法
1.3.1 动物分组及干预 选取10 只小鼠设为正常对照组,其余50 只将背部2 cm×2 cm 区域剃毛,剃毛1次/3 d。剃毛区域均匀涂抹10%H2O2构建白癜风动物模型[13],以造模区域毛发颜色变化及皮肤白斑情况确认造模成功[14]。造模成功后按随机数字表法将其分为模型组、阳性药组及GA 乳膏低、中、高剂量组,每组10 只。GA 乳膏各剂量组在造模区进行涂抹给药,1 g/次,1 次/d;阳性药组灌胃8-MOP4.25 mg/kg,2 次/d,间隔时间为6 h,连续给药30 d。模型组及正常对照组不进行干预。
1.3.2 血液和皮肤样本的制备 实验结束后,采集血样,静置1 h 后在4℃的条件下分离血清,用手术刀在小鼠造模区域皮肤进行1.5 cm×1.5 cm 的切取,将皮肤组织样本部分放在4%多聚甲醛中,部分储存在-80℃冰箱中。
1.3.3 组织病理学检查 取小鼠造模部位的皮肤,用石蜡块包裹,并切成3~5 μm 的切片,用苏木精-伊红染色。
1.3.4 血清ET-1、TNF-α 及IL-18 检测 用酶联免疫吸附试验试剂盒检测血清中的ET-1、TNF-α 及IL-18。
1.3.5 Western blot 分析 使用BCA 蛋白测定试剂盒测定皮肤组织中的蛋白浓度,将组织样品(50 μg)煮沸5 min,装入10%的聚丙烯酰胺凝胶,然后转移到PVDF 膜上。用三缓冲盐水加TBST 缓冲液和3%的牛血清白蛋白在室温下将膜封锁1 h。将膜与一抗(稀释度1∶500)在4℃下孵育过夜,用TBST(3~5 次)冲洗5 min,然后与二抗(稀释度1∶1 000)在室温下孵育1 h,用TBST(3~5 次)冲洗5 min。采用增强型化学发光法检测印迹,使用图像分析软件对照β-actin 蛋白确定蛋白条带的密度。
1.3.6 RT-qPCR 分析 依试剂盒说明书制备PCR 体系:反转录产物2 μl,Primer A(10 μmol/L)1 μl,Primer B(10 μmol/L)1 μl,ddH2O 11 μl,2X SYBGREEN PCR Master Mix 15 μl,共30 μl。将制备完成的PCR 反应管放入实时荧光定量PCR 仪内,在95℃预变性15 s,然后以95℃15 s,60℃30 s,70℃15 s 循环40 次进行PCR 反应,以2-ΔΔCt法计算mRNA 表达量。
1.4 统计学方法
采用GraphPad Prism 8.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,比较采用t 检验;多组计量资料比较采用单因素方差分析,组间两两比较采用LSD-t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 GA 作用靶点筛选
SwissTargetPrediction 数据库分别输入GA 的mol2结构式获取蛋白作用靶点,经蛋白质数据库Uniprot校验后根据z’score>0 得到最终符合条件的17 个基因靶点:NOS2、ET1、ARNT、PTGS2、DPP6、TNF、BCL2、CDk4、CDk1、CYP1A1、IL18、GSTP1、ARNT、NLRP3、IL1β、Casp1、TYR。
2.2 白癜风候选靶点
以“vitiligo”为关键词,应用数据库查相关疾病靶点。经整理合并后共得到459 个靶点,映射交集处理结果显示,获得GA-白癜风交集靶基因有10 个。见图1。

图1 GA-白癜风交集靶基因维恩图
2.3 PPI 网络构建
GA 治疗白癜风靶点及其功能的PPI 网络图共有10 个节点,25 条边,平均节点自由度为5,酪氨酸酶、NOD 样受体热蛋白结构域相关蛋白3、诱导性一氧化氮合酶、TNF、IL-1β、IL-18 等为核心靶点。见图2。
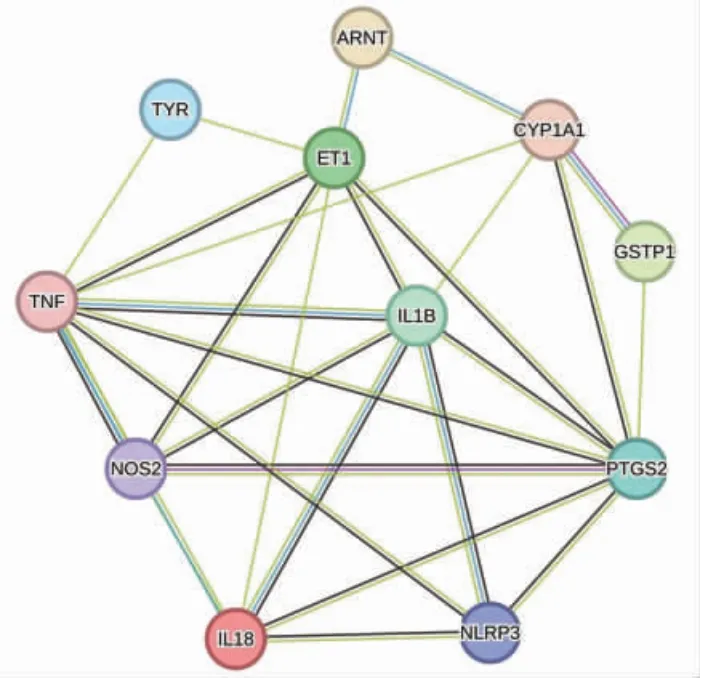
图2 GA 治疗白癜风靶点的蛋白质-蛋白质相互作用网络
2.4 GO 功能富集分析及KEGG 通路分析
药物疾病交集核心靶点进行GO 富集分析及KEGG 通路富集分析,前10 的途径见图3,对富集得到的通路结果见图4。结果显示,GA 中有效成分可能通过核因子κB、NOD 样受体及HIF-1 通路等发挥治疗白癜风的作用。

图3 GA 治疗白癜风核心靶点GO 富集分析

图4 GA 治疗白癜风核心靶点KEGG 通路富集分析
2.5 GA 抗白癜风关键靶点分子对接
将筛的3 个关键靶点的空间结构与GA 的分子结构进行分子对接,结果显示,GA 与ET-1、TNF-α 和IL-18的对接结合能分别为-4.6、-8.2 和-7.2 kcal/mol。见图5。

图5 GA 与作用于白癜风关键靶点的分子对接
2.6 六组皮肤组织染色
正常对照组皮肤无明显异常。模型组皮肤与正常对照组比较,表皮棘层皱襞变厚,毛囊破损及角质层明显增生。GA 乳膏各剂量组表皮虽有轻微棘层皱襞,与模型组比较明显改善。见图6。
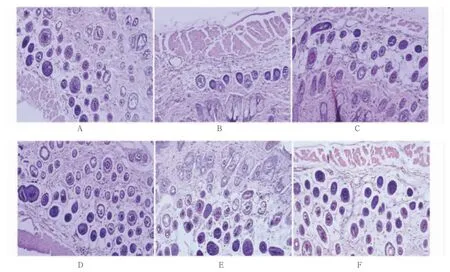
图6 六组皮肤组织苏木精-伊红染色(100×)
2.7 六组血清ET-1、TNF-α 及IL-18 水平比较
模型组血清ET-1、IL-18、TNF-α 水平高于正常对照组,GA 乳膏低、中、高剂量组血清ET-1、IL-18、TNF-α 水平低于模型组(P<0.05)。见图7。
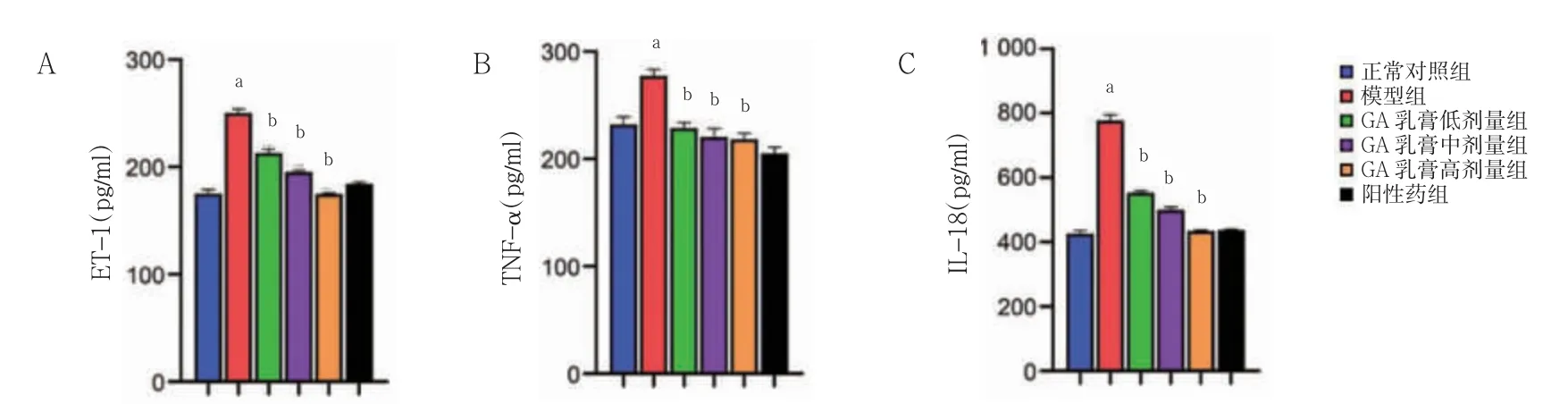
图7 六组血清ET-1、TNF-α 及IL-18 水平比较(n=10)
2.8 六组皮肤组织中ET-1 和TNF-α 蛋白表达比较
模型组皮肤组织中ET-1、TNF-α 蛋白表达高于正常对照组(P<0.05)。GA 乳膏高剂量组皮肤组织ET-1蛋白表达低于模型组,GA 乳膏中、高剂量组皮肤组织TNF-α 蛋白表达低于模型组(P<0.05)。GA 乳膏中、高剂量组皮肤组织TNF-α 蛋白表达低于GA乳膏低剂量组,GA 乳膏高剂量组皮肤组织ET-1 蛋白表达低于GA 乳膏低剂量组(P<0.05)。见图8。
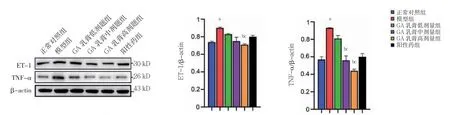
图8 六组皮肤组织中ET-1 和TNF-α 蛋白表达比较(n=10)
2.9 六组皮肤组织中ET-1、TNF-α 及IL-18 mRNA表达比较
模型组皮肤组织中ET-1、IL-18、TNF-α mRNA表达高于正常对照组,GA 乳膏低、中、高剂量组皮肤组织ET-1、TNF-α mRNA 表达低于模型组,GA 乳膏中、高剂量组皮肤组织IL-18 mRNA 表达低于模型组和GA 乳膏低剂量组(P<0.05)。见图9。

图9 六组皮肤组织中ET-1、TNF-α 及IL-18 mRNA 表达比较(n=10)
3 讨论
白癜风是一种自身免疫介导的炎症性皮肤病,全身任何部位的皮肤均可发生,但好发于易受摩擦、阳光暴晒的暴露部位及褶皱部位[15-16]。白癜风发病的关键是黑素细胞合成黑素功能的减退和缺失[17]。本研究运用网络药理学的方法,探讨了GA 及其作用靶点的相关性,GA 中存在1 个活性成分与多个核心靶标作用的现象,体现了中药多成分与多靶标之间共同作用的机制,得出ET-1、TNF-α 及IL-18 是GA 治疗白癜风的关键靶点。
黑素细胞旁分泌网络与黑素细胞功能减退密切相关[18],黑素细胞旁分泌网络是一个复杂的系统[19],对其功能具有重要调节作用[20]。ET-1 已被证实在白癜风的发生发展过程中扮演着重要的角色[21]。本研究结果显示,GA 乳膏治疗可显著降低白癜风模型动物血清和皮肤组织中ET-1 的表达水平。
TNF-α 是一种由活化的单核巨噬细胞释放的炎症因子,可对黑素细胞产生细胞毒性作用,进而抑制黑素细胞色素生成[22]。白癜风患者TNF-α 水平高于正常人,TNF-α 高表达可诱导角质形成细胞凋亡,诱发白癜风[23]。本研究结果显示,GA 乳膏治疗可显著降低白癜风模型动物血清和皮肤组织中TNF-α 蛋白及其mRNA的表达水平,发挥显著的抗黑素细胞凋亡的作用。
IL-18 水平的升高可促进和诱导γ 干扰素及CD8+T 细胞活性而参与白癜风的炎症反应及发病过程[24]。ET-1 通过p38 MAPK 通路依赖性机制诱导IL-18 的表达[25]。本研究结果提示,GA 乳膏可显著降低白癜风模型动物血清IL-18 水平及其mRNA 在皮肤组织中的表达水平。
综上,本研究基于网络药理学,通过关联网络构建及分析,初步阐释了GA 治疗白癜风的作用机制。实验研究结果显示,GA 乳膏很可能通过增加黑素细胞旁分泌网络ET-1 及炎症因子TNF-α、IL-18 表达发挥作用,为后续研究白癜风的作用机制提供了研究基础。
