不同药物方案治疗儿童川崎病疗效和安全性的网状Meta分析Δ
2023-12-01黄小惠吕智濠黄裕立南方医科大学顺德医院佛山市顺德区第一人民医院儿科广东佛山58300南方医科大学顺德医院佛山市顺德区第一人民医院心血管内科广东佛山58300
陈 昶 ,黄小惠 ,吕智濠 ,黄裕立 #[.南方医科大学顺德医院(佛山市顺德区第一人民医院)儿科,广东佛山 58300;.南方医科大学顺德医院(佛山市顺德区第一人民医院)心血管内科,广东 佛山 58300]
川崎病(Kawasaki disease,KD)是一种多发于5岁以下儿童的急性血管炎,主要影响中型血管,可导致患儿发生冠状动脉瘤(coronary artery aneurysms,CAA)等严重心血管并发症[1]。KD是儿童期第二常见的血管炎,发生率仅次于过敏性紫癜[2]。一项上海地区50 家医院参与的研究结果显示,5 岁以下儿童的KD 发病率由2013年的0.688%上升到了2017年的1.073%[3],呈逐渐上升的趋势。
目前,大部分指南推荐单次静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)2 g/kg 和口服阿司匹林[起始剂量30~50 mg/(kg·d),美国指南推荐可提高剂量至80~100 mg/(kg·d),热退48~72 h则可降至3~5 mg/(kg·d)]作为KD 的标准疗法[4―5]。虽然IVIG 联合阿司匹林可迅速降低KD 患儿的炎症标志物,缓解发热并降低CAA的发生风险,但仍有10%~15%的患儿会持续发热,即发生IVIG 抵抗[1]。IVIG 抵抗儿童发生CAA的风险较高[6]。针对IVIG 抵抗,有学者提出,可加用糖皮质激素、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)抑制剂、环孢素等药物方案强化治疗[7―9]。但这些研究大多仅限于某一新型疗法与标准疗法的对比,对不同疗法间的疗效差异缺乏全面的比较。基于此,本研究采用网状Meta分析的方法比较了不同药物治疗方案用于儿童KD 的疗效和安全性,旨在为临床治疗提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型
本研究纳入的文献类型为国内外公开发表的随机对照试验(randomized controlled trial,RCT),语种为中文和英文。
1.1.2 研究对象
本研究纳入的患者为KD患儿,均符合《川崎病诊断指南第6 次修订版》[5]或《2017AHA 科学声明:川崎病诊断、治疗和长期管理》[4]的诊断标准。
1.1.3 干预措施
试验组患儿给予新型疗法,即在标准IVIG 疗法的基础上给予糖皮质激素或TNF-α抑制剂或环孢素,可在初始阶段使用(以下简称“糖皮质激素疗法”“TNF-α 抑制剂疗法”“环孢素疗法”),亦可在第二阶段使用(以下简称“补救性糖皮质激素疗法”“补救性TNF-α抑制剂疗法”“补救性环孢素疗法”);对照组患儿给予标准IVIG疗法,即在初始阶段静脉注射IVIG 2 g/kg,若用药后36~48 h 仍有发热,明确为IVIG 抵抗后,再静脉注射IVIG 2 g/kg作为二线补救治疗。
1.1.4 结局指标
本研究的主要结局指标为4~8 周CAA 发生率,根据KD 患儿治疗4~8 周时的超声心动图判定。次要结局指标包括:(1)初始IVIG 抵抗发生率,即初始阶段IVIG使用后36~48 h后仍有发热的KD患儿比例,在排除其他原因后,判定为初始IVIG 抵抗;(2)不良反应发生率,不良反应包括一般不良反应及严重不良反应,如皮疹、呕吐、感染、电解质紊乱、高血压和休克等。
1.1.5 排除标准
本研究的排除标准包括:(1)Meta分析、系统综述类文献;(2)理论、病例报告、综述、会议论文;(3)仅有摘要的文献;(4)重复发表的文献;(5)试验设计不符合RCT要求的文献;(6)不包括所需要的效应指标或结局指标数据不完整的文献。
1.2 文献检索策略
采用PICOS原则,计算机检索the Cochrane Library、PubMed、Embase、CINAHL、Web of Science、ProQuest、Google学术、中国知网、万方数据、百度学术数据库和世界卫生组织国际临床试验注册平台、ClinicalTrials.gov等。中文检索词为“川崎病”“皮肤黏膜淋巴结综合征”“川崎综合征”“糖皮质激素”“甲基强的松”“泼尼松”“环孢素”“肿瘤坏死因子α 抑制剂”“依那西普”“英夫利昔单抗”“冠状动脉瘤”“冠状动脉异常”;英文检索词为“Kawasaki disease”“lymph node syndrome mucocutaneous”“Kawasaki syndrome” “glucocorticoid”“methylprednisolone”“prednison”“cyclosporine”“ciclosporin”“tumor necrosis factor-alpha inhibitor” “etanercept”“infliximab” “coronary aneurysms”“coronary artery diseases”“coronary artery aneurysms”“coronary artery lesion”。检索时限均为建库至2023年2月28日。采用主题词与自由词相结合的方式进行检索。
1.3 文献筛选与数据提取
分别由2 名研究者独立对文献进行筛选和数据提取,如遇分歧,由第3名研究者判断。提取资料包括:第一作者、发表时间、干预措施、结局指标等。
1.4 纳入文献质量评价
采用Cochrane 协作网提供的5.4.1 偏倚风险评估工具对纳入文献质量进行评价,具体包括:选择偏倚、分配隐藏偏倚、实施偏倚、测量偏倚、随访偏倚、报告偏倚、其他偏倚;每个条目均分为高风险、低风险和不清楚[10]。
1.5 统计学方法
采用Stata 14.2 软件进行网状Meta 分析,并绘制证据关系图。数据采用相对危险度(relative risk,RR)及其95%置信区间(confidence interval,CI)表示。采用I2检验分析各研究间的异质性,若I2<50%和P>0.1,表示各研究间无统计学异质性,采用固定效应模型进行Meta分析后,再进行网状Meta分析;反之,表示各研究间统计学异质性较大,分析造成异质性的原因,在排除异质性因素后,采用随机效应模型进行Meta分析,最后再进行网状Meta分析。
当存在闭合环时,通过节点分裂法不一致性检验确定是否存在不一致性,P>0.05表示一致性良好,采用一致性模型进行分析,反之则采用不一致性模型进行分析;当无闭合环时,勿需进行一致性检验。采用累计排序曲线下面积(surface under cumulative ranking curve,SUCRA)评价各干预措施的优劣性,SUCRA越大表示结局指标发生率越低,对应方案越有利于受试者[11]。通过绘制比较-校正漏斗图判断该研究是否存在发表偏倚或小样本研究效应。检验水准α=0.05。
2 结果
2.1 文献筛选结果与纳入研究基本信息
初检共获得文献2 632篇,经阅读题目、摘要及全文后,最终纳入10 篇文献[12―21],共计1 323 例患儿,其中试验组651例、对照组672例;共涉及6种干预措施,分别为标准IVIG 疗法、糖皮质激素疗法、环孢素疗法、TNF-α抑制剂疗法、补救性糖皮质激素疗法、补救性TNF-α 抑制剂疗法。文献筛选流程见图1,纳入文献基本信息见表1(文献[18]中,有2 例患儿因输注3 剂次标准剂量IVIG 后仍发热持续而退出,其他文献均无因治疗退出者)。

表1 纳入文献基本信息

图1 文献筛选流程图
2.2 纳入文献质量评价结果
所有文献均为RCT[12―21]。9项研究描述了随机序列产生的方法[12―16,18―21],6 项研究描述了分配隐藏方案[14,16,18―21],3 项研究采用了双盲[13,16,19],7 项研究对研究者使用了盲法[12―16,18―19]。结果见图2、图3。
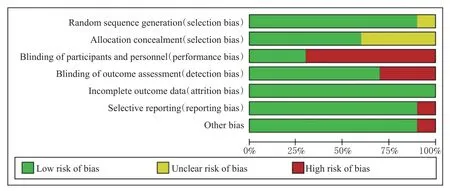
图2 偏倚风险条形图

图3 偏倚风险总图
2.3 网状Meta分析结果
2.3.1 各结局指标的证据关系图
针对3个结局指标,各干预措施间均未形成闭合环,不需要进行不一致性检验。结果见图4(图中,圆圈表示各干预措施,其大小表示采用这种措施的患儿数,每条直线的粗细表示进行直接比较的研究数量)。
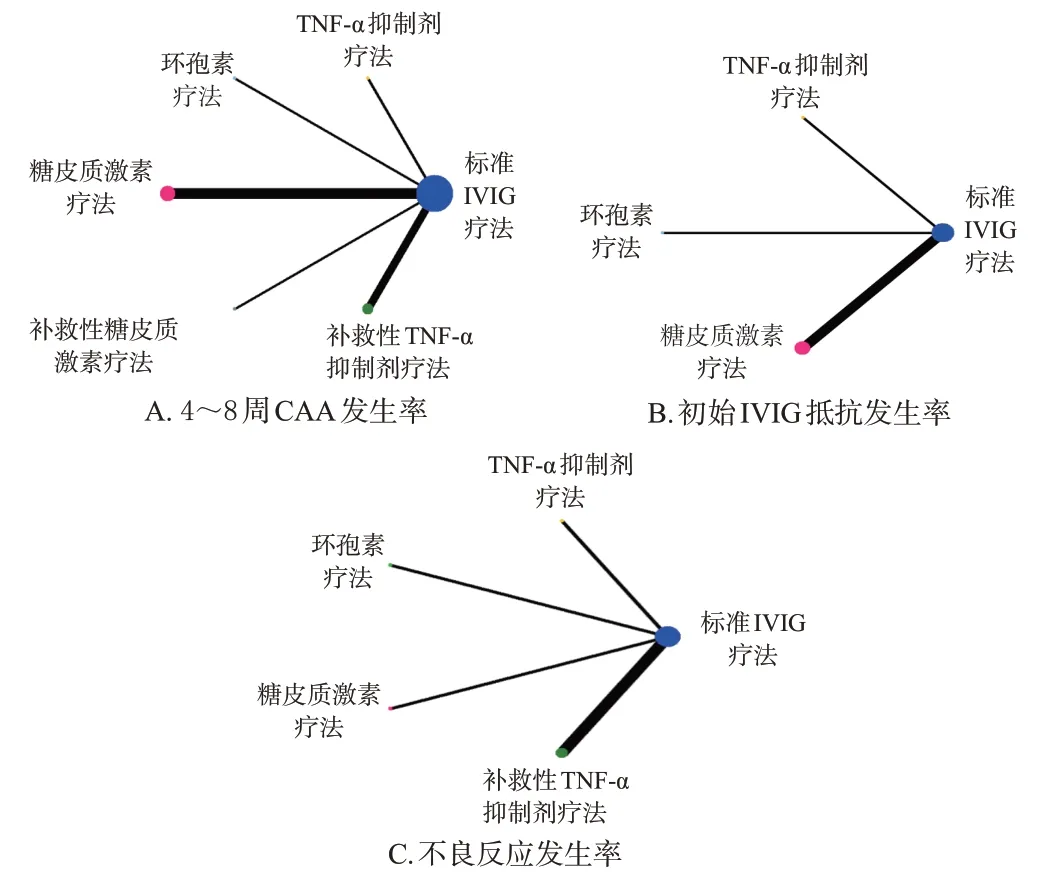
图4 各结局指标的证据关系图
2.3.2 4~8周CAA发生率
10 项研究均报道了4~8 周CAA 发生率[12―21],各研究间无统计学异质性(P=0.092,I2=39.9%),采用固定效应模型进行Meta 分析,再进行网状Meta 分析。结果显示,使用糖皮质激素疗法患儿4~8 周CAA 发生率显著低于使用标准IVIG 疗法[RR=0.31,95%CI(0.15,0.64),P<0.05]和TNF-α 抑制剂疗法[RR=0.10,95%CI(0.02,0.59),P<0.05]患儿,而使用补救性糖皮质激素疗法[RR=4.18,95%CI(1.25,13.94),P<0.05]、补救性TNF-α 抑制剂疗法[RR=3.57,95%CI(1.54,8.28),P<0.05]患儿4~8周CAA发生率均较使用糖皮质激素疗法患儿显著升高;其他干预措施间比较,差异均无统计学意义(P>0.05)。结果见图5。

图5 4~8周CAA发生率的网状Meta分析结果
2.3.3 初始IVIG抵抗发生率
6 项研究报道了初始IVIG 抵抗发生率[12―16,18],各研究间有统计学异质性(P=0.013,I2=65.5%),采用随机效应模型,以干预方式进行亚组分析后发现,异质性来源主要为糖皮质激素疗法。经分析发现,Kobayashi等[14]、Ogata 等[15]的研究分别以Kobayashi、Egami 评分对入组前受试者进行初筛,最终入组者皆为预测高风险的KD 患儿。在排除这2 项研究后,最终纳入4 项研究[12―13,16,18],各研究间无统计学异质性(P=0.424,I2=0),采用固定效应模型进行Meta分析,再进行网状Meta分析。结果显示,与标准IVIG疗法比较,环孢素疗法可有效降低患儿初始IVIG 抵抗发生率[RR=0.47,95%CI(0.28,0.81),P<0.05];其他干预措施间比较,差异均无统计学意义(P>0.05)。结果见图6。

图6 初始IVIG抵抗发生率的网状Meta分析结果
2.3.4 不良反应发生率
6项研究报道了不良反应发生率[13,16―19,21],各研究间无统计学异质性(P=0.114,I2=43.8%),采用固定效应模型进行Meta分析,再进行网状Meta分析。结果显示,各干预措施间不良反应发生率比较,差异均无统计学意义(P>0.05)。结果见图7。
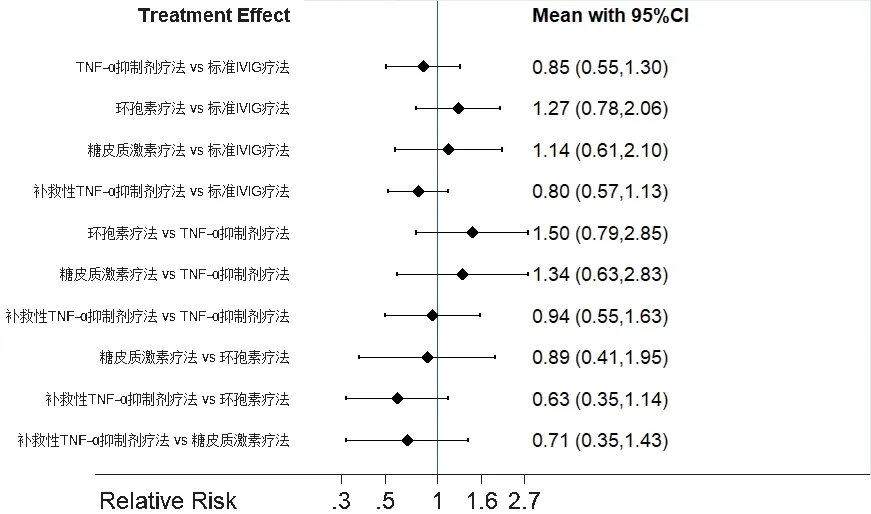
图7 不良反应发生率的网状Meta分析结果
2.3.5 不同干预措施的网状Meta分析排序
4~8周CAA发生率的排序从低到高依次为糖皮质激素疗法(SUCRA=90.5)<环孢素疗法(SUCRA=84.0)<标准IVIG疗法(SUCRA=47.7)<补救性TNF-α抑制剂疗法(SUCRA=38.1)<补救性糖皮质激素疗法(SUCRA=31.2)<TNF-α 抑制剂疗法(SUCRA=8.5);初始IVIG 抵抗发生率排序为环孢素疗法(SUCRA=91.9)<糖皮质激素疗法(SUCRA=59.3)<TNF-α 抑制剂疗法(SUCRA=28.3)<标准IVIG 疗法(SUCRA=20.5);不良反应发生率排序为补救性TNF-α 抑制剂疗法(SUCRA=80.9)<TNF-α 抑制剂疗法(SUCRA=71.1)<标准IVIG疗法(SUCRA=45.9)<糖皮质激素疗法(SUCRA=33.9)<环孢素疗法(SUCRA=18.2)。
2.4 发表偏倚分析结果
分别以4~8 周CAA 发生率、初始IVIG 抵抗发生率、不良反应发生率为指标绘制比较-校正漏斗图。结果显示,所有两两比较结果均沿中垂线对称分布,表明本研究存在发表偏倚的可能性较小,但由于3个结局指标纳入的研究较少,故检验效能不足。结果见图8。

图8 不同干预措施的比较-校正漏斗图
3 讨论
本研究结果发现,在4~8周CAA发生率方面,相较于标准IVIG 疗法和TNF-α 抑制剂疗法,在初始阶段使用糖皮质激素可显著改善患儿的4~8 周CAA 发生率,而补救性TNF-α抑制剂疗法、补救性糖皮质激素疗法患儿的4~8周CAA发生率均较使用糖皮质激素疗法患儿高;在初始IVIG 抵抗发生率方面,环孢素疗法较标准IVIG 疗法更有效;在不良反应发生率方面,各干预措施间比较差异均无统计学意义。这提示在标准IVIG疗法基础上,于初始阶段加用糖皮质激素是改善KD 患儿心血管结局的有效干预措施。
KD 最早出现的病理过程是坏死性动脉炎,其与中性粒细胞浸润同步,在发热出现的2周内逐渐形成,最终发展为动脉瘤[22]。KD治疗的延误或抵抗均会增加CAA的发生风险[4―5]。有效的干预措施可将病变局限在坏死性动脉炎早期,并在2周内彻底控制炎症。对于冠状动脉未受累或仅有扩张的患者,发病后4~6周可停止抗炎治疗[4]。受累冠状动脉从中层平滑肌的水肿分离、免疫细胞浸润至肌成纤维细胞大量增殖,并最终形成瘢痕,整个过程需要8 周[23]。故在发病第4~8 周检查CAA 是否存在,可作为评价疗效的主要结局指标。IVIG抵抗可致CAA 的发生风险升高,导致患者发生远期后遗症[1]。由于初始IVIG 抵抗在治疗完成后24~48 h 才被发现,二线补救治疗通常在KD 诊断后2~3 d 才开始,此时已接近或超过发病10 d。因此,KD 发病后10~20 d 仍需接受IVIG治疗的患儿较10 d内完成治疗患儿的冠脉病变发生率更高(27% vs.1%)[24],故本研究选择初始IVIG抵抗发生率作为次要结局指标。
糖皮质激素是经典的抗炎药物,用于KD 时可与IVIG 共同降低白细胞介素2(interleukin-2,IL-2)、IL-6、IL-8 和IL-10 的水平[25]。对于发生IVIG 抵抗的患者,糖皮质激素可抑制IVIG无法完全抑制的免疫细胞和炎症因子,如CD8+T 细胞[26]。临床在初始阶段就立即针对KD 患儿全身炎症进行强化治疗,可最大限度地减少不可逆的病理变化。本研究中,4~8周CAA发生率方面,以糖皮质激素疗法疗效最优;初始IVIG抵抗率方面,以环孢素疗法最优,糖皮质激素疗法位列第二;不良反应发生率方面,虽然糖皮质激素疗法较标准IVIG 疗法的不良反应发生率比较,差异无统计学意义,但SUCRA排序提示,糖皮质激素疗法可能有更高的不良反应发生风险,故日本指南[5]、欧洲SHARE倡议[27]均建议,针对高风险KD患儿,在第一剂IVIG时可加用糖皮质激素。
环孢素可通过负调节Ca2+/活化T 细胞核因子通路来抑制过度炎症;此外,环孢素还可抑制某些IVIG、糖皮质激素不涉及的炎症因子[28]。本研究中,初始IVIG抵抗发生率方面,以环孢素疗法最优;4~8周CAA发生率方面,虽然环孢素疗法位列第二,但与其他干预措施比较差异无统计学意义;不良反应发生率方面,环孢素的发生风险最高。
KD 急性期患儿血清TNF-α 水平显著升高,且与CAA的发生密切相关[29]。常见的TNF-α抑制剂(如英夫利昔单抗)可下调IVIG 抵抗KD 患儿的促炎因子水平,包括C反应蛋白、可溶性TNF受体Ⅰ和IL-6[30],从而迅速退热[8]。本研究中,4~8 周CAA 发生率方面,TNF-α 抑制剂疗法和补救性TNF-α 抑制剂疗法的疗效均劣于糖皮质激素疗法和环孢素疗法;初始IVIG 抵抗发生率方面,TNF-α 抑制剂疗法的SUCRA 排序虽优于标准IVIG疗法,但两组间比较差异无统计学意义;不良反应发生率方面,以补救性TNF-α抑制剂疗法的发生风险最低。
综上所述,初始阶段给予糖皮质激素可显著减少KD患儿4~8周CAA的发生风险,给予环孢素可显著改善初始IVIG 抵抗,在补救阶段使用TNF-α 抑制剂的不良反应发生率可能最低。本研究存在的局限性为:(1)纳入样本量较小,除糖皮质激素外,其他能够合并的研究不多,且部分数据具有异质性;(2)患儿种族、诊断标准有所不同;(3)纳入文献质量不高;(4)参与比较的干预措施不够完善,可能会对结果产生影响。因此,本研究所得结论仍需更多高质量RCT进一步验证。
