CDK4/6抑制剂联合内分泌药物治疗HR阳性/HER2阴性乳腺癌疗效与安全性的Meta分析Δ
2023-12-01黄聪聪肖勋立何学珍井冈山大学附属医院药剂科江西吉安343000
黄聪聪,彭 靖,肖勋立 ,何学珍(井冈山大学附属医院药剂科,江西 吉安 343000)
全球统计数据显示,2020年新增乳腺癌患者约230万例,乳腺癌已成为女性最常见的肿瘤[1]。乳腺癌是一种异质性疾病,以激素受体(hormone receptor,HR)阳性、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性为常见亚型,其中HR 阳性患者占乳腺癌患者的70%以上[2―3]。对于HR 阳性乳腺癌患者,临床常用的治疗手段为内分泌药物疗法,包括芳香化酶抑制剂等。虽然该疗法可明显延长患者生存期[4―5],但几乎所有患者均会出现耐受能力下降[5],使得内分泌药物治疗的效果受到很大限制,因此寻找解决内分泌药物耐药的方法就显得尤为重要。
周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂可通过抑制视网膜母细胞瘤(retinoblastoma,Rb)蛋白磷酸化来阻止细胞周期从G1期过渡到S期,从而促进肿瘤细胞衰老、凋亡[6]。已有临床研究表明,与单用内分泌药物比较,CDK4/6抑制剂联合内分泌药物能够提高HR 阳性/HER2 阴性乳腺癌患者的疗效,显著延长患者的生存期[7]。近年来,不断有关于CDK4/6 抑制剂的新的研究数据公布和新的CDK4/6 抑制剂上市,目前已上市的CDK4/6抑制剂包括达尔西利、阿贝西利、哌柏西利、瑞波西利。为此,本研究系统性评价了上述4 种CDK4/6 抑制剂联合内分泌药物治疗HR阳性/HER2阴性乳腺癌的疗效和安全性,旨在为临床用药提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型
本研究纳入的文献类型为随机对照试验(randomized controlled trial,RCT),语种限定为中文或英文。
1.1.2 研究对象
本研究纳入的患者为HR 阳性/HER2 阴性乳腺癌患者。
1.1.3 干预措施
试验组患者给予CDK4/6 抑制剂联合内分泌药物;对照组患者单用内分泌药物或联用安慰剂。CDK4/6抑制剂包括达尔西利、阿贝西利、瑞波西利、哌柏西利;内分泌药物包括来曲唑、阿那曲唑、氟维司群等。
1.1.4 结局指标
本研究的结局指标为:(1)无进展生存期(progression free survival,PFS);(2)总生存期(overall survival,OS);(3)客观缓解率(objective response rate,ORR);(4)临床获益率(clinical benefit rate,CBR);(5)不良反应发生率。
1.1.5 排除标准
本研究的排除标准包括:(1)个案报道、综述和Meta分析;(2)动物或细胞的基础研究;(3)缺乏数据的临床研究、会议摘要和重复发表的文献。
1.2 文献检索策略
计算机检索PubMed、the Cochrane Library、Embase、Web of Science、中国知网、万方数据、维普网。中文检索词为“乳腺癌” “乳腺肿瘤”“乳腺癌症”“达尔西利”“阿贝西利”“瑞波西利”“哌柏西利”;英文检索词为“breast neoplasms”“breast cancer” “dalpiciclib”“abemaciclib”“ribociclib”“palbociclib”。检索时限均为建库至2023年4月。采用主题词与自由词相结合的方式检索。
1.3 文献筛选与资料提取
由2位研究者独立筛选文献,如遇分歧,双方协商或由第3位研究者解决。如果多篇文献来自同一个RCT,则选取最新公布的数据。提取资料包括:第一作者、发表年份、例数、干预措施、结局指标等。
1.4 纳入文献质量评价
采用Cochrane 系统评价员手册推荐的5.1.0偏倚风险评估工具对文献质量进行评价,具体包括:随机序列产生、分配隐藏、对实施者和参与者采用盲法、研究结果评估、结果数据完整性、选择性报告结果、其他偏倚,每项均分为“高风险”“低风险”“不清楚”[8]。
1.5 统计学方法
采用RevMan 5.4.1 软件进行Meta 分析。PFS、OS使用风险比(hazard ratio,HR)及其95%置信区间(confidence interval,CI)表示,ORR、CBR 及不良反应发生率采用比值比(odds ratio,OR)及其95%CI 表示。采用χ2检验分析各研究间的异质性。若P>0.05且I2<50%,表示各研究间无统计学异质性,采用固定效应模型进行分析;反之,则采用随机效应模型进行分析;若各组间异质性明显,则进行敏感性分析和描述性分析。采用倒漏斗图进行发表偏倚分析。检验水准α=0.05。
2 结果
2.1 文献筛选结果与纳入研究基本信息
初检共获得文献10 450 篇,经阅读标题、摘要及全文后,最终纳入文献22篇[9―30];涉及15项RCT,合计18 574例患者。所有研究均为随机对照、双盲、Ⅱ或Ⅲ期试验,其中试验组9 932例、对照组8 642例。文献筛选流程见图1,纳入研究基本信息见表1。
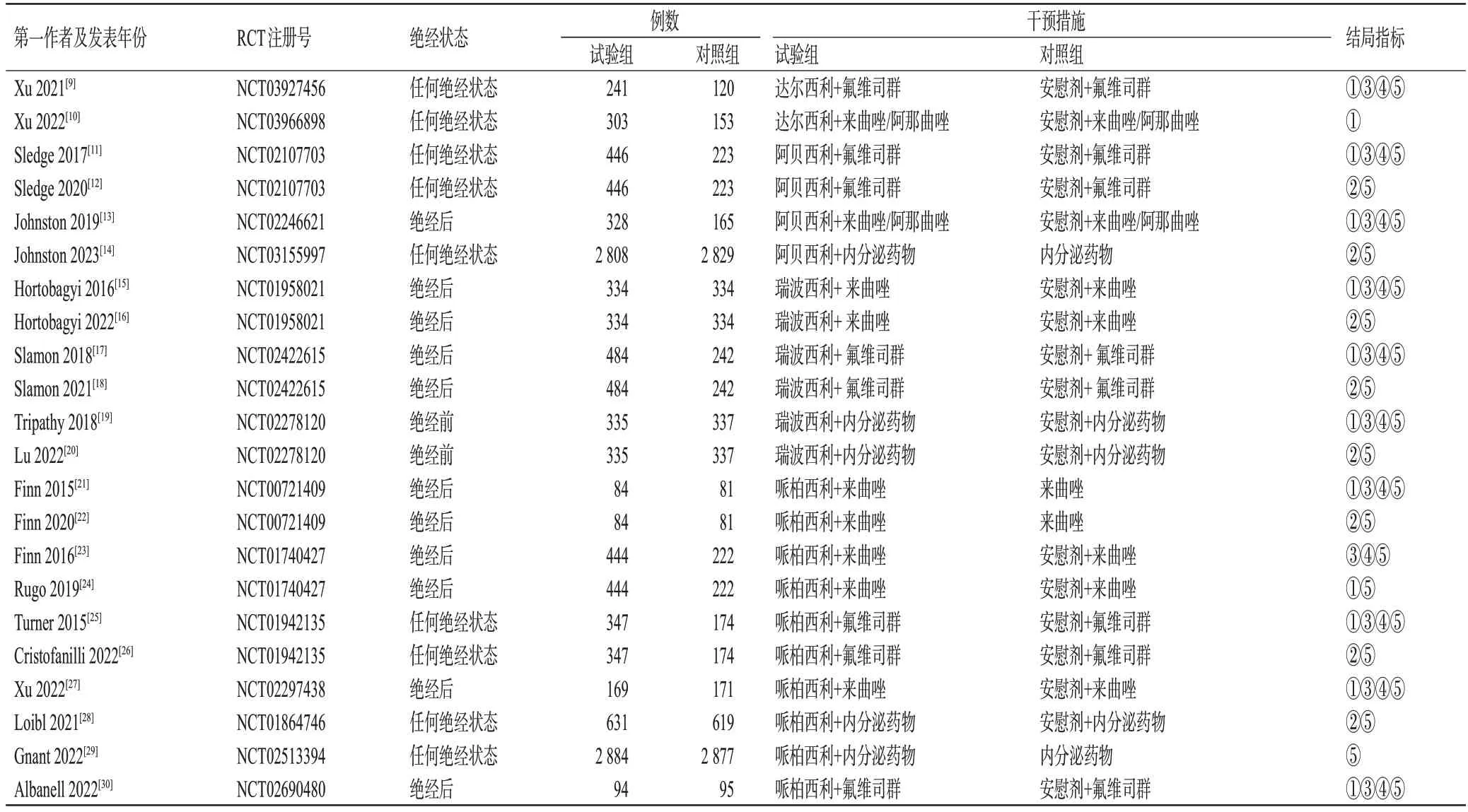
表1 纳入研究的基本信息

图1 文献筛选流程
2.2 纳入研究的质量评价
所有研究均为RCT[9―30],均描述了随机分配方法和分配隐藏方法,结果数据均完整,均未选择性报道结果,均不清楚是否存在其他偏倚来源。结果见图2、图3。

图2 偏倚风险条形图
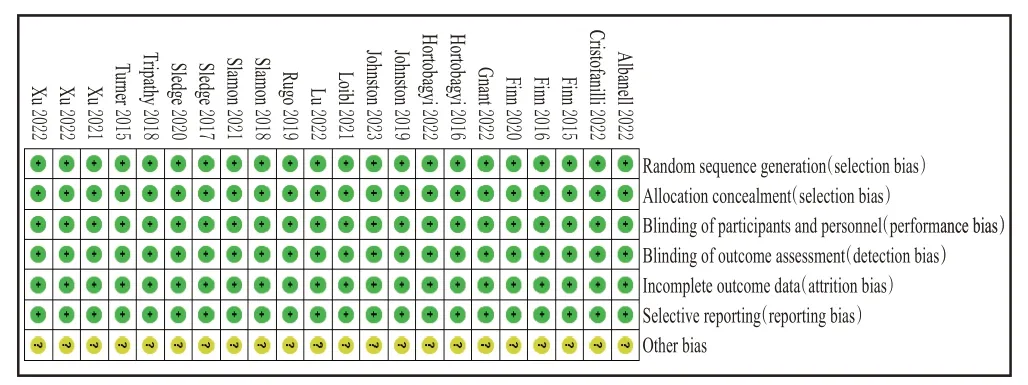
图3 偏倚风险总图
2.3 Meta分析结果
2.3.1 PFS
12 项研究报道了PFS[9―11,13,15,17,19,21,24―25,27,30]。各研究间无统计学异质性(P=0.50,I2=0),采用固定效应模型进行分析。结果显示,试验组患者的PFS显著长于对照组[HR=0.77,95%CI(0.74,0.79),P<0.000 01],详见图4。

图4 PFS的Meta分析森林图
2.3.2 OS
8 项研究报道了OS[12,14,16,18,20,22,26,28]。各研究间无统计学异质性(P=0.79,I2=0),采用固定效应模型进行分析。结果显示,试验组患者的OS 显著长于对照组[HR=0.91,95%CI(0.87,0.94),P<0.000 01],详见图5。

图5 OS的Meta分析森林图
2.3.3 ORR
11 项研究报道了ORR[9,11,13,15,17,19,21,23,25,27,30]。各研究间无统计学异质性(P=0.42,I2=2%),采用固定效应模型进行分析。结果显示,试验组患者的ORR 显著高于对照组[OR=1.71,95%CI(1.51,1.93),P<0.000 01],详见图6。

图6 ORR的Meta分析森林图
2.3.4 CBR
11 项研究报道了CBR[9,11,13,15,17,19,21,23,25,27,30]。各研究间无统计学异质性(P=0.09,I2=38%),采用固定效应模型进行分析。结果显示,试验组患者的CBR显著高于对照组[OR=1.73,95%CI(1.52,1.95),P<0.000 01],详见图7。

图7 CBR的Meta分析森林图
2.3.5 不良反应发生率
试验组患者≥3 级不良反应发生率、中性粒细胞减少发生率、白细胞减少发生率、贫血发生率、腹泻发生率、恶心发生率均显著高于对照组(P<0.05)。结果见表2。

表2 不良反应发生率的Meta分析结果
2.4 敏感性分析
以中性粒细胞减少发生率为指标,当剔除Johnston等[14]研究后,各研究间的异质性改变较明显(P<0.000 1,I2=73%),但Meta分析结果显示,试验组患者的中性粒细胞减少发生率仍显著高于对照组[OR=71.66,95%CI(51.02,100.64),P<0.000 01],与剔除前比较未发生明显改变,表明结果较稳健。
分别以≥3级不良反应发生率、白细胞减少发生率、贫血发生率、腹泻发生率、恶心发生率为指标,逐一剔除各项研究后,各研究间的异质性均无较大改变,Meta 分析结果亦未发生明显改变,表明结果较稳健。
2.5 发表偏倚分析
分别以PFS、OS、ORR、CBR 为指标绘制倒漏斗图,结果显示,各研究散点基本在倒漏斗范围内,表明本研究存在发表偏倚的可能性较小。结果见图8。
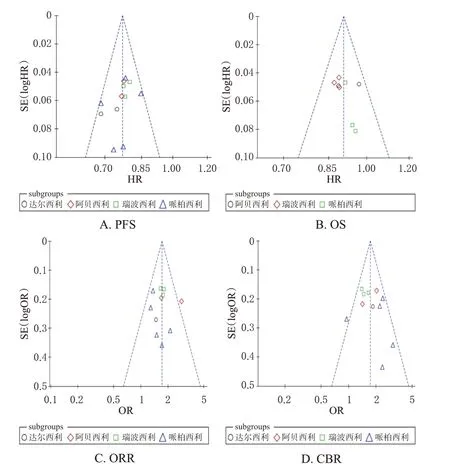
图8 PFS等指标的发表偏倚分析图
3 讨论
有研究报道,CDK4/6 是细胞增殖过程中重要的调控因子,可通过与细胞周期蛋白D结合形成细胞周期蛋白D-CDK4/6 复合物,而使得Rb 蛋白磷酸化,继而释放转录因子E2F,促使DNA开始复制,使细胞从G1期发展至S期[31]。另有研究发现,许多HR阳性晚期乳腺癌患者表现出细胞周期蛋白D-CDK4/6-Rb 通路紊乱,这为CDK4/6 抑制剂治疗乳腺癌提供了理论依据[32]。早期的PALOMA-1 研究显示,与单用来曲唑相比,哌柏西利联合来曲唑可将HR阳性/HER2阴性乳腺癌患者的PFS从10.2 个月延长至20.2 个月,中位OS 从33.3 个月延长至37.5 个月[21]。这证明了CDK4/6 抑制剂联合内分泌药物用于HR阳性/HER2阴性乳腺癌患者的疗效更好。本研究结果显示,试验组患者的PFS、OS、ORR、CBR 均显著优于对照组。
本研究结果还显示,试验组患者≥3 级不良反应发生率和中性粒细胞减少、白细胞减少、贫血等血液毒性反应发生率以及腹泻、恶心等非血液学不良反应发生率均显著高于对照组。Onesti等[33]研究表明,CDK4/6抑制剂与高血液毒性反应有关,尤其是中性粒细胞减少。CDK4/6 抑制剂的不良反应以血液毒性反应最为常见,其原因可能是该类制剂抑制了CDK4/6,而CDK4/6是造血前体增殖的关键调节剂[34]。CDK4/6 抑制剂引起的骨髓抑制与化疗诱导的骨髓抑制有所不同,化疗诱导骨髓抑制的机制是引起细胞DNA损伤和导致造血干细胞凋亡;而CDK4/6 抑制剂则是通过抑制造血干细胞从G1期发展至S期,导致细胞周期停滞,从而引起骨髓抑制,如果停用CDK4/6 抑制剂,骨髓移植可迅速逆转[35]。除了血液毒性反应外,CDK4/6抑制剂还可能引起腹泻、恶心等非血液学不良反应。虽然CDK4/6抑制剂的不良反应明显,尤其是血液毒性反应,但目前尚未有因CDK4/6抑制剂不良反应而死亡的病例报道,可见CDK4/6 抑制剂仍然可作为乳腺癌患者治疗的一个重要选择。
综上所述,CDK4/6抑制剂联合内分泌药物治疗HR阳性/HER2阴性乳腺癌的疗效显著,不良反应发生率较高,尤其是血液毒性反应。本研究的局限性为:(1)纳入研究的干预措施、纳入患者的状态、治疗药物不尽相同;(2)部分临床试验还在进行中,相关数据暂未公布。故本研究所得结论仍需要更多大样本、高质量RCT 进行验证。
