卡博替尼治疗晚期甲状腺癌有效性和安全性的Meta分析
2023-12-01赵紫婷胡晓霞兰州大学第二医院老年病科兰州730030兰州大学第二医院肿瘤内科兰州730030
竺 晶 ,谢 骥 ,赵紫婷 ,胡晓霞 #(.兰州大学第二医院老年病科,兰州 730030;.兰州大学第二医院肿瘤内科,兰州 730030)
甲状腺癌是最常见的内分泌肿瘤,占全球所有肿瘤的3%,且发病率呈逐年增加趋势[1]。2020年全球癌症统计数据显示,甲状腺癌新发患者为586 202例[2]。虽然甲状腺癌的发病率有所上升,但死亡率在全世界范围内保持稳定或呈下降趋势[3]。
甲状腺癌分为分化型甲状腺癌(differentiated thyroid carcinoma,DTC)、甲状腺髓样癌(medullary thyroid carcinoma,MTC)和甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)3 种病理类型[4]。虽然大多数甲状腺癌患者预后良好,但仍有10%~15%的患者复发,5%的患者发生远处转移[5]。研究指出,67%的远处转移DTC 患者在治疗过程中或初始治疗时即失去分化表型,丧失摄碘能力,从而进展为放射性碘难治性分化型甲状腺癌(radioactive iodine-refractory differentiated thyroid cancer,RAIR-DTC)[6]。MTC 患者占所有甲状腺癌患者的5%,在晚期MTC 患者中,转移部位以肝、肺和骨骼较为常见,且晚期转移性DTC 和MTC 患者通常预后不佳[7],包括手术、放射碘标准治疗和细胞毒性化疗在内的多模式治疗的疗效均有限[5]。
酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)为三磷酸腺苷与酪氨酸激酶结合的竞争性抑制剂,可以阻断酪氨酸激酶活性,抑制肿瘤细胞的增殖,用于治疗晚期甲状腺癌的疗效显著,但其毒副作用不容忽视[8]。卡博替尼是一种口服的多靶点TKIs,能抑制细胞间质上皮转换因子(cellular-mesenchymal to epithelial transition factor,c-MET)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等受体的活性。2021年9月,卡博替尼在美国获批用于局部或晚期转移性DTC 的治疗[9],但尚未在我国上市。为此,本研究拟通过Meta 分析的方法评价卡博替尼治疗晚期甲状腺癌的有效性和安全性,旨在为该药在我国获批适应证提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型
本研究纳入的文献类型为随机对照试验(randomized controlled trial,RCT),语种为中文和英文。
1.1.2 研究对象
本研究纳入的患者为晚期甲状腺癌患者。
1.1.3 干预措施
试验组患者给予卡博替尼,对照组患者给予安慰剂。
1.1.4 结局指标
本研究的主要结局指标包括无进展生存期(progression free survival,PFS)、总生存期(overall survival,OS);次要结局指标包括客观缓解率(objective response rate,ORR)、不良事件(adverse event,AE)发生率。
1.1.5 排除标准
本研究的排除标准包括:(1)不能获得摘要或全文的文献;(2)重复发表的文献;(3)无法提取数据的文献;(4)结局指标不一致的文献。
1.2 文献检索策略
计算机检索PubMed、the Cochrane Library、Embase、ClinicalTrials.gov、万方数据、维普网、中国知网、中国临床试验注册中心。中文检索词包括“甲状腺癌”“甲状腺肿瘤”“卡博替尼”;英文检索词包括“thyroid neoplasms”“thyroid cancer”“cabozantinib”。检索时限为建库至2022年11月。
1.3 文献筛选与资料提取
由2名研究人员独立筛选文献,如遇分歧,则通过讨论或与第三方协商解决。提取资料包括:(1)纳入研究的基本信息,如题目、发表时间、作者等;(2)纳入患者的基本特征,如患者例数、年龄、性别等;(3)研究方法,如质量评价的关键因素;(4)干预措施,如给药途径、剂量等;(5)结局指标。
1.4 纳入文献质量评价
采用Cochrane 系统评价员手册推荐的5.1.0 偏倚风险评估工具进行质量评价,具体包括:随机方法是否正确、分配是否隐藏、对实施者和参与者是否采用盲法、结果数据的完整性、是否选择性报告研究结果、其他偏倚来源,每个条目均分为“高偏倚”“低偏倚”“不清楚”[10]。
1.5 统计学方法
采用RevMan 5.4 软件进行统计分析。二分类变量以危险比(risk ratio,RR)及其95%置信区间(confidence interval,CI)表示,时间相关终点(PFS、OS)以风险比(hazard ratio,HR)及其95%CI表示。采用χ2检验和I2检验判断各研究间的异质性,若P>0.1且I2<50%,表明各研究间无统计学异质性,采用固定效应模型进行分析;反之,则表明各研究间存在统计学异质性,进一步分析其异质性来源,在排除明显临床异质性后,采用随机效应模型进行分析;若临床异质性明显,则采用亚组分析或敏感性分析。检验水准α=0.05。
2 结果
2.1 文献筛选流程与纳入研究基本信息
初检共得到相关文献1 431篇,经阅读标题、摘要及全文后,最终纳入文献4 篇[11―14],共计588 例患者,其中试验组389 例,对照组199 例。文献筛选流程见图1,纳入研究基本信息见表1(文献[11]和文献[12]来自同一试验,但样本量及随访时间不同,文献[12]在文献[11]的基础上新纳入试验组45 例、对照组26 例;文献[13]和文献[14]来自同一试验,样本量相同,但随访时间及结局指标不同,故计算总例数时仅纳入其中一条文献,总例数与表1不同)。
2.2 纳入研究质量评价结果
4 项研究均为RCT[11―14]。2 项研究未提及随机序列产生的具体方法及分配是否隐藏[13―14];所有研究均对实施者和参与者施盲,结果数据均完整,均无选择性报告结果,均不清楚是否存在其他偏倚来源。结果见图2、图3。

图3 偏倚风险总图
2.3 Meta分析结果
2.3.1 PFS
3项研究报道了PFS[11―13],各研究间无统计学异质性(P=0.64,I2=0),采用固定效应模型进行Meta 分析。结果显示,试验组患者的PFS 显著长于对照组[HR=0.24,95%CI(0.19,0.31),P<0.000 01]。按不同肿瘤类型进行亚组分析,结果显示,试验组DTC 患者[HR=0.22,95%CI(0.16,0.30),P<0.000 01]、MTC 患者[HR=0.28,95%CI(0.19,0.41),P<0.000 01]的PFS 均显著长于对照组。结果见图4。
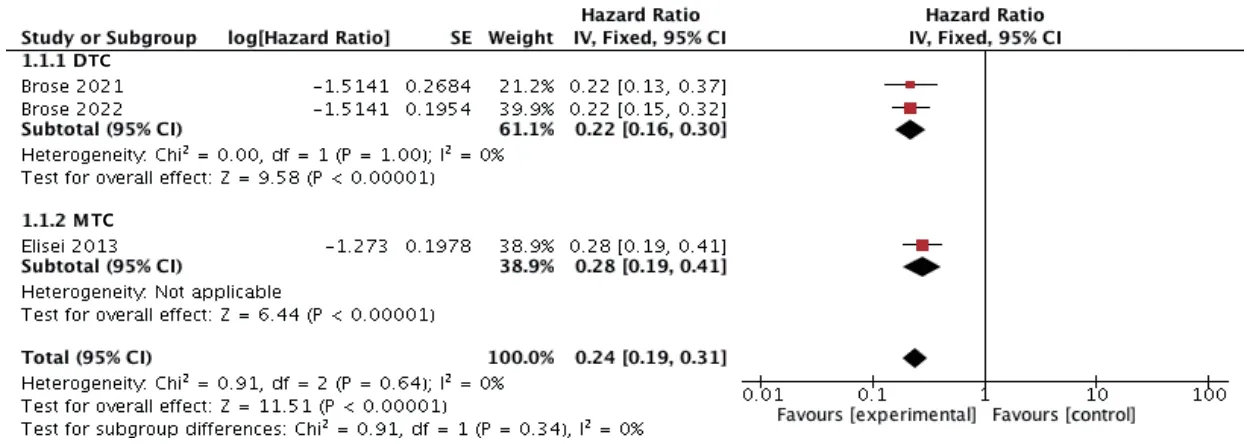
图4 PFS的Meta分析森林图
2.3.2 OS
4 项研究均报道了OS[11―14],各研究间无统计学异质性(P=0.54,I2=0),采用固定效应模型进行Meta 分析。结果显示,两组患者的OS 比较,差异无统计学意义[HR=0.83,95%CI(0.67,1.02),P=0.07]。按不同肿瘤类型进行亚组分析,结果显示,试验组DTC 患者[HR=0.67,95%CI(0.44,1.02),P=0.06]、MTC 患者[HR=0.89,95%CI(0.70,1.13),P=0.32]的OS 与对照组比较,差异均无统计学意义。结果见图5。

图5 OS的Meta分析森林图
2.3.3 ORR
3 项研究报道了ORR[11―13],各研究间无统计学异质性(P=0.63,I2=0),采用固定效应模型进行Meta 分析。结果显示,试验组患者的ORR 显著高于对照组[RR=31.46,95%CI(6.32,156.75),P<0.000 1]。按不同肿瘤类型进行亚组分析,结果显示,试验组DTC 患者[RR=15.37,95%CI(2.13,111.00),P=0.007]、MTC患者[RR=63.64,95%CI(3.97,1 019.17),P=0.003]的ORR 均显著高于对照组。结果见图6。
2.3.4 AE发生率
试验组患者3~4 级AE[RR=2.15,95%CI(1.76,2.61),P<0.000 01]、严重不良事件(serious adverse event,SAE)[RR=1.78,95%CI(1.11,2.83),P=0.02]、腹泻[RR=3.29,95%CI(1.62,6.66),P=0.001]、掌跖红斑感觉异常[RR=28.19,95%CI(12.25,64.88),P<0.000 01]、高血压[RR=6.50,95%CI(3.90,10.83),P<0.000 01]发生率均显著高于对照组,而两组患者的疲劳发生率[RR=1.25,95%CI(0.78,1.98),P=0.35]比较差异无统计学意义。结果见表2。
3 讨论
甲状腺癌细胞常发生酪氨酸激酶受体及其介导的下游信号通路(包括丝裂原活化蛋白激酶/细胞外调节蛋白和磷脂酰肌醇3-激酶/蛋白激酶B)异常激活,而引起肿瘤细胞增殖、分化、凋亡,并导致血管生成相关活动的异常[15]。在甲状腺肿瘤细胞中,靶向高表达酪氨酸激酶的多激酶抑制剂在体外和体内均显示出了良好的抗肿瘤活性[5]。对于常规治疗无效、明显进展的晚期甲状腺癌患者,可考虑接受靶向药物治疗[15]。卡博替尼是一种小分子、多靶向的口服TKIs,可阻断c-MET、RET 和VEGF2受体,抑制肿瘤细胞的扩散以及耐药的发生[7]。该药于2012年和2017年先后被美国FDA批准用于治疗进行性转移性MTC 和晚期肾细胞癌[16];基于COSMIC-311试验的结果,卡博替尼于2021年被美国FDA批准用于治疗局部或晚期转移性DTC[9]。
本研究结果显示,卡博替尼可以显著改善晚期甲状腺癌患者的PFS和ORR。卡博替尼治疗后,DTC患者的中位PFS为11.0个月[12],MTC患者的中位PFS为11.2个月[13]。本研究中,尽管两组患者的OS 比较差异无统计学意义,但卡博替尼治疗晚期MTC 的疗效观察结果提示,与安慰剂相比,卡博替尼治疗后患者的中位OS增加了5.5个月[14]。靶向治疗为晚期甲状腺癌的治疗策略之一,但并没有真实世界数据显示TKIs对晚期甲状腺癌患者的预后有改善作用[17]。有研究发现,其他TKIs,如索拉非尼和仑伐替尼同样可以延长晚期甲状腺癌患者的PFS,且也并未延长患者的OS[18―19]。可见,卡博替尼治疗晚期甲状腺癌患者的疗效不劣于其他TKIs。
靶向药物常见的不良反应包括腹泻、恶心、呕吐、疲乏、高血压、皮疹及手足皮肤反应等[15]。有研究发现,经卡博替尼治疗后,患者最常见的药物不良反应为食欲下降、体重减轻、腹泻、疲劳[20]。一项网状Meta分析结果显示,使用TKIs患者的严重腹泻发生风险最高,不同种类的TKIs导致严重腹泻的风险不同,卡博替尼的发生风险高于仑伐替尼和索拉非尼[21]。本研究中,试验组患者3~4 级AE 发生率及SAE、腹泻、掌跖红斑感觉异常、高血压发生率均显著高于对照组,但两组患者的疲劳发生率比较差异无统计学意义。有研究认为,卡博替尼是患者最可能因无法忍受不良反应而停药的TKIs[22]。对于发生3~4 级AE 及SAE 的患者建议停用卡博替尼,待AE缓解后,可考虑以较低剂量恢复治疗[23]。德国的一项研究显示,在接受卡博替尼治疗的晚期MTC患者中,发生AE 患者的PFS 及OS 均显著延长[20]。一些特定的AE也被发现可以预测更好的生存结局,例如发生高血压和腹泻的患者与未发生者相比,其PFS 和OS 均显著延长[24]。尽管TKIs可以改善晚期甲状腺癌患者的预后,但TKIs 治疗的最佳时机仍不明确,特别是对于无症状患者。有研究发现,除了ATC 外,甲状腺肿瘤细胞的生长速度比其他恶性肿瘤慢,肿瘤细胞直径小于1 cm的患者不会出现任何症状,且生存质量较好;若过早使用TKIs,大多数患者可能会因TKIs相关毒性反应而导致生存质量下降[25]。目前,已经开展了覆盖RAIR-DTC 患者从无症状到出现症状进展这一时间范围的临床试验,有助于确定无症状RAIR-DTC 患者开始TKIs 治疗的最佳时间点[26]。对于正在使用卡博替尼的患者应早期识别是否存在不良反应,并对其进行动态危险风险分层评估,以确定治疗的有效性及是否需要使用卡博替尼治疗。此外,由于TKIs需长期口服,因此需加强对患者的用药教育,密切监测其血压,及时识别早期AE 并及时干预,以预防SAE的发生。
综上所述,卡博替尼可延长晚期甲状腺癌患者的PFS,增加ORR,但AE 发生率较高。本研究的局限性为:(1)纳入样本量较小;(2)随访时间存在差异,无法估计OS;(3)纳入文献数据有限,无法进行发表偏倚分析。故本文所得结论尚需更多高质量研究予以验证。
