单采血小板献血者新型冠状病毒IgM 和IgG 抗体水平监测结果分析及对血液安全的影响*
2023-11-30张翙王心维何汝汝韦振兴梁进恒庞栋陈利民
张翙 王心维 何汝汝 韦振兴 梁进恒 庞栋△ 陈利民
(1.南宁中心血站,广西 南宁 530007;2.中国医学科学院北京协和医学院输血研究所)
SARS-CoV-2 导致的人体肺部病变,通常被称为新型冠状病毒感染(coronavirus infection disease-19, COVID-19),因SARS-CoV-2 对人具有高传染性和高致病性,大流行期间给人类造成了不可估量的损失。 SARS-CoV-2 的主要传播途径是通过呼吸道飞沫,至今MERS-CoV[1]及SARS-CoV-2 经血液传播的证据仍然不足。 虽然许多临床研究显示能在COVID-19 重症患者中检测到SARS-CoV-2 的核酸(RNA 血症)[2],但目前仍然认为其通过输血传播的风险可以忽略[3],心理层面因素造成的对献血和血液制品安全性的担忧[4]对血液供应和临床用血有着重要的影响[5]。 且随着SARS-CoV-2 奥密克戎变异株(Omicron)[6]的毒性减弱[7]以及人群中的广泛接种新冠疫苗,国家防控策略不再采取“乙类传染病甲类防控措施”这类以限制人口流动和大规模核酸检测为主要措施的策略[8],2022 年12 月7 日国务院联防联控机制综合组发布新的关于新冠疫情防控措施的通知,被认为开启了我国“后疫情时代”。 根据当时新冠病毒感染防控政策,为指导血站进一步做好无偿献血工作,2022 年12 月17 日国家卫生健康委、中央军委后勤保障部卫生局发布《血站新冠病毒感染防控工作指引(第二版)》(国卫办医急函〔2022〕449 号)[9],旨在保障采供血机构工作人员和无偿献血者安全,确保血液安全平稳供应。 为确保临床用血安全,本研究追踪监测了单采血小板献血者感染SARS-CoV-2 康复后IgM 和IgG 抗体阳性率及S/CO值与时间(2022 年12 月8日后,跨度14~15 周)消长性变化,为血液临床安全性使用提供数据支持。
1 对象与方法
1.1 对象 南宁地区单采血小板献血者,符合以下标准:1)2022 年12 月8 日后,感染新冠病毒(核酸检测阳性)。 2)献血者在《新冠病毒感染相关健康状况征询表》承诺没有以下情况:①48 h 内曾接受新冠病毒灭活疫苗或基因重组疫接种。 ②14 d 内曾接受灭活疫苗和基因重组疫苗以外的其他类型新冠病毒疫苗接种(不包括减毒活疫苗)。 ③感染新冠病毒(重型和危重型除外),且距离最后1 次阳性结果不足7 d。 ④6 个月内曾被诊断为新冠病毒感染重型或危重型。3)符合单采血小板献血者标准。 4)连续捐献血小板6 ~7次,即T1(2 周)—T7(14 周),15 d<捐献时间间隔≤20 d。 5)所有的调查,包括从献血登记表中收集献血者的性别、年龄等基本信息,血液标本采集、血液标本检测,均获得献血者知情同意。 本研究方案经南宁中心血站医学伦理委员会审查批准,批文编号:2023-EC-09。
1.2 试剂与仪器 新型冠状病毒(2019-nCoV)的IgM 和IgG抗体检测试剂盒(磁微粒化学发光法)(郑州安图生物工程股份有限公司,批号:29230214)。 A2000 PLUS 全自动化学发光测定仪(郑州安图生物工程股份有限公司)。
1.3 方法
1.3.1 献血前征询 1)在原有健康征询的基础上,增加《新冠病毒感染相关健康状况征询表》,了解献血者新冠病毒感染相关健康状况。 2)对每位献血者进行体温测量,如献血者出现体温≥37.3℃应当告知献血者暂缓献血。 3)书面告知献血者(签名确认),如献血后48 h 内诊断新冠病毒感染,应及时回告血站,血站献血后服务科负责接受献血者回告,接到回告后应当做好记录并采取以下措施:①对未输注的血液,紧急收回后作保密性弃血处理。 ②血液已输注,做好相关信息登记,及时通知相关医院对受血者进行跟踪回访。 ③排查与该献血者有密切接触的工作人员,按属地疫情防控要求管理。
1.3.2 标本采集 单采血小板献血时,核酸检测留样试管留取约5 mL 全血, 1 600×g 离心10 min 使血浆与红细胞分离后置于医用冰箱(低于-25℃)保存备检。
1.3.3 标本检测
1.3.3.1 检测前准备 所有检测标本一次性取出,并在室温复温30 min,所有解冻后标本检测前均上下倒转3 次混匀,确保血浆标本内容物均匀。
1.3.3.2 实验检测 原理为用2019-nCoV 抗原包被磁微粒,辣根过氧化物酶标记人IgM、IgG 抗体,通过免疫反应形成固相抗原-抗体-酶标二抗复合物,经复合物催化发光底物发出光子,发光强度与新型冠状病毒(2019-nCoV)IgM、IgG 抗体的含量成正比。
1.3.3.3 结果判定与质量控制 Cut off 值=阳性对照孔平均发光值×Cut off 系数,S/CO≥1.00 时,结果判定为阳性;S/CO<1.00 时,结果判定为阴性。 质量控制为阳性对照S/CO 在4.4~5.6 范围内试验有效。
1.4 统计学分析 所有数据用SPSS 26.0 统计软件录入及处理。 计数资料、率的比较采用χ2检验;计量资料,以“均数±标准差(¯x±s)”表示,组间比较用T检验,P<0.05 有统计学意义。
2 结果
符合纳入标准单采血小板献血者54 人,年龄24 ~59(42.46±9.08)岁,男性45(83.33%)人,女性9(16.67%)人。提供359 份血液标本用于检测,有效检测结果349 份,全部血液标本均未收到献血后回报。 T1—T7时间段内IgM 检测呈阳性11 人,阳性率20.37%; IgM 抗体S/CO 值T1—T3逐步升高,T4—T7逐步下降。 T1—T7时间段内IgG 检测呈阳性54人,阳性率100%;IgG 抗体S/CO 值随时间变化逐步降低。在T1—T7时间段内,SARS-CoV-2 IgG 抗体S/CO 值在不同性别、年龄的献血者间无差异(P>0.05),见表1,2,图1。
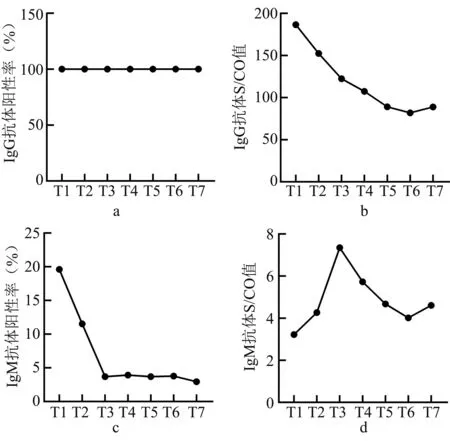
图1 IgG、IgM 抗体随时间变化情况

表1 单采血小板献血者新冠病毒IgG、IgM 抗体检测结果 (n,%)
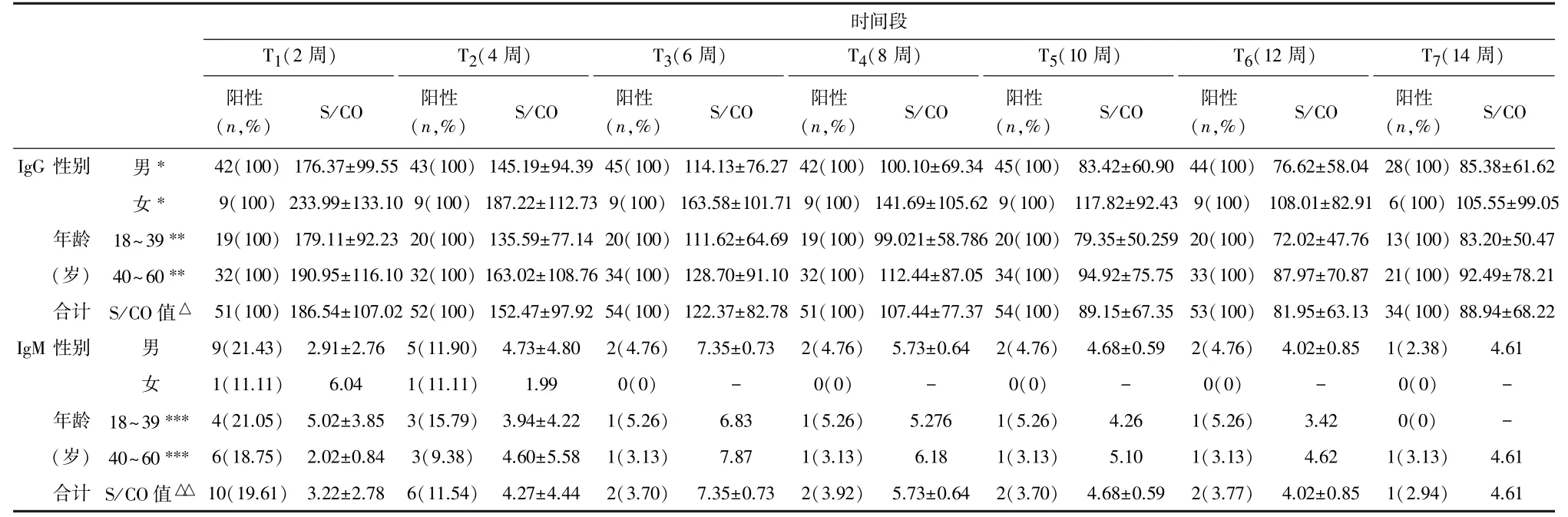
表2 单采血小板献血者新冠病毒IgG/IgM 抗体检测S/CO 值动态变化情况 (¯x±s)
3 讨论
为提升SARS-CoV-2 检测的准确性,我国普遍采用的SARS-CoV-2 感染检测为“咽拭子核酸+IgM +IgG”同时检测。 开展献血者SARS-CoV-2 感染后IgM 和IgG 抗体动态检测的意义在于:1)筛查献血者可能存在的感染[10]:IgM 抗体可以检测到是否有当前或最近的SARS-CoV-2 感染;2)判断献血者是否已经产生了SARS-CoV-2 免疫保护,是对核酸检测结果的一种补充[11]。 如果血清检出IgM,而未检出IgG,可提示新近发生感染。 此后,在患者逐渐康复过程中IgM 抗体也开始下降,且在病毒清除后快速减少并消失。 IgG 产生于感染中后期[12],通常在病毒感染后的d14 左右出现,并逐渐上升,替代IgM 成为感染标志物及清除病毒的主要抗体,该抗体在体内停留的时间较IgM 长。
本研究以单采血小板献血者为研究对象,采用全自动化学发光法,追踪2022 年12 月后献血者感染SARS-CoV-2 康复后IgM 和IgG 抗体阳性率及S/CO 值随时间变化情况(T1—T7的7 个时间点,跨度14~15 周),共计纳入54 人,检测结果显示时间段内IgM 检测阳性率在SARS-CoV-2 康复2周时最高,为20.37%,S/CO 值随时间变化先上升后下降。IgM 检测阳性率明显低于其他研究[13],说明随着SARS-CoV-2 致病性的下降,机体能更快清除病原体。 IgG 检测阳性率在2~14 周内均为100%, S/CO 值随时间变化逐步降低,这与其他研究一致[14];其中T7时间点的S/CO 值比T6时间点稍高,可能是因为部分献血者只提供了6 次血浆标本,导致T7时间点纳入的对象较少,可能造成了一定的偏移。 有文献指出,在COVID-19 恢复期血浆捐献者中,男性、年长者体内的抗体滴度更高[15],而本研究结果显示IgG 抗体及IgM 抗体的S/CO 值在不同性别(男/女)及年龄段(18 ~39 岁/40 ~60岁)的献血者间比较均无差异(P>0.05),可能是由于标本量较少导致。
虽然SARS-CoV-2 咽拭子检测阳性不代表血液中能够检测到SARS-CoV-2 完整病毒或病毒核酸(RNA 血症),但不能完全排除经血传播风险。 相反,对于经SARS-CoV-2 感染后康复的人群,如其咽拭子核酸检测阴性而IgM 和IgG 均为阳性,则提示体内病毒被清除,但IgM 尚未达到检测下限。 排除咽拭子核酸检测假阴性后,理论上血液中不存在SARSCoV-2,经血传播风险可以忽略。 “恢复期血浆疗法”(convalescent plasma therapy)[16]是在疫情初期,疫苗接种未普及、特效治疗药物未能有效开发的情况下针对重症患者使用[17],其主要是利用“中和抗体”竞争性结合受体结合域来抑制SARS-CoV-2 的感染和扩散,帮助免疫系统有效地清除感染[18]。 但“恢复期血浆疗法”对于献血者选择和中和抗体滴度均需要有严格的要求[19]。 大部分人在感染SARS-CoV-2后会在2~3 周内康复,但是部分人会出现持续的症状影响心血管系统、消化系统、神经系统等,这些症状会持续数周或数月,甚至可能更长时间[20],被称为“长期影响新型冠状病毒感染”的现象(长COVID)[21]。 长COVID 对血液安全的威胁往往被忽略,虽然献血者IgM 抗体及/或IgG 抗体阳性,但因为SARS-CoV-2 会长时间存在于长COVID-19 献血者体内或造成RNA 血症[22],所以不能完全排除SARS-CoV-2 经血传播风险[23]。
本研究结果显示献血者感染SARS-CoV-2 康复后2 ~15周内IgG 抗体阳性率为100%,为献血者感染SARS-CoV-2 康复后献血的血液安全提供了数据支持[24]。 本研究尚存在不足之处:1)研究对象并未做SARS-CoV-2 咽拭子核酸检测,仅在献血征询时候要求SARS-CoV-2 核酸检测阳性延迟献血(默认为献血者均为SARS-CoV-2 核酸检测阴性);2)本研究使用的检测方法是新冠病毒抗体IgM 和IgG 定性检测方法,S/CO 值不代表待检标本中的抗体量,最好的办法是采用血浆标本连续稀释的方法,以最终能检出的最高稀释度代表抗体的相对量,以此可观察T1—T7时期内抗体的变化情况;3)因为条件限制,暂未能开展SARS-CoV-2 中和抗体检测实验;4)在后疫情时代无偿献血者SARS-CoV-2 IgG S/CO 值随时间变化逐步下降,能够维持多久时间需要进一步追踪研究[25];5)本研究标本量相对较少,可能存在偏倚。
致谢:感谢南宁中心血站机采科所有同志在血液标本采集工作上予以的支持。
利益冲突:所有作者均声明不存在利益冲突。
