辐照血液临床应用中国专家共识
2023-11-30辐照血液临床应用中国专家共识编写组
辐照血液临床应用中国专家共识编写组
输血相关移植物抗宿主病(transfusion associated graft versus host disease, TA-GVHD)是1 种罕见且严重的输血不良反应,发病率约为百万分之一,易感人群发病率约为0.1%~2%[1-4]。 主要临床表现为发热、全血细胞减少、皮疹、肝损伤、胃肠道症状,目前缺乏有效的治疗手段,病死率约90%[1,3,5]。 目前国际上公认预防TA-GVHD 最为有效的方法是辐照血液。 我国在辐照血液的应用上发展相对缓慢,尚未形成完善的行业标准和指南。 为规范并促进辐照血液在我国的合理应用,我们联合国内输血医学、血液病学及儿科学领域专家共同撰写本共识,旨在为临床医务人员提供辐照血液使用的明确指导,以期最大程度降低受血者TA-GVHD 的发生风险,同时避免辐照血液的超适应证使用。
本共识编写组于共识制订过程中系统检索了PubMed、中国知网、万方数据库和中国生物医学文献数据库等国内外主要数据库从建库至2023 年2 月发表的文献,检索词为“transfusion associated graft versus host disease”、“irradiated blood”、“输血相关移植物抗宿主病”、“辐照血”及其他相关的关键词,并对相关文献进行了充分复习。 为更好地指导临床实践,本共识参考GRADE 分级的指导原则形成最终推荐意见[6]。 推荐级别及证据质量等级分级见表1[6]。 证据质量等级是决定推荐等级的主要因素之一,但由于TA-GVHD的低发病率和高病死率,目前没有随机对照试验,大部分数据来自个案报道、病例系列研究和血液安全预警系统。 此外,由于TA-GVHD 发病风险受人群遗传多样性的影响,而HLA基因在不同人种、不同地区的分布存在很大差异,例如日本人群优势HLA单体型A*3303-B*4403-DR*1302 频率为9.8%,而中国人群优势HLA单体型A*02-B*46-DR*09 频率为4.56%,这导致各国基于HLA基因频率预测的TA-GVHD风险差异很大[7,8]。 因此,不同国家对于TA-GVHD 高风险人群的识别存在区别,制定指南的依据和相应的建议也存在相当大的差异。 本共识在充分评估证据质量等级基础上,参考国外辐照血液应用相关指南,综合我国具体情况、临床可行性等相关因素确定推荐等级。
一、概述
(一)辐照血液的定义
使用一定剂量的放射线(Χ 或γ 射线)对全血或血液成分进行照射,使血液中的T 淋巴细胞失去增殖活性所制成的血液制剂,其目的是预防TA-GVHD 的发生。 辐照后血液制剂的质量控制要求与原血液制剂要求相同[9]。
(二)辐照血液预防TA-GVHD 的机制
当受者输入含有供者免疫活性淋巴细胞(主要是T 淋巴细胞)的血液及血液成分后,不被受者免疫系统识别和排斥,供者淋巴细胞在受者体内植活,增殖并攻击受者的组织器官及造血系统导致TA-GVHD 的发生。 这一过程主要受3 个因素影响:1)供者T 淋巴细胞的数量和活性;2)受者的免疫功能状态;3)供受者是否存在HLA 单向匹配(供者为纯合子而受者为杂合子并且其中1 个等位基因或抗原与供者相合)。其中输入一定数量的活性T 淋巴细胞是导致TA-GVHD 的必备条件。 一般认为引起TA-GVHD 需输入1×107/kg 以上的淋巴细胞,但在免疫功能缺陷儿童中有低至1×104/kg 的淋巴细胞即引起TA-GVHD 的病例报道,然而所需的最低淋巴细胞数量尚不明确[10]。 因此,减少活性淋巴细胞的输入是预防TA-GVHD 的主要方法之一。 目前的白细胞去除技术可去除99.9%的白细胞,虽可降低TA-GVHD 风险,但并不能完全预防TA-GVHD 发生。 有文献总结了348 例TA-GVHD 病例其中有66 例发生在输注去白细胞血液的患者中[5]。 采用Χ 或γ 射线照射血液可使其淋巴细胞内的DNA 损伤致其失活,从而抑制其在受血者体内增殖[11]。 25Gy 照射剂量时活性淋巴细胞可减少5 个对数级以上,并低于有限稀释法检测下限[12]。 日本自实行血液辐照政策后未再报道TA-GVHD病例[13]。 因此,辐照血液可有效预防TA-GVHD。
【推荐意见】
对全血或血液成分进行白细胞去除可降低TA-GVHD 发生率,但不能作为辐照血液的替代措施。 (1/B)
(三)国内外辐照血液应用进展
TA-GVHD 发病机制上的差异导致日本和欧美国家辐照血液策略不同[13]。 日本曾是全球TA-GVHD 发生率最高的国家,大多数TA-GVHD 的发生归因于HLA 单向匹配,基于HLA 抗原分布推测TA-GVHD 的发生风险高于欧美国家5~10 倍[4]。 日本输血和细胞治疗学会的辐照指南经历了5 次更新,至2009 年指南要求,除新鲜冰冻血浆外对所有同种异体血液进行辐照。 目前日本所有受血者均接受辐照红细胞和辐照血小板,日本红十字会负责辐照90%的红细胞及98%的血小板,其余部分由配备辐照装置的医疗机构负责辐照[13,14]。 欧美国家的TA-GVHD 多发生于免疫功能缺陷人群,其辐照适应证主要与严重免疫抑制的疾病有关。 英国、加拿大、澳大利亚、新西兰、荷兰、挪威等国家均发布了相应的辐照血液应用指南,最新的辐照血液成分应用指南由英国血液学会于2020 年发布[15-18]。 随着辐照血液的规范应用,2010 年~2019 年期间英国仅有956 次符合辐照血液适应证却因各种原因未予以辐照的事件发生。 英国严重输血危害(Serious Hazards of Transfusion,SHOT)报告系统自2013 年后未再有TA-GVHD 报告[15]。 加拿大血液服务中心提供的数据表明辐照红细胞应用比例由2004~2005 年的4.5%增加到2015~2016 年的6.7%[18]。 2014 年美国对大约2100 家机构的调查显示,36%~63%的机构对TA-GVHD 高风险患者应用辐照血液,也有少数机构实行普遍辐照政策[10]。 近年来美国血液与生物治疗促进协会(Association for the Advancement of Blood & Biotherapies,AABB)已认可部分病原体灭活技术(如INTERCEPT 血液处理系统)灭活的血小板可替代辐照血小板,未来有望在部分领域替代现有辐照技术[19]。
国内辐照血液应用已有二十余年历史,但存在发展缓慢、认识不足、应用不规范等诸多问题。 一方面临床医生对辐照血液的作用及辐照血液适应证了解较少,导致部分应接受辐照血液的患者未能应用辐照血液。 同时,由于临床医生对于TA-GVHD 的认识不足,导致漏诊误诊,TA-GVHD 报告率极低。 另一方面,由于目前只有少数采供血机构和医院开展血液辐照技术,截至2020 年12 月我国安装的血液辐照仪不到100 台,红细胞辐照的比例不到5%,远远不能满足临床对辐照血液的需求[20]。 此外,极少部分能提供血液辐照技术的机构可能存在辐照血液适应证不明确导致辐照血液过度应用的现象。 因此,国内对辐照血液的认识及临床合理应用亟待提高。
二、辐照血液技术要点
(一)放射源
用于血液辐照的射线一般为Χ 射线或γ 射线,γ 射线的放射源又可分为同位素铯源(137Cs)和钴源(60Co)。 同等辐照剂量下Χ 射线和γ 射线对T 淋巴细胞的灭活能力相似,对红细胞及血小板功能的影响也相似[21-25]。 Χ 射线与γ 射线血液辐照设备性能参数比较见表2,两者的辐照效果相当,均可安全应用于医疗机构或采供血机构。 基于对放射防护安全性的考虑,目前Χ 射线血液辐照设备有逐渐取代同位素放射源设备的趋势。 国内采供血机构或医疗机构可根据自身需求选用Χ 射线或γ 射线血液辐照设备,但相关环境、设施必须符合相关法律法规的要求。
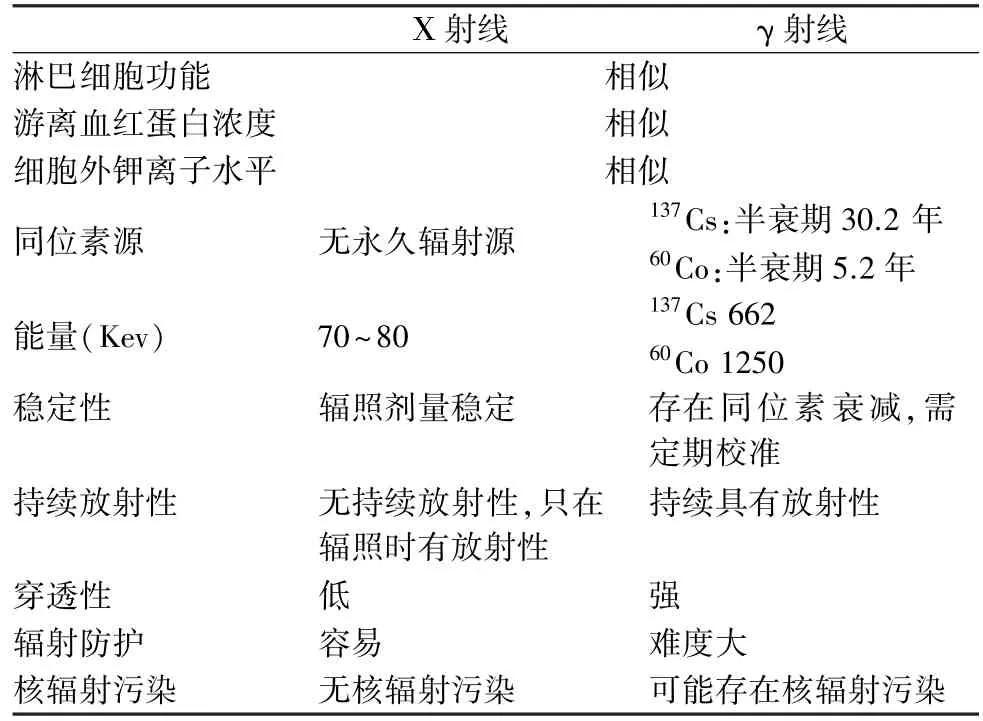
表2 Χ 射线与γ 射线血液辐照设备性能参数比较
(二)辐照剂量
最佳的辐照剂量是在不损伤有效血液成分的前提下能够完全抑制淋巴细胞的有丝分裂能力。 淋巴细胞是对辐照处理最为敏感的细胞。 辐照对淋巴细胞功能的影响呈剂量依赖性,辐照剂量分别为5、10、15、20、25、30Gy 时,活性T 淋巴细胞分别减少1.3、2.8、4.4、4.7、5.3、5.5 个对数级,并且在25Gy 和30Gy 时检测不到T 淋巴细胞增殖[26]。 因此,为确保T 淋巴细胞完全失去活性,建议辐照剂量不低于25Gy[26]。目前尚无患者在接受25Gy 及以上辐照血液后发生TAGVHD 的报道,而接受低于此辐照剂量血液时仍有病例报道。
各国推荐的辐照剂量略有不同。 日本推荐的辐照剂量为15~50Gy[16]。 AABB 规定血袋中心部位的辐射剂量≥25Gy 且<50Gy,血液成分任何部位的最小辐照剂量必须≥15Gy[27]。 欧洲标准要求的辐照剂量为血液成分任何部位的辐照剂量必须≥25Gy 且<50Gy[28]。 国内2019 版《血站技术操作规程》中规定血液辐照最低剂量为25Gy,血液任何位点的辐照剂量不宜超过50Gy[29]。
为确保辐照血液产品的质量,血液辐照设备必须定期按要求进行监测、校准和质量控制,包括剂量校正和放射分布校正。 此外辐照血液产品应粘贴血液辐照指示卡,通过指示卡颜色变化可区分辐照与未辐照血液并确认辐照剂量[30]。
【推荐意见】
血液辐照最低剂量为25Gy,血液任何位点的辐照剂量不宜超过50Gy。 (1/B)
(三)需辐照的血液
理论上对于TA-GVHD 高风险患者(指本共识辐照血液临床应用部分推荐的应用辐照血液的患者)输注含活性T 淋巴细胞的异体血液均应进行辐照处理。 迄今为止输注全血、红细胞(不包括冰冻解冻去甘油红细胞)、血小板、粒细胞后均有TA-GVHD 报道。 输注冰冻解冻去甘油红细胞虽未见TA-GVHD 病例报道,但研究发现冰冻解冻去甘油红细胞中仍残留有免疫活性的淋巴细胞,残留白细胞数约为1×107/单位(430~450 mL 全血),因此冰冻解冻去甘油红细胞推荐辐照[31,32]。 尽管新鲜冰冻血浆解冻后仍存活少量T 淋巴细胞(约为2×104/200 mL 全血),但至今未见与冰冻血浆、冷沉淀及其他血浆提取成分相关的TA-GVHD 病例报道,且各国指南均不推荐对冰冻血浆成分血进行辐照,因此不建议对新鲜冰冻血浆、冰冻血浆、冷沉淀及其他血浆提取成分进行辐照[14,15,17,33]。
由于亲属之间可能存在共同的HLA 单体型,输注亲属的血液发生TA-GVHD 的风险较高。 输注来自父母、同胞及二级亲属的血液发生TA-GVHD 风险分别是输注无亲缘关系供者血液的7~17 倍、4 ~9 倍和1.5 ~5 倍[34]。 另有研究报道美国人群中一级亲属间输血TA-GVHD 的风险增加21 倍、德国人群中该风险增加18 倍、日本人群中该风险增加11倍[7]。 Kopolovic 等[5]报道的348 例TA-GVHD 中有50 例为输注亲属血液的病例。 因此,无论患者是否存在免疫功能缺陷,只要输注一级或二级亲属的全血或血液成分(红细胞、血小板、粒细胞)均应进行辐照。 同时,临床上应最大程度避免输注来自一级或二级亲属的血液。 HLA 配型的血液大大增加了供受者之间出现HLA 单向匹配的几率,有文献报道风险可达40%[35]。 因此,HLA 配型的全血或血液成分(红细胞、血小板、粒细胞)均应进行辐照。
【推荐意见】
1)对所有TA-GVHD 高风险患者输注全血或血液成分(红细胞、血小板、粒细胞)时均应辐照,其中冰冻解冻去甘油红细胞推荐辐照。 (1/B)
2)新鲜冰冻血浆、冰冻血浆、冷沉淀及其他血浆提取成分(凝血因子浓缩物、白蛋白和静脉注射免疫球蛋白)不需辐照。 (1/B)
3)输注一级或二级亲属、HLA 配型的全血或血液成分(红细胞、血小板、粒细胞)均应进行辐照。 (1/B)(四)不同血液成分辐照时机和储存期限
1.红细胞
关于红细胞辐照时机和储存期的规定主要依据储存过程中淋巴细胞数量及活性、可接受的溶血水平和细胞外钾离子水平。 有研究报道红细胞储存至27 d 时存活淋巴细胞数量不发生明显变化,但淋巴细胞CD2、CD3、CD4、CD28、CD45等表面抗原表达下降,T 淋巴细胞增殖活化能力下降[36]。TA-GVHD 发生率随红细胞储存时间延长降低,93.7%的TAGVHD 患者输注的血液为储存10 d 以内,输注储存14 d 以上的血液未见TA-GVHD 报道[5]。 因此TA-GVHD 高风险患者输注红细胞时,若输注采集后14 d 内的红细胞则均应辐照,若输注储存15 ~28 d 的红细胞因仍残留有一定TAGVHD 风险也可考虑辐照。 辐照红细胞在储存期间钾离子水平、游离血红蛋白浓度、乳酸和乳酸脱氢酶水平逐渐增加,钠离子、葡萄糖、2,3-二磷酸甘油酸水平随时间延长显著下降,以上指标变化程度较非辐照红细胞更明显,但不具有显著临床意义[37-39]。 采集后早期辐照的红细胞比晚期辐照的红细胞损伤相对较轻,最佳辐照时间在采集后14 d 内[40,41]。基于辐照红细胞功能的研究表明,新鲜辐照红细胞相较于储存辐照红细胞在携氧能力和改善脑氧饱和度方面更具优势,推测慢性贫血的患者可能更受益于新鲜辐照的红细胞[42]。此外有研究显示辐照红细胞储存1 周以上时非过敏性输血反应(主要指输血相关非溶血性发热反应)显著增加[43]。
国内2019 版《血站技术操作规程》规定全血及红细胞应在采集后14 d 内辐照,辐照后可再储存14 d 且不超过原保存期[29]。 英国指南的辐照红细胞辐照时间及储存时间建议与我国相同[15]。 AABB 规定保存期内的红细胞均可辐照,辐照后的保存期为28 d,或同血液辐照前的原保存期,但必须以较短者为准[27]。
【推荐意见】
TA-GVHD 高风险患者输血时,储存14 d 内的全血或红细胞均应辐照,辐照后储存时间不超过14 d 或原保存期(以时间短者优先)。 储存15~21 d 的全血或15~28 d 的红细胞可考虑辐照,辐照后尽早使用。 (1/B)
2.血小板
辐照对血小板数量没有明显影响,辐照后血小板储存第5 天血小板计数有小幅下降但仍在可接受的质量控制范围内[44]。 一项回顾性研究显示,输注辐照后储存时间短于24 h的血小板其1 小时血小板恢复率与未辐照血小板相比无显著差异,若输注辐照后储存时间超过24 h 的血小板则1 小时血小板恢复率下降且低于30%[45]。 辐照可能导致血小板的蛋白质组学/代谢组学变化,但小于50Gy 的辐照剂量对血小板功能不产生有临床意义的影响[46,47]。 目前各国指南均认为血小板可在储存期内任何时间辐照,辐照后储存期限不变。
【推荐意见】
血小板在保存期内均可辐照,辐照后应尽早输注,保存期限同未辐照血小板。 (1/B)
3.粒细胞
粒细胞相较于淋巴细胞对辐照不敏感。 50Gy 的剂量辐照后粒细胞仍然具有正常的功能,包括抑菌能力、趋化迁移能力和超氧化物产生能力等[48]。 由于粒细胞保存期限只有24 h,因此应尽量缩短采集与辐照的间隔时间且辐照后尽快输注。
【推荐意见】
粒细胞应在采集后尽快辐照,辐照后应尽快输注,保存期限同未辐照粒细胞。 (1/B)
三、辐照血液临床应用
受血者免疫功能低下是TA-GVHD 发生的重要危险因素。 因此,辐照血液的临床应用主要基于受血者免疫功能状态,尤其是T 淋巴细胞免疫抑制状态及持续时间。
特别说明:下文推荐意见中的辐照血液指辐照全血、红细胞、血小板和粒细胞,不包含血浆及其提取成分。
(一)胎儿和婴幼儿
胎儿及新生儿的免疫系统与成人相比存在差异。 胎龄15 周时,T 淋巴细胞随血流从胸腺迁移至全身周围淋巴组织,并参与细胞免疫反应,但其功能欠成熟。 出生时,T 淋巴细胞功能已近完善,足月儿外周血中T 淋巴细胞计数已达成人水平,其中CD4+细胞数较多,CD4+/CD8+比值为3 ~4。 早产儿出生时T 淋巴细胞数量少,对有丝分裂原反应较低,1月龄时T 淋巴细胞数量可达到足月儿水平。
儿童TA-GVHD 病例中约70%见于新生儿[49]。 新生儿中报道的TA-GVHD 病例几乎均存在危险因素,如宫内输血、新生儿换血、先天性免疫功能缺陷或输注亲属供者血液。 日本曾报道27 例新生儿TA-GVHD,其中20 例为早产儿、10 例进行了换血治疗、22 例为亲属供者[50]。 目前胎儿和婴幼儿中尚无单纯输注血小板发生TA-GVHD 的病例报道。
胎儿和新生儿血液辐照策略应综合考虑胎儿成熟度、新生儿的日龄、免疫状态、既往输血情况。 目前一致认为宫内输血和新生儿换血需应用辐照血液,由于新生儿换血往往需求比较急,辐照应以不延误换血治疗为前提。 考虑到宫内输血可能导致免疫抑制,辐照血液需持续应用一段时间,但持续时间并不明确,英国指南中提出对有宫内输血史的患儿宜提供辐照血液成分至预产期后6 个月[15]。 各国对于早产儿或足月儿的推荐有所不同。 意大利新生儿输血指南建议出生体重≤1500g 或胎龄≤30 周早产儿输注辐照红细胞[51]。澳大利亚指南提出对胎龄<28 周或体重<900g 的早产儿应考虑提供辐照血液成分,可能情况下也考虑对所有新生儿提供辐照血液成分[17]。 英国指南认为足月新生儿免疫系统已发育成熟,可对输入的外来细胞产生足够的免疫反应,常规红细胞或血小板输注时不需辐照[15]。 而约翰霍普金斯大学医学院为避免未确诊的原发性免疫缺陷患儿发生TA-GVHD 则对所有小于6 周岁的儿童提供辐照血液成分[52]。
宫内输血、新生儿换血或大量输血的新生儿和婴幼儿高钾血症风险增加,应使用新鲜红细胞,因此建议使用采血后7 d内的红细胞进行辐照。 辐照红细胞储存过程中钾离子水平随储存时间延长逐渐升高,为降低高钾血症风险,红细胞辐照后宜24 h 内输注或洗涤后输注,若在24 h 后输注宜监测血钾水平[51,53,54]。
【推荐意见】
1)用于宫内输血(红细胞、血小板)和新生儿换血治疗的红细胞应辐照。 (1/B)
2)有宫内输血史或新生儿换血治疗史的患儿宜接受辐照血液直至预产期后6 个月。 (2/C)
3)早产儿、极低出生体重儿输血时应输注辐照血液,直至出生后1 个月或纠正胎龄至40 周。 (1/C)
4)足月儿输注红细胞和血小板时不推荐辐照(有宫内输血史、大量输血或极低出生体重新生儿除外)。 (2/C)
5)对于宫内输血、新生儿换血或大量输血的新生儿和婴幼儿,应使用采血后7 d 内的红细胞辐照,辐照后宜24 h 内输注或洗涤后输注。 (1/C)
(二)原发性免疫缺陷病
原发性免疫缺陷病中涉及T 细胞数量和/或功能缺陷的疾病是TA-GVHD 的高危因素,例如先天性胸腺发育不全综合征(DiGeorge 综合征)、重症联合免疫缺陷病、Wiskott-Aldrich 综合征等。 Kopolovic 等总结的348 例TA-GVHD 病例中有25 例(7.2%)原发性免疫缺陷病患者,2008 ~2018 年文献报道的23 例TA-GVHD 中有3 例为重症联合免疫缺陷病患者[5,15]。 单独体液免疫功能缺陷与TA-GVHD 无关,迄今为止尚无体液免疫孤立缺陷患者发生TA-GVHD 的报道[22]。
部分T 细胞免疫缺陷病患者出生后可能临床表现并不明显,导致这些患者在确诊前输注了非辐照血液。 因此若怀疑存在T 细胞免疫缺陷病即应输注辐照血液直至排除诊断。条件允许时应评价患者免疫功能状态,包括淋巴细胞亚群及对丝裂原应答反应的测定。 英国指南提出对于T 淋巴细胞计数>0.4×109/L 且初始T 淋巴细胞≥30%,并且没有其他免疫缺陷的证据时应用非辐照血液成分是安全的[15]。 对于治疗后免疫功能获得重建的患者是否仍需要输注辐照血液目前未见相关报道。
【推荐意见】
1)对于严重的先天性T 淋巴细胞免疫缺陷性疾病或重症联合免疫缺陷病患者输血时应输注辐照血液。 (1/B)
2)当怀疑存在T 细胞免疫缺陷相关疾病时,输血时应输注辐照血液。 (1/C)
(三)继发性免疫缺陷病
1.血液系统恶性肿瘤
血液系统恶性肿瘤患者通常存在一定程度的免疫功能缺陷,放化疗期间更为明显,但放化疗导致的T 淋巴细胞抑制持续时间不长。 急性淋巴细胞白血病停止化疗后3 ~6 个月CD4+T 细胞数和初始T 细胞数恢复至正常水平,CD8+T细胞数在停止化疗后6 个月内恢复正常[55]。 需要注意的是有研究表明霍奇金淋巴瘤即使在缓解期也存在细胞免疫功能缺陷[56,57]。
淋巴系统肿瘤TA-GVHD 发生率为0.1%~1%,其中霍奇金淋巴瘤比非霍奇金淋巴瘤更易发生TA-GVHD[58]。 已报道的TA-GVHD 病例中血液系统恶性肿瘤占19.3%[5]。 1996~2017 年SHOT 报道的14 例TA-GVHD 中有6 例为血液系统恶性肿瘤(3 例非霍奇金淋巴瘤、1 例华氏巨球蛋白血症、1 例多发性骨髓瘤、1 例急性淋巴细胞白血病)[15]。 Stutzman等[58]报道在105 例Ⅲ/Ⅳ期霍奇金淋巴瘤中出现2 例TAGVHD。 北京大学血液病研究所回顾性分析了397 例免疫功能低下的血液病患者输血后发生TA-GVHD 的情况,并对应用辐照血液预防TA-GVHD 的效果进行分析。 结果显示:在未予以输注辐照血液的200 例患者中发生4 例TA-GVHD(2%),其中3 例为急性淋巴细胞白血病、1 例为多发性骨髓瘤。 应用辐照血液的197 例患者无TA-GVHD 发生。 该研究结果提示在免疫功能低下的血液病患者中输注辐照血液可完全预防TA-GVHD[2]。
目前对于血液系统恶性肿瘤患者是否需要常规给予辐照血液存在不同意见。 英国指南建议对于急性白血病、非霍奇金淋巴瘤患者不常规应用辐照血液[15]。 澳大利亚指南则将急性白血病、非霍奇金淋巴瘤、B 细胞肿瘤接受放化疗导致淋巴细胞低于0.5×109/L 作为辐照血液的可能适应证[17]。值得注意的是,既往认为霍奇金淋巴瘤患者应终身接受辐照血液,但并无高质量证据支持[22]。 因此,近年来部分指南对霍奇金淋巴瘤的推荐做了修改。 英国指南虽然仍建议霍奇金淋巴瘤患者终身接受辐照血液,但推荐等级由2010 年的1/B 改为目前的2/C[15,22]。 荷兰2011 年指南推荐霍奇金淋巴瘤3/4 期为辐照血液适应证,但在新版指南中已去除这一适应证[4]。
【推荐意见】
对于急性白血病、淋巴瘤、多发性骨髓瘤放化疗期间淋巴细胞<0.5×109/L 的患者输血时宜输注辐照血液。 (2/C)
2.异基因造血干细胞移植
异基因造血干细胞移植后免疫系统的重建是1 个长期过程。 CD4+T 细胞在移植后前3 个月低于0.2×109/L,移植后1 年恢复到0.3×109/L,5 年恢复到0.45×109/L,约20~30年后恢复正常水平。 在减低强度预处理移植中,CD4+T 细胞恢复至0.2×109/L 的时间延迟至移植后9 个月。 异基因造血干细胞移植后CD8+T 细胞重建约为2~6 个月[8]。
异基因造血干细胞移植一直被认为是辐照血液的适应证,Kopolovic 等[5]关于TA-GVHD 的系统综述中有少部分患者的TA-GVHD 发生于造血干细胞移植后。 有研究者对行减低强度预处理异基因造血干细胞移植的83 例患者予以输注非辐照去白细胞血液,无TA-GVHD 发生,且移植相关GVHD和总生存率与输注辐照去白细胞血液组无差别,但细菌感染率较输注辐照去白细胞血液组明显增加[59]。 由于TAGVHD 与移植相关GVHD 临床表现极为相似导致鉴别困难,可能存在较高的漏诊率。
目前一致认为异基因造血干细胞移植患者输血时应接受辐照,但何时开始及何时停止使用辐照血液未形成统一意见。 尚无高级别证据可用于判断停止使用辐照血液的安全时限。 欧洲血液和骨髓移植手册推荐从预处理开始直至异基因移植后至少6 个月或直至免疫功能重建需使用辐照血液[60]。 英国指南明确在造血干细胞植入和淋巴系统重建之前使用辐照血液[15]。 澳大利亚指南建议辐照血液成分应持续使用至移植后至少12 个月或直到淋巴细胞>1×109/L[17]。耶鲁大学医学院则认为由于疾病复发等风险对此类患者应终身使用辐照血液[61]。
【推荐意见】
1)所有接受异基因造血干细胞移植的患者输血时应输注辐照血液。 (1/B)
2)辐照血液应在异基因造血干细胞移植患者预处理时即开始提供,一直持续至满足以下所有标准:①移植后满6~12 个月;②淋巴细胞计数>1×109/L;③已停用所有免疫抑制剂。 (1/C)
3.自体造血干细胞移植
自体造血干细胞移植对免疫功能的影响低于异基因造血干细胞移植。 自体造血干细胞移植后6 个月T 淋巴细胞数量和功能恢复正常[8]。 国内外有少量自体造血干细胞移植后出现TA-GVHD 的报道[62]。 由于患者在干细胞采集前可能需要输血,理论上输注异体血液中的淋巴细胞有可能混入采集的干细胞中,为避免此种情况发生,采集前输注的异体血液可考虑辐照。
欧洲血液和骨髓移植手册推荐自体造血干细胞移植患者在干细胞采集前2 周至移植后至少3 个月需接受辐照血液成分[60]。 英国指南推荐在采集干细胞前7 天及自预处理开始至自体造血干细胞移植后3 个月(预处理方案含全身放疗者延长至移植后6 个月)应给予辐照血液成分[15]。
【推荐意见】
1)所有接受自体造血干细胞移植的患者从预处理开始输血时应输注辐照血液,持续时间至移植后3~6 个月。 (1/C)
2)自体骨髓和外周血造血干细胞采集前7 天内输注异体血液时可给予辐照血液。 (2/C)
4.使用抑制细胞免疫功能的药物
多种药物可导致细胞免疫功能抑制,如嘌呤类似物(氟达拉滨、克拉屈滨、苯达莫司汀等)、抗-CD52 单克隆抗体、抗胸腺细胞球蛋白(antithymocyte globulin, ATG)等。 应用嘌呤类似物的患者在治疗后2~3 个月CD4+细胞下降到和获得性免疫缺陷综合征相似的水平,并可持续多年[63]。 抗-CD52 单克隆抗体应用后CD8+细胞恢复至>0.2×109/L 需20 个月,CD4+细胞恢复至>0.4×109/L 需35 个月[64]。 ATG 导致的CD4+细胞衰竭的持续时间约为6 个月。 已有多例氟达拉滨相关TA-GVHD 报道,甚至有研究在8 例接受氟达拉滨治疗的慢性淋巴细胞白血病患者中发现了3 例TA-GVHD[65,66]。此外在应用克拉屈滨、抗-CD52 单克隆抗体及ATG 的患者中均有TA-GVHD 的报道[67,68]。 单独抑制体液免疫功能的药物如利妥昔单抗不会增加TA-GVHD 风险。
氟达拉滨、克拉屈滨说明书中均指出正在接受或已经接受该药物治疗的患者,在需要输血时应该只接受经过辐照处理的血液。 不过从开始应用去白细胞血液成分后,英国未再有继发于嘌呤类似物的TA-GVHD 的报道,因此2020 年英国指南将对用嘌呤类似物的患者终身应用辐照血液成分的推荐等级由1/B 调整至2/C[15,69]。 2008 年欧洲血液与骨髓移植重型再障工作组对再生障碍性贫血患者应用ATG 治疗后血液辐照情况进行调查,结果表明85%的骨髓移植中心在ATG 应用后常规使用辐照血液,但各中心对于辐照血液成分应用持续时间不一,短至6 个月,长至终身接受辐照血液[68]。 目前新的免疫抑制剂或生物制剂不断出现,并且随着接受已上市药物治疗患者的逐渐增多,需及时评估药物是否会增加TA-GVHD 发生风险。
【推荐意见】
接受嘌呤类似物、ATG 治疗的患者输血时宜输注辐照血液,持续时间至少6~12 个月。 (2/C)
5.嵌合抗原受体T 细胞治疗
近年来,嵌合抗原受体T 细胞(chimeric antigen receptor T cell, CAR-T)免疫治疗应用于多种血液系统肿瘤(急性白血病、淋巴瘤、多发性骨髓瘤等),并在实体肿瘤、自身免疫系统疾病中开展了诸多临床研究。 CAR-T 的治疗过程包括采集自体外周血淋巴细胞、清除淋巴细胞预处理、CAR-T 细胞回输。 在细胞采集阶段应避免混入异体淋巴细胞。 清除淋巴细胞预处理方案通常含氟达拉滨,会对T 淋巴细胞产生持续深度抑制。 另外CAR-T 细胞回输后的免疫重建过程也需要较长时间。 阿基仑赛(靶向CD19 的CAR-T 细胞)治疗复发/难治大B 细胞淋巴瘤后,淋巴细胞恢复至1×109/L 以上需1 年,其中CD8+细胞1 年时全部恢复正常,但有33%的患者CD4+细胞1 年时未达到0.2×109/L[70]。 目前尚未见与CAR-T 治疗相关的TA-GVHD 报道。 英国指南提出CAR-T治疗后3 个月内应输注辐照血液成分[15]。
【推荐意见】
接受CAR-T 细胞免疫治疗的患者从预处理开始输血时宜输注辐照血液,持续时间至少12 个月。 CAR-T 治疗的患者外周血淋巴细胞采集前7 天输注异体血液时可给予辐照血液。 (2/C)
6.其他
再生障碍性贫血患者往往存在由免疫细胞及其分泌的负向调控因子紊乱导致的免疫功能异常。 但在再生障碍性贫血患者中不存在严重T 细胞免疫功能受损,此类患者CD8+T 细胞数量显著增多,CD4+T 细胞中Th1 细胞比例显著升高,提示再生障碍性贫血本身不会增加TA-GVHD 风险[71]。 但再生障碍性贫血患者常需行异基因造血干细胞移植和/或使用ATG 从而抑制T 细胞功能,这些治疗措施可能会增加TA-GVHD 的发生风险。
获得性免疫缺陷综合征是1 种严重细胞免疫缺陷性疾病,故理论上极易发生TA-GVHD,但至今尚未见相关病例报告。 原因可能有:(1)由于TA-GVHD 的某些临床表现与获得性免疫缺陷综合征相似导致漏诊或误诊;(2)人类免疫缺陷病毒对供者T 淋巴细胞进行攻击,导致供者T 淋巴细胞丧失免疫识别能力。 目前各国指南均未推荐对获得性免疫缺陷综合征患者提供辐照血液。
自1999 年英国开始应用去白细胞血液后有超过50 000例实体器官移植患者,均无TA-GVHD 病例报道[15]。 甚至有报道对接受抗-CD52 单克隆抗体预处理的肾移植患者输注未辐照血液,亦无TA-GVHD 发生[72]。 因此,无充足证据表明实体器官移植患者需要输注辐照血液。
实体肿瘤患者TA-GVHD 风险并不增加。 目前有少量实体肿瘤发生TA-GVHD 的报道,但这些病例大多发生于合并其他TA-GVHD 高危因素如自体造血干细胞移植或使用嘌呤类似物的患者中,因此目前没有明确证据表明实体肿瘤患者需应用辐照血液[17]。
【推荐意见】
对于再生障碍性贫血、人类免疫缺陷病毒感染/获得性免疫缺陷综合征患者、实体肿瘤患者或实体器官移植患者不推荐使用辐照血液,除非患者输注粒细胞、HLA 配型血液、来自一级或二级亲属的血液或有他相关治疗病史(如造血干细胞移植、ATG、嘌呤类似物治疗等)。 (1/B)
本共识基于现有的文献证据和专家意见,主要对辐照血液相关技术要点和临床应用做出推荐,希望能够促进采供血机构合理供应及医疗机构合理应用辐照血液。 但由于TAGVHD 相关研究领域缺乏高质量的循证证据,因此本共识中的推荐意见证据等级普遍偏低,多系国内相关领域专家在已有证据基础上充分讨论后形成的一致性建议。 随着相关基础研究及临床研究的不断深入,期待出现更多的证据,积累更多的经验,以形成更具有规范性和指导性的指南。
本共识署名单位排名不分先后,并列第一
本共识专家组成员(以专家姓氏笔画排序):
北京大学肿瘤医院内蒙古医院(内蒙古医科大学附属肿瘤医院) 于天为,临沂市人民医院 于连玲,解放军总医院第一医学中心 于洋,烟台毓璜顶医院 于淑红,联勤保障部队第九〇〇医院 马立强,山东大学齐鲁医院 马现君,解放军总医院第一医学中心 马春娅,烟台毓璜顶医院 马俊杰,河北省儿童医院 马莉,清华大学附属北京清华长庚医院 马海梅,沈阳市妇婴医院 马铭梓,首都医科大学附属北京儿童医院 马曙轩,广元市中心医院 王大方,遂宁市中心医院 王远杰,深圳市血液中心 王宋兴,大连医科大学附属第二医院 王忠利,西安交通大学第一附属医院 王宝燕,中国医科大学附属盛京医院 王秋实,中南大学湘雅二医院 王勇军,吉林大学第一医院 王晓宁,解放军总医院海南医院 王海宝,青岛大学附属医院王海燕,中国科学技术大学附属第一医院(安徽省立医院)王敏,北京大学第一医院王鹏,航天中心医院王新华,上海交通大学医学院附属上海儿童医学中心 王静,安徽医科大学第一附属医院 卞茂红,中国人民解放军陆军军医大学大坪医院 文爱清,空军军医大学第一附属医院 尹文,中国医学科学院北京协和医院 甘佳,淄博市第一医院 石海燕,福建省肿瘤医院 叶先仁,福建医科大学附属协和医院 付丹晖,西安国际医学中心医院 白艳丽,南昌大学第一附属医院 乐爱平,新疆军区总医院 邢颜超,郑州大学第一附属医院 吕先萍,宁波大学附属第一医院 吕定丰,南京中医药大学附属南京中医院 朱培元,海口市人民医院 伍燕,湖北省天门市第一人民医院 向健,解放军总医院第一医学中心 庄远,山东第一医科大学第一附属医院(山东省千佛山医院) 刘小信,湖北医药学院附属医院(十堰市太和医院)刘久波,浙江大学医学院附属邵逸夫医院 刘志伟,河北省人民医院 刘建辉,陕西省人民医院 刘春风,兰州大学第一医院 刘春霞,吉林大学白求恩第三医院 刘铁梅,联勤保障部队第九四二医院 刘海峰,山西医科大学第二医院 刘培贤,山东第一医科大学附属省立医院 刘新,大连市中心医院 安晓华,石家庄市人民医院 安翠平,山西省人民医院 许大巍,吉林市中心医院 许丽影,中国医学科学院血液病医院(中国医学科学院血液学研究所)孙佳丽,潍坊市人民医院 孙福廷,北京大学肿瘤医院 孙巍,南华大学附属第一医院 阳志勇,山东大学第二医院 芦鑫,柳州市工人医院 苏茜,天津医科大学总医院 杜春红,首都医科大学附属北京友谊医院 李小飞,天津市第一中心医院 李代红,中南大学湘雅医院 李宁,兰州大学第一医院 李宇宁,上海交通大学医学院附属第六人民医院 李志强,柳州市人民医院 李丽敏,中南大学湘雅三医院 李昕,贵州医科大学附属医院 李艳菊,山西省中西医结合医院 李海宏,中国医学科学院肿瘤医院 李喜莹,北华大学附属医院 李尊严,空军特色医学中心 李翠莹,中国医学科学院血液病医院(中国医学科学院血液学研究所)杨文钰,解放军总医院第一医学中心 杨光,云南省第一人民医院 杨同华,陕西省人民医院 杨江存,海南医学院第一附属医院 杨丽云,贵州省人民医院 杨眉,河北医科大学第二医院 杨敬芳,海南省人民医院 吴巨峰,解放军总医院第七医学中心 吴涛,联勤保障部队第九六二医院吴霜,赣南医学院第一附属医院 邱芳,重庆医科大学附属第一医院 余泽波,哈尔滨医科大学附属第二医院 汪辉,解放军总医院第一医学中心 汪德清,武汉大学中南医院 沈长新,上海交通大学医学院附属儿童医学中心 沈树红,河南省传染病医院 宋继军,赤峰学院附属医院 张龙,深圳大学总医院张印则,吉林省肿瘤医院 张冬霞,广西钦州市第一人民医院张光文,沈阳市第九人民医院 张传树,蚌埠医学院第一附属医院 张军,天津市天津医院 张凯,西藏军区总医院 张泉,云南省第一人民医院 张婵,解放军总医院第一医学中心 张婷,首都医科大学附属北京朝阳医院 张蕾,重庆医科大学附属第二医院 陆华,山西省运城市中心医院 陈云科,内蒙古自治区人民医院 陈凤,新疆维吾尔自治区人民医院 陈伟,南京大学医学院附属鼓楼医院 陈青,浙江省人民医院 陈秉宇,浙江大学医学院附属儿童医院 陈学军,联勤保障部队第九二三医院 陈要朋,四川大学华西第二医院 陈剑,首都医科大学附属北京世纪坛医院 陈麟凤,深圳市第二人民医院/深圳大学第一附属医院 邵超鹏,河北省儿童医院 邵智利,贵州省黔西南州人民医院 武林,吉林市化工医院 范垂姝,温州医科大学附属第二医院 林甲进,解放军总医院第一医学中心 林洁,解放军总医院第四医学中心 欧阳锡林,吉林市人民医院 罗微,沧州市人民医院 金艳,南京医科大学第一附属医院 周小玉,南方医科大学深圳临床医学院 周世乔,广西医科大学第一附属医院 周吉成,南方医科大学南方医院 周华友,北京陆道培医院 周菁,南部战区总医院 周谋,中国医学科学院血液病医院(中国医学科学院血液学研究所) 庞爱明,玉林市第一人民医院 庞德,中部战区总医院 郑山根,北部战区总医院郑伟,新疆医科大学第一附属医院 居敏,昆明市儿童医院 屈柯暄,深圳市人民医院 孟庆宝,解放军总医院第八医学中心孟祥红,新疆医科大学附属中医医院 赵刚,河北医科大学第四医院 赵学涛,贵黔国际总医院 赵树铭,青海红十字医院赵铁民,河南省儿童医院 赵鼎,中国医科大学附属第一医院郝一文,空军军医大学第一附属医院 胡兴斌,华中科技大学同济医学院附属武汉儿童医院 胡红兵,中国人民解放军联勤保障部队第九二四医院 胡松林,北京医院 胡俊华,海军军医大学第一附属医院 查占山,北京大学人民医院 侯瑞琴,南昌大学第二附属医院 饶美英,德阳市人民医院 姜天华,广州市妇女儿童医疗中心 洪婕,厦门大学附属第一医院 洪强,山东第一医科大学附属省立医院 浑守永,贵州医科大学附属医院 祝丽丽,中国人民解放军陆军军医大学第一附属医院姚春艳,首都医科大学宣武医院 姚洁,解放军总医院第五医学中心 骆群,四川大学华西医院 秦莉,贵阳市第一人民医院秦梅,四川省医学科学院·四川省人民医院 袁红,解放军总医院第五医学中心 袁顺宗,首都儿科研究所附属儿童医院耿凌云,中南大学湘雅三医院 桂嵘,复旦大学附属华山医院夏荣,西安大兴医院 夏爱军,福建省漳州市医院 原敏,广州市妇女儿童医疗中心 顾晓琼,海军军医大学第一附属医院钱宝华,武汉大学人民医院 徐朴,中国医科大学附属盛京医院 徐刚,浙江大学医学院附属儿童医院 徐晓军,东部战区总医院 栾建凤,空军军医大学第一附属医院 高广勋,吉林大学第一医院 高素君,吉林医药学院附属医院 郭路生,江西省人民医院 唐长玖,海军军医大学第二附属医院 唐晓峰,西南医科大学附属医院 黄远帅,解放军联勤保障部队第九六〇医院 黄象艳,哈尔滨医科大学附属第一医院 曹荣祎,济宁医学院附属医院 常洪劲,中国人民解放军西部战区总医院 彭涛,安徽医科大学第一附属医院 葛健,昆明医科大学第一附属医院 董伟群,中国人民解放军总医院第六医学中心 蒋学兵,武汉儿童医院 曾凌空,温州医科大学附属第一医院 谢作听,浙江大学医学院附属第一医院 谢珏,广西医学科学院·广西壮族自治区人民医院 蓝梅,吉林省人民医院 赖增新,湖南省人民医院 雷平,上海交通大学医学院附属瑞金医院 蔡晓红,广西医科大学第三附属医院 廖燕,联勤保障部队第九四〇医院 樊红艳,宁夏回族自治区人民医院 樊瑞军,广西医学科学院·广西壮族自治区人民医院 黎海澜,解放军总医院第三医学中心 潘纪春,河南省人民医院 燕备战,解放军总医院第五医学中心 薄剑,空军军医大学第二附属医院 穆士杰,中国人民解放军联勤保障部队第九二〇医院 戴莹,华中科技大学同济医学院附属同济医院魏晴
执笔人:林洁(解放军总医院第一医学中心)、庄远(解放军总医院第一医学中心)
通信作者:于洋,Email:yuyangpla301@163.com