胃肠道恶性肿瘤患者术后静脉血栓栓塞症的危险因素
2023-11-30楼能蔡炜龙叶国超
楼能,蔡炜龙,叶国超
湖州市中心医院 普外科,浙江 湖州 313000
胃肠道恶性肿瘤在我国发病率高,目前手术仍是治疗胃肠道恶性肿瘤的最主要方式[1]。静脉血栓栓塞症(venous thromboembolism, VTE)包括深静脉血栓形成(deep vein thrombosis, DVT)和肺栓塞(pulmonary embolism, PE),是外科手术术后常见的并发症[2]。VTE一旦发生,不仅会影响患者的生活质量和预后,严重者还会危及生命。目前对术后VTE研究较多的是骨科、妇科等患者,针对胃肠道恶性肿瘤术后VTE的相关研究较少[3-4]。基于此,本研究旨在通过回顾性研究探讨胃肠道恶性肿瘤患者术后VTE的相关危险因素,为术后VTE的预防提供思路。
1 对象和方法
1.1 研究对象 回顾性收集2017年1月至2020年6月间湖州市中心医院行胃癌或结直肠癌根治术的患者1 262例。纳入标准:①病理学诊断明确为胃癌或结直肠癌且在我院行根治性手术;②术前3 d内在我院行下肢血管彩超;③术后3~5 d行双下肢血管彩超。排除标准:①术前有合并血栓相关合并症;②3个月内有使用影响凝血功能的药物史;③患有凝血功能障碍疾病;④临床病理资料不全。根据纳入及排除标准,最终518例患者纳入本研究,具体见图1。其中胃癌患者235例,结直肠癌患者283例,男349例,女169例,年龄32~87岁,平均(61±5.4)岁。本研究经我院伦理委员会批准。
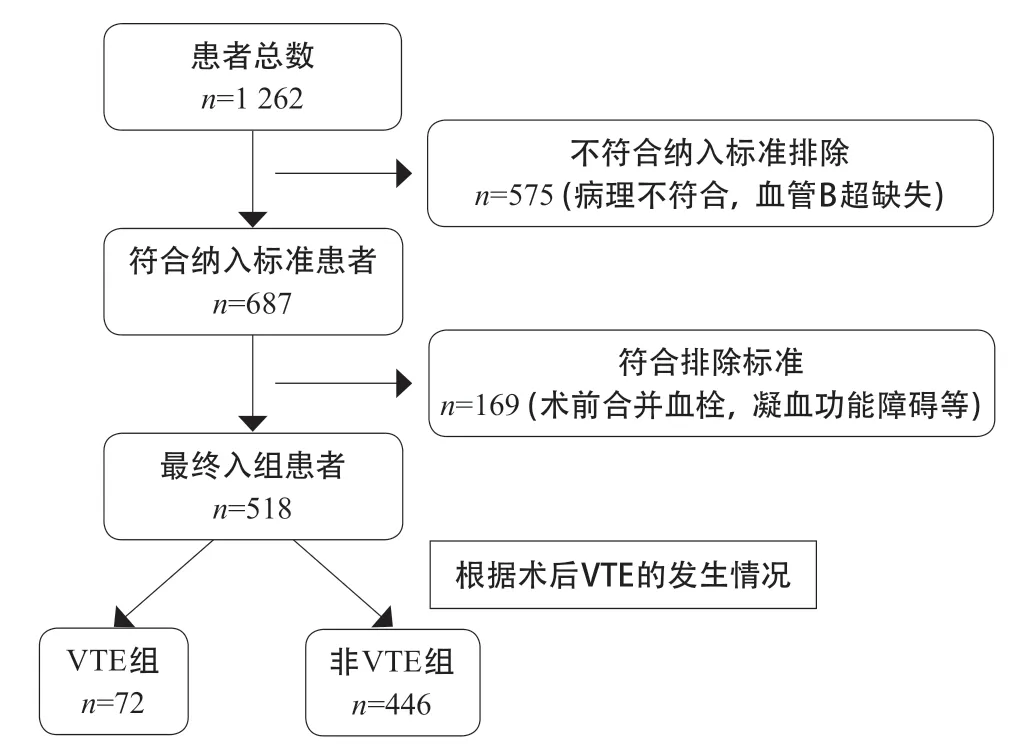
图1 患者入组流程图
1.2 诊断方法 DVT的诊断:所有患者术前3 d内及术后3~5 d常规行双下肢血管多普勒彩色超声筛查下肢DVT。DVT的检查及诊断由2名经验丰富的超声科医师使用彩色多普勒超声仪(线阵式探头,频率5.0~10.0 MHz),通过静脉加压技术和乏式技术共同确认完成,如结果存在分歧,则需由高年资超声医师进一步确认。超声诊断标准(需同时满足以下3条)[5]:①静脉管腔内出现回声不等的实性团块;②管腔内彩色血流信号减少或充盈缺损;③加压后管腔部分塌陷或无塌陷。
PE的诊断:术后患者如有PE相关症状、D二聚体明显升高或发现下肢DVT,排除禁忌后行肺动脉CT造影。PE的检查由1名影像科技师使用多层螺旋CT肺动脉造影完成(32排螺旋CT,管电压100 kV,管电流自动匹配,肘静脉注射碘海醇100 mL,流量4 mL/s,扫描层厚0.5 mm,层间距0.5 mm),由2名影像科医师共同确认完成诊断,如结果存在分歧,则需由高年资影像科医师进一步确认。CT诊断标 准[6]:肺动脉血管出现完全性或者偏心性的充盈缺损影像表现,管径与相邻同级别的通畅肺动脉相比扩张(急性肺动脉栓塞)或缩小(慢性肺动脉栓塞)判为阳性;血管光滑,走形自然,未见到明确的充盈缺损影为阴性。
1.3 研究方法 通过医院信息管理系统及调阅病历收集资料,包括①术前资料:患者的性别、年龄、吸烟史、身体质量指数(body mass index, BMI)、高血压病史、糖尿病史、心肺系统合并症、化疗史、血红蛋白、血小板计数、D二聚体、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、凝血酶原时间(thromboplastin time,PT)、甘油三酯、胆固醇;②术中资料:是否腔镜手术、手术持续时间(指麻醉开始到患者苏醒时间)、手术中是否输血;③术后资料:病理类型、病理分期、D二聚体、是否药物预防、是否机械预防、VTE类型等资料。以上术前血液生化指标取自入院前后2 d内化验结果,术后血液生化指标取自术后第1天化验结果,均为本院测得。根据术后住院期间是否发生VTE分为VTE组和非VTE组。
1.4 统计学处理方法 采用SPSS22.0进行统计学分析,计量资料符合正态分布的以表示,两组间比较使用独立样本t检验,不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验;计数资料用频数表示,组间比较分析采用χ2检验;多因素分析采用二元Logistic回归分析。P<0.05表示差异有统计学意义。
2 结果
2.1 VTE的发生情况 共有72例患者术后发生VTE,发生率为13.90%。其中发生PE 19例(3.67%,其中10例合并DVT),6例(1.16%)为肺动脉主干栓塞,13例(2.51%)为肺动脉分支栓塞;发生DVT 53例(10.23%),46例(8.87%)为下肢肌间静脉血栓,5例(0.97%)为下肢深静脉血栓,2例(0.39%)为肠系膜深静脉血栓。
2.2 2组间基线资料及胃肠道恶性肿瘤术后VTE的单因素分析 通过单因素分析发现,VTE组患者术后D二聚体水平、糖尿病和术前化疗比例高于非VTE组,肿瘤分期晚(III/IV期)比例高于非VTE组,而围手术期的药物预防及机械预防比例低于非VTE组患者,差异有统计学意义(P<0.05),见表1。

表1 胃肠道恶性肿瘤术后VTE组、非VTE组的临床和实验室指标比较
2.3 胃肠道恶性肿瘤术后VTE的二元Logistic回归分析 将胃肠道肿瘤患者术后是否发生VTE作为因变量,把单因素分析中潜在相关因素作为自变量(P<0.1),以α入=0.05,α出=0.10的水准进行多元线性回归分析。同时对自变量进行多重共线性检验,本研究发现各自变量容忍度(TOL)在0.92~0.99,均大于0.1,方差膨胀因子(VIF)在1.01~1.09,均小于10.0,因此可认为各自变量间不存在多重共线性问题。通过二元Logistic回归分析发现,老龄(≥65岁)、肿瘤分期晚(III/IV期)、术后高D二聚体(≥ 5 mg/mL)是胃肠道恶性肿瘤患者术后VTE的独立危险因素,而围手术期药物预防和机械预防是保护因素,可以降低术后VTE的发生率。见表2。
3 讨论
本研究72例VTE患者中有46例为下肢肌间静脉血栓,占比为63.89%,与郜永顺等[7]研究结果一致,提示下肢肌间静脉血栓是VTE中最常见的类型。下肢肌间静脉血栓指分布于小腿肌肉静脉丛的血栓,多见于比目鱼肌和腓肠肌[8]。由于肌间静脉血栓发生通常无明显临床症状,因此容易被忽略,绝大多数都是通过下肢血管彩超检查发现[9]。虽然,本研究中合并DVT的PE患者中肌间静脉血栓的比例较低,仅有4例,但由于下肢肌间静脉血栓可向上蔓延形成下肢近端深静脉血栓,后者引起PE的概率会显著升高。因此,针对下肢肌间静脉血栓的预防同样不可忽视。
目前已有较多血栓预测模型应用于临床,其中应有较广泛的是Caprini评分、Padua评分等量 表[10-11]。但这些量表较为粗泛,对于专科血栓形成相关的因素涵盖不全,缺乏针对性。FERNADES 等[12]的研究显示,不同恶性肿瘤的VTE发生率有所差异,其中血液系统肿瘤、肺癌、胰腺癌、胃癌、肠癌的发生率较高,而乳腺癌和前列腺癌VTE的发生率较低。具体原因未明确,推断可能与不同肿瘤细胞所分泌的促凝及促血小板聚集因子之间的差异有关。通过文献回顾,本研究将胃肠道恶性肿瘤患者术后VTE可能的相关因素纳入分析[13-15],最终发现老龄(≥65岁)、肿瘤分期晚、术后高D二聚体(≥ 5 mg/mL)、术后无血栓预防措施为术后VTE的独立危险因素。
有研究表明,VTE的发生率会随着年龄的增长而升高[7],这与本研究中老龄患者(≥65岁)术后VTE的高发病率结果一致,老龄患者的VTE发生率是其他患者的1.78倍。其中的原因可能是老龄患者一方面基础疾病较多,身体机能下降,恢复速度较年轻患者慢,导致术后卧床时间延长,在原有代谢率就偏低的基础上血流速度进一步减缓;另一方面老年患者静脉瓣膜功能减退,自身血管壁弹性差、脆性增加,同时受手术创伤刺激后血管内皮细胞损伤增多,促凝物质释放增多,血液黏稠,这些均与术后VTE形成密切相关[16-17]。
根据国外大数据研究[12]显示所有VTE患者中约有20%合并恶性肿瘤,恶性肿瘤患者的VTE发生率明显高于非肿瘤患者。研究认为恶性肿瘤与血栓形成的3个关键要素均相关,包括:血液瘀滞、血管内皮细胞损伤以及血液高凝状态。与接受相同类型手术的非癌症患者相比,癌症患者的术后VTE的风险至少增加2倍[18]。本研究虽然没有涉及非肿瘤患者对比,但发现肿瘤分期与术后VTE的发生密切相关,与I/II期肿瘤患者相比,III/IV期患者的术后VTE风险提高近一倍(OR=1.960)。可能的原因是进展期肿瘤患者相比早期患者循环肿瘤负荷更重,肿瘤相关的促凝物质和细胞因子的释放增加,肿瘤细胞与宿主单核/巨噬细胞、血小板及血管内皮细胞黏附增加,这些均会导致血液的高凝状态。此外,进展期恶性肿瘤患者年龄相对偏大,肿瘤治疗带来的创伤更大、恢复更慢,这些均会导致更高的VTE风险[19]。
D二聚体是交联纤维蛋白在纤溶系统作用下产生的可溶性降解产物,为特异性继发性纤溶标志物。D二聚体升高往往提示体内存在高凝状态和继发性维蛋白溶解亢进。由于D二聚体敏感性较高,因此,当体内血栓形成时大部分患者血清D二聚体浓度会升高[20]。但是D二聚体的特异性不高,已有研究[21]证实恶性肿瘤及手术创伤也会导致D二聚体升高,因此胃肠道恶性肿瘤术后患者的血清D二聚体往往会高于普通患者,这也解释了本研究中患者为何术前D二聚体会略高于正常参考范围。此时,如果使用临床上常用的参考值作为血清D二聚体异常的指标具有局限性。本研究选取5 mg/mL作为截断值发现D二聚体对于VTE的形成具有较高的预测效能。研究中发现,与低水平D二聚体患者相比,当术后D二聚体≥5 mg/mL,发生VTE的风险升高近2倍。因此,虽然不能将术后D二聚体作为VTE的独立诊断依据,但可以作为术后VTE形成的重要预测指标。
有些因素虽然在其他研究中被认为与术后VTE相关,比如BMI、吸烟史、血脂、心肺系统疾病、手术持续时间、手术方式等[1,7],但是在本研究中,其VTE的发生率差异无统计学意义。糖尿病患者和有术前化疗史的患者VTE发生率相对较高,在单因素分析中差异有统计学意义,但在多因素Logistic回归分析中作为混杂因素被剔除。据推断由于糖尿病患者的年龄偏大,而存在术前化疗史的患者肿瘤分期较晚,因此,这两者的预测效能可能被年龄和肿瘤分期所掩盖。所以,后续随着样本量的增加也许能够得到更多有价值的研究结果。
根据普外科围手术期VTE指南推荐[22],早期预防是防治术后VTE的关键。国内外相关研究[23-24]显示,腹部手术患者在无任何血栓预防措施的情况下VTE的发生率可达20%以上。本研究的总体VTE的发生率为13.90%,无血栓干预的VTE发生率为19.50%。本研究结果证实围手术期的药物和机械预防均可以有效降低术后VTE的发生率。药物预防指围手术期给予低剂量的低分子肝素预防性抗凝治疗,机械预防通常指使用压力梯度弹力袜和间歇性压力泵治疗。鉴于胃肠道肿瘤患者的术后VTE风险普遍较高,根据研究结果可考虑将术后机械预防可作为常规预防手段,而药物预防实施与否需由临床医师综合评估患者的出血及血栓风险后决定。
本研究存在一些局限性。首先,作为一个单中心回顾性研究,部分信息难以追溯,对自变量的选择缺乏全面性;其次,由于肺动脉CT造影不是常规筛查,因此难免会遗漏部分隐匿性的PE,导致PE发生率较实际发生率偏低;最后,由于样本量偏小,选择偏倚难以完全避免,虽然胃癌和结直肠癌有一定的相似性,但是单独分析会使得结论更加科学、严谨。
综上所述,胃肠道恶性肿瘤患者术后的VTE发生率高,老龄(≥65 岁)、肿瘤分期晚(III/IV期)、术后高D二聚体(≥5 mg/mL)是术后VTE的高危因素,而围手术期的机械预防和药物预防是术后VTE的保护因素。针对高危因素及时准确地筛选出VTE高危患者,尽早进行围手术期干预可以有效降低术后VTE的发生率,从而达到改善患者预后的目的。
